 |
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ –≤
–±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є
–Т –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —А–∞–±–Њ—В–µ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є–є —З–∞—Б—В–Њ –њ—А–Є—Е–Њ–і–Є—В—Б—П –њ—А–Є–±–µ–≥–∞—В—М –Ї –Ј–∞—А–∞–ґ–µ–љ–Є—О —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е, –Є–ї–Є –Њ–њ—Л—В–љ—Л—Е, –ґ–Є–≤–Њ—В–љ—Л—Е. –І–∞—Й–µ –≤—Б–µ–≥–Њ –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–Љ–µ–љ—П—О—В –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –Љ–µ–ї–Ї–Є—Е, –љ–∞–Є–±–Њ–ї–µ–µ –і–µ—И–µ–≤—Л—Е, –ґ–Є–≤–Њ—В–љ—Л—Е: –±–µ–ї—Л—Е –Љ—Л—И–µ–є –Є –Ї—А—Л—Б, –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї, –Ї—А–Њ–ї–Є–Ї–Њ–≤, –∞ –Є–Ј –њ—В–Є—Ж-–≥–Њ–ї—Г–±–µ–є –Є –Ї—Г—А. –†–µ–ґ–µ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —Б–Њ–±–∞–Ї –Є –Ї–Њ—И–µ–Ї, –µ—Й–µ —А–µ–ґ–µ вАФ —А–∞–Ј–ї–Є—З–љ—Л–µ –≤–Є–і—Л —Б–µ–ї—М—Б–Ї–Њ—Е–Њ–Ј—П–є—Б—В–≤–µ–љ–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е. –¶–µ–ї—М –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –њ–∞—В–Њ–≥–µ–љ–љ–Њ—Б—В–Є –Є–ї–Є —Б—В–µ–њ–µ–љ–Є –≤–Є—А—Г–ї–µ–љ—В–љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –≤—Л–і–µ–ї–µ–љ–Є–Є –Є–Ј –Љ–∞—В–µ—А–Є–∞–ї–∞ —З–Є—Б—В—Л—Е –Ї—Г–ї—М—В—Г—А –Љ–Є–Ї—А–Њ–±–Њ–≤, –Њ—В–і–µ–ї–µ–љ–Є–Є –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ –Є–Ј —Б–Љ–µ—Б–Є —Б —Б–∞–њ—А–Њ—Д–Є—В–љ—Л–Љ–Є –≤–Є–і–∞–Љ–Є –Є —В. –і. –®–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –љ–∞—Е–Њ–і—П—В –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ –Є –≤ —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ: –Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є вАФ –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞, –Ї—А–Њ–ї–Є–Ї–Є (–Њ–≤—Ж—Л, —В–µ–ї—П—В–∞) вАФ –њ—А–Є –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–Є–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –∞–≥–≥–ї—О—В–Є–љ–Є—А—Г—О—Й–Є—Е —Б—Л–≤–Њ—А–Њ—В–Њ–Ї, –≥–µ–Љ–Њ–ї–Є–Ј–Є–љ–∞, —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Є —В. –њ. –Ф–ї—П –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –њ–Є—В–∞—В–µ–ї—М¬≠–љ—Л—Е —Б—А–µ–і –Њ—В –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ–ї—Г—З–∞—О—В –Ї—А–Њ–≤—М, —Б—Л–≤–Њ—А–Њ—В–Ї—Г, —А–∞–Ј–ї–Є—З–љ—Л–µ –Њ—А–≥–∞–љ—Л, —В–Ї–∞–љ–Є –Є —В. –і. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –Ї–∞—З–µ—Б—В–≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –љ–∞—Г—З–љ–Њ-—Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є —А–∞–±–Њ—В–µ. –Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ —Б–ї—Г–ґ–∞—В —В–∞–Ї¬≠–ґ–µ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Њ—Б—В—А—Л—Е –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Є–љ¬≠—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –≤–Є—А—Г–ї–µ–љ—В–љ–Њ—Б—В–Є –Є —В–Њ–Ї—Б–Є–≥–µ–љ–љ–Њ—Б—В–Є –Є–Ј—Г—З–∞–µ–Љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –Љ–Є–Ї—А–Њ–±–Њ–≤, –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –∞–Ї—В–Є–≤¬≠–љ–Њ—Б—В–Є –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л—Е –≤–∞–Ї—Ж–Є–љ –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Е –љ–∞ –±–µ–Ј–≤—А–µ–і¬≠–љ–Њ—Б—В—М.
–С–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –і–ї—П –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є —А–∞–±–Њ—В—Л –Њ–±—Л—З–љ–Њ —А–∞–Ј–≤–Њ–і—П—В –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –Њ—А–≥–∞–љ–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –њ–Є—В–Њ–Љ–љ–Є–Ї–∞—Е. –≠—В–Њ –і–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤—Б–µ–≥–і–∞ –њ–Њ–ї—Г—З–∞—В—М –≤ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ—А–Њ–≤–µ—А–µ–љ–љ—Л–є –Є –±–µ–Ј—Г–њ—А–µ—З–љ–Њ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞ –њ–Њ–і–Њ–њ—Л—В–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї. –Х—Б–ї–Є –ґ–Є–≤–Њ—В–љ—Л–µ –љ–µ —А–∞–Ј–≤–Њ–і—П—В—Б—П, –∞ —В–Њ–ї—М–Ї–Њ —Б–Њ–і–µ—А–ґ–∞—В—Б—П –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є, —В–Њ –њ–Њ–Љ–µ—Й–µ–љ–Є–µ –і–ї—П –љ–Є—Е –љ–Њ—Б–Є—В –љ–∞–Ј–≤–∞–љ–Є–µ вАУ –≤–Є–≤–∞—А–Є–є. –Э–Њ–≤—Л–µ –њ–∞—А—В–Є–Є –ґ–Є–≤–Њ—В–љ—Л—Е –Ј–∞–Ї—Г–њ–∞—О—В—Б—П –≤ –њ–Є—В–Њ–Љ–љ–Є–Ї–∞—Е. –£—Б–ї–Њ–≤–Є—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є –Ї–Њ—А–Љ–ї–µ–љ–Є—П –≤ –і–∞–љ–љ—Л—Е –њ–Њ–і—А–∞–Ј–і–µ–ї–µ–љ–Є—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л, –њ–Њ—Н—В–Њ–Љ—Г –≤ –љ–Є–ґ–µ –њ—А–Є–≤–µ–і–µ–љ–љ–Њ–Љ –Љ–∞—В–µ—А–Є–∞–ї–µ –љ–µ –±—Г–і–µ—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Љ–µ–ґ–і—Г —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ–Є —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є.
–Ъ—А–∞—В–Ї–Є–µ —Б–≤–µ–і–µ–љ–Є—П –Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є, —А–∞–Ј–≤–µ–і–µ–љ–Є–Є, –Ї–Њ—А–Љ–ї–µ–љ–Є–Є –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
–°–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –њ–Є—В–Њ–Љ–љ–Є–Ї–∞—Е –і–Њ–ї–ґ–љ–Њ –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞—В—М —Г—Б–ї–Њ–≤–Є—П–Љ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є—П –Є—Е –≤ –њ—А–Є—А–Њ–і–µ. –≠—В–Њ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –і–Є–Ї–Є–Љ, —А–Њ–і–Є–≤—И–Є–Љ—Б—П –љ–∞ –≤–Њ–ї–µ –ґ–Є–≤–Њ—В–љ—Л–Љ –Є –њ—В–Є—Ж–∞–Љ (–і–Є–Ї–Є–µ –≥–Њ–ї—Г–±–Є, –≤–Њ—А–Њ–±—М–Є, –і–Њ–Љ–∞—И–љ–Є–µ —Б–µ—А—Л–µ –Љ—Л—И–Є –Є –Ї—А—Л—Б—Л). –Т –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –і–ї—П –љ–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Є –Ї–Њ—А–Љ–ї–µ–љ–Є—П —Н—В–Є –ґ–Є–≤–Њ—В–љ—Л–µ –±—Л—Б—В—А–Њ –њ–Њ–≥–Є–±–∞—О—В –≤ –љ–µ–≤–Њ–ї–µ (–Њ—Б–Њ–±–µ–љ–љ–Њ –≤–Њ—А–Њ–±—М–Є –Є —Б–µ—А—Л–µ –Љ—Л—И–Є). –Ю–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ —Г—Б–њ–µ—И–љ–Њ–є —А–∞–±–Њ—В—Л –њ–Є—В–Њ–Љ–љ–Є–Ї–∞ —П–≤–ї—П–µ—В—Б—П —Б—В—А–Њ–≥–Њ–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ –≤—Б–µ—Е –≤–µ—В–µ—А–Є–љ–∞—А–љ–Њ-—Б–∞–љ–Є—В–∞—А–љ—Л—Е, –Ј–Њ–Њ—В–µ—Е–љ–Є—З–µ—Б–Ї–Є—Е –Є –Ј–Њ–Њ–≥–Є–≥–Є–µ–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–∞–≤–Є–ї. –Я–Њ—Б–ї–µ–і–љ–Є–µ –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—О—В —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –њ—А–Њ—Б—В–Њ—А–љ—Л—Е, —Б–≤–µ—В–ї—Л—Е, —Б—Г—Е–Є—Е –Є —З–Є—Б—В—Л—Е –Ї–ї–µ—В–Ї–∞—Е, –≤ —Е–Њ—А–Њ—И–Њ –≤–µ–љ—В–Є–ї–Є—А—Г–µ–Љ—Л—Е, —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г¬≠—А–Њ–є –њ–Њ–Љ–µ—Й–µ–љ–Є—П—Е, —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–µ –Є –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–µ –Ї–Њ—А–Љ–ї–µ–љ–Є–µ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ¬≠—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –≤ —Ж–µ–ї—П—Е –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ¬≠–≤–∞–љ–Є–є. –У—А–Њ–Љ–∞–і–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –і–ї—П –њ–Є—В–Њ–Љ–љ–Є–Ї–∞ –Є–Љ–µ–µ—В —Е–Њ—А–Њ—И–Є–є —Б–Њ—Б—В–∞–≤ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї–µ–є (—Б–∞–Љ—Ж–Њ–≤ –Є —Б–∞–Љ–Њ–Ї).
–Я–Є—В–Њ–Љ–љ–Є–Ї (–≤–Є–≤–∞—А–Є–є) –і–Њ–ї–ґ–µ–љ –Є–Љ–µ—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ—В–і–µ–ї–µ–љ–Є–є –і–ї—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–Њ–≤ –ґ–Є–≤–Њ—В–љ—Л—Е (–Ї—А–Њ–ї–Є–Ї–Є, –Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є, –Љ—Л—И–Є –Є —В. –і.).
–Т —Б—В—А—Г–Ї—В—Г—А—Г –≤–Є–≤–∞—А–Є—П –≤—Е–Њ–і—П—В:
1. –Њ—В–і–µ–ї–µ–љ–Є–µ –і–ї—П –Ї–∞—А–∞–љ—В–Є–љ–Є—А–Њ–≤–∞–љ–Є—П –Є –∞–і–∞–њ—В–∞—Ж–Є–Є –≤–љ–Њ–≤—М –њ–Њ—Б—В—Г–њ–Є–≤—И–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е;
2. —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–ї–Є–љ–Є–Ї–∞ –і–ї—П —Б–Њ–і–µ—А¬≠–ґ–∞–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –Њ–њ—Л—В–µ;
3. –Є–Ј–Њ–ї—П—В–Њ—А—Л –і–ї—П –њ–Њ–і–Њ–Ј—А–Є—В–µ–ї—М–љ—Л—Е –љ–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Ј–∞–≤–µ–і–Њ–Љ–Њ –±–Њ–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, —Г–љ–Є—З—В–Њ–ґ–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –њ–Њ —Г—Б–ї–Њ–≤–Є—П–Љ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ–Њ;
4.—Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –њ–Њ–Љ–µ—Й–µ–љ–Є–µ (–Є–ї–Є –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є–Њ–љ–љ–∞—П), –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—В—Б—П –≤–Ј–≤–µ—И–Є–≤–∞–љ–Є–µ, —В–µ—А–Љ–Њ–Љ–µ—В—А–Є—П, –Ј–∞—А–∞–ґ–µ–љ–Є–µ, –≤–∞–Ї—Ж–Є–љ–∞—Ж–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е, –≤–Ј—П—В–Є–µ —Г –љ–Є—Е –Ї—А–Њ–≤–Є –Є –љ–µ¬≠–Ї–Њ—В–Њ—А—Л–µ –і—А—Г–≥–Є–µ –њ—А–Њ—Ж–µ–і—Г—А—Л.
–Ю–±–Њ—А—Г–і–Њ–≤–∞–љ–Є–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –њ–Њ–Љ–µ—Й–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ –Ї–∞–ґ–і–Њ–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Ј–∞–і–∞—З–∞–Љ–Є –Є —Г—Б–ї–Њ–≤–Є—П–Љ–Є –њ—А–Њ–≤–Њ–і–Є–Љ—Л—Е –љ–∞—Г—З–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ъ–∞—А–∞–љ—В–Є–љ–љ–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ, –Њ—В–і–µ–ї–µ–љ–Є–µ –і–ї—П –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –Є –Є–Ј–Њ¬≠–ї—П—В–Њ—А –і–ї—П –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е —А–∞–Ј–Љ–µ—Й–∞—О—В—Б—П –≤ –њ–Њ–Љ–µ¬≠—Й–µ–љ–Є—П—Е, —Б—В—А–Њ–≥–Њ –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л—Е –Њ–і–љ–Њ –Њ—В –і—А—Г–≥–Њ–≥–Њ –Є –Њ—В –≤—Б–µ—Е –Њ—Б—В–∞–ї—М–љ—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є–є –≤–Є–≤–∞—А–Є—П.
–Ъ—А–Њ–Љ–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤—Л—И–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –µ–і–Є¬≠–љ–Є—Ж, –≤ —Б–Њ—Б—В–∞–≤–µ –≤–Є–≤–∞—А–Є—П –і–Њ–ї–ґ–љ—Л –љ–∞—Е–Њ–і–Є—В—М—Б—П:
–∞) –Ї–Њ—А–Љ–Њ–Ї—Г—Е¬≠–љ—П –Є–Ј –і–≤—Г—Е —Б–Љ–µ–ґ–љ—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є–є –і–ї—П –њ–µ—А–µ—А–∞–±–Њ—В–Ї–Є –Є –Є–Ј–≥–Њ¬≠—В–Њ–≤–ї–µ–љ–Є—П –Ї–Њ—А–Љ–Њ–≤ —Б —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л–Љ–Є –≤—Л—Е–Њ–і–∞–Љ–Є –≤ –Ї–Њ—А–Є–і–Њ—А –Є–Ј –Ї–∞–ґ–і–Њ–≥–Њ –њ–Њ–Љ–µ—Й–µ–љ–Є—П, –Ї–ї–∞–і–Њ–≤–∞—П —Б–Њ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ¬≠–љ—Л–Љ–Є –ї–∞—А—П–Љ–Є (–Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–Љ–Є –Є–ї–Є –Њ–±–Є—В—Л–Љ–Є –≤–љ—Г—В—А–Є –ґ–µ—Б—В—М—О) –Є —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї–∞–Љ–Є –і–ї—П —Е—А–∞–љ–µ–љ–Є—П –Ј–∞–њ–∞—Б–∞ –Ї–Њ—А–Љ–Њ–≤,
–±) –і–µ–Ј–Є–љ—Д–µ–Ї¬≠—Ж–Є–Њ–љ–љ–Њ-–Љ–Њ–µ—З–љ–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ –Є–Ј 2 –Ї–Њ–Љ–љ–∞—В, –Њ–±—К–µ–і–Є–љ–µ–љ–љ—Л—Е –њ–µ—А–µ¬≠—Е–Њ–і–љ—Л–Љ –∞–≤—В–Њ–Ї–ї–∞–≤–Њ–Љ –Є–ї–Є —Б—Г—Е–Њ–ґ–∞—А–Њ–≤–Њ–є –Ї–∞–Љ–µ—А–Њ–є.
–†–∞–±–Њ—В–∞ –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–Љ–Њ–µ—З–љ–Њ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Љ–∞—В–µ—А–Є–∞–ї–∞, –њ–Њ—Б—В—Г–њ–∞—О—Й–µ–≥–Њ –љ–∞ –Њ–±—А–∞–±–Њ—В–Ї—Г. –Ш–љ—Д–Є¬≠—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї, –љ–∞–њ—А–Є–Љ–µ—А –Ї–ї–µ—В–Ї–Є, –њ–Њ–і—Б—В–Є–ї–Ї–Є, –Ї–Њ—А¬≠–Љ—Г—И–Ї–Є, –≤–љ–∞—З–∞–ї–µ –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—В, –∞ –Ј–∞—В–µ–Љ –њ–Њ–і–≤–µ—А–≥–∞—О—В –Љ–µ—Е–∞–љ–Є¬≠—З–µ—Б–Ї–Њ–є —З–Є—Б—В–Ї–µ –Є –Љ–Њ–є–Ї–µ. –Ь–∞—В–µ—А–Є–∞–ї, –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–є –Њ–њ–∞—Б¬≠–љ–Њ—Б—В–Є –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П, –≤–љ–∞—З–∞–ї–µ –њ–Њ–і–ї–µ–ґ–Є—В –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є –Њ—З–Є—Б—В¬≠–Ї–µ, –∞ –Ј–∞—В–µ–Љ (–њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є) —Б—В–µ—А–Є–ї–Є–Ј–∞—Ж–Є–Є.
–Ь–Њ–µ—З–љ–Њ–µ –њ–Њ–Љ–µ—Й–µ–љ–Є–µ –≤ –њ—А–∞–≤–Є–ї—М–љ–Њ –Њ—А–≥–∞–љ–Є–Ј–Њ–≤–∞–љ–љ–Њ–Љ –≤–Є–≤–∞—А–Є–Є –Є–Љ–µ–µ—В –Љ—Г—Б–Њ—А–Њ–њ—А–Њ–≤–Њ–і –і–ї—П —Г–і–∞–ї–µ–љ–Є—П –љ–µ—З–Є—Б—В–Њ—В –Є –≥—А—Г–Ј–Њ–њ–Њ–і—К¬≠–µ–Љ–љ–Є–Ї –і–ї—П –і–Њ—Б—В–∞–≤–Ї–Є –≤ –≤–Є–≤–∞—А–Є–є –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є—П.
–†—П–і–Њ–Љ —Б –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–Љ–Њ–µ—З–љ—Л–Љ –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ —А–∞–Ј–Љ–µ—Й–∞—О—В—Б—П —Б–Ї–ї–∞–і —З–Є—Б—В–Њ–≥–Њ (–Ј–∞–њ–∞—Б–љ–Њ–≥–Њ) –Є–љ–≤–µ–љ—В–∞—А—П —Б –Ї–ї–µ—В–Ї–∞–Љ–Є, –њ–Њ–Є–ї¬≠–Ї–∞–Љ–Є, –Ї–Њ—А–Љ—Г—И–Ї–∞–Љ–Є –Є —В. –њ., –±—Л—В–Њ–≤—Л–µ –њ–Њ–Љ–µ—Й–µ–љ–Є—П –Є —Б–∞–љ–Є—В–∞—А–љ—Л–є –±–ї–Њ–Ї (–і—Г—И–µ–≤–∞—П –Є —В—Г–∞–ї–µ—В) –і–ї—П –Њ–±—Б–ї—Г–ґ–Є–≤–∞—О—Й–µ–≥–Њ –њ–µ—А—Б–Њ–љ–∞–ї–∞.
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ–Є —Б–∞–љ–Є—В–∞—А–љ—Л–Љ–Є –њ—А–∞–≤–Є–ї–∞¬≠–Љ–Є, –≤–Є–≤–∞—А–Є–є —А–∞–Ј–Љ–µ—Й–∞–µ—В—Б—П –≤ –Њ—В–і–µ–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ–Љ –Ј–і–∞–љ–Є–Є –Є–ї–Є –љ–∞ –≤–µ—А—Е–љ–µ–Љ —Н—В–∞–ґ–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ—А–њ—Г—Б–∞. –Я—А–Є —А–∞–Ј–Љ–µ—Й–µ¬≠–љ–Є–Є –≤–Є–≤–∞—А–Є—П –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–Љ –Ї–Њ—А–њ—Г—Б–µ –Њ–љ –і–Њ–ї–ґ–µ–љ –±—Л—В—М –њ–Њ–ї–љ–Њ¬≠—Б—В—М—О –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ –Њ—В –≤—Б–µ—Е –і—А—Г–≥–Є—Е –њ–Њ–Љ–µ—Й–µ–љ–Є–є.
–Я–Њ–Љ–µ—Й–µ–љ–Є–µ –і–ї—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –і–Њ–ї–ґ–љ–Њ –±—Л—В—М —В–µ–њ–ї—Л–Љ, —Б–≤–µ—В–ї—Л–Љ –Є —Б—Г—Е–Є–Љ —Б —Ж–µ–љ—В—А–∞–ї—М–љ—Л–Љ –Њ—В–Њ–њ–ї–µ–љ–Є–µ–Љ, –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ –Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ—Л–Љ –Њ—Б–≤–µ—Й–µ–љ–Є–µ–Љ, –њ—А–Є–љ—Г¬≠–і–Є—В–µ–ї—М–љ–Њ–є –њ—А–Є—В–Њ—З–љ–Њ-–≤—Л—В—П–ґ–љ–Њ–є –≤–µ–љ—В–Є–ї—П—Ж–Є–µ–є, –њ–Њ–і–≤–Њ–і–Ї–Њ–є –≥–Њ—А—П¬≠—З–µ–є –Є —Е–Њ–ї–Њ–і–љ–Њ–є –≤–Њ–і—Л.
–Я–Њ–ї—Л –≤ –≤–Є–≤–∞—А–Є–Є –і–µ–ї–∞—О—В –Є–Ј –≤–Њ–і–Њ–љ–µ–њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞¬≠–ї–∞, –±–µ–Ј –њ–ї–Є–љ—В—Г—Б–Њ–≤, —Б —Г–Ї–ї–Њ–љ–Њ–Љ –Ї –Њ—В–≤–µ—А—Б—В–Є—П–Љ –Є–ї–Є –ґ–µ–ї–Њ–±–∞–Љ, –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–љ—Л–Љ –Ї –Ї–∞–љ–∞–ї–Є–Ј–∞—Ж–Є–Є. –°—В–µ–љ–Ї–Є –њ–Њ–Ї—А—Л–≤–∞—О—В –≥–ї–∞–Ј—Г—А–Њ–≤–∞–љ–љ–Њ–є –њ–ї–Є—В–Ї–Њ–є, –њ–Њ—В–Њ–ї–Ї–Є –Є –і–≤–µ—А–Є –Њ–Ї—А–∞—И–Є–≤–∞—О—В –Љ–∞—Б–ї—П–љ–Њ–є –Ї—А–∞—Б–Ї–Њ–є.
–Я—А–∞–≤–Є–ї–∞ –њ–Њ–њ–Њ–ї–љ–µ–љ–Є—П –≤–Є–≤–∞—А–Є—П –љ–Њ–≤—Л–Љ–Є –ґ–Є–≤–Њ—В–љ—Л–Љ–Є
–Я–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –≤–Є–≤–∞—А–Є—П –љ–Њ–≤—Л–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –ґ–Є–≤–Њ—В–љ—Л–Љ–Є –њ—А–Њ–≤–Њ–і—П—В –Є–Ј –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Є—В–Њ–Љ–љ–Є–Ї–Њ–≤ –≤ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–µ–љ–Є–Є –≤–µ—В–µ—А–Є–љ–∞—А–љ–Њ–≥–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–∞, —Г–і–Њ—Б—В–Њ–≤–µ—А—П—О—Й–µ–≥–Њ, —З—В–Њ –ґ–Є–≤–Њ—В–љ—Л–µ –њ–Њ—Б—В—Г–њ–∞—О—В –Є–Ј —Е–Њ–Ј—П–є—Б—В–≤–∞, –±–ї–∞–≥–Њ–њ–Њ–ї—Г—З–љ–Њ–≥–Њ –њ–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ, –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–і–Њ—А–Њ–≤—Л. –Ц–Є–≤–Њ—В–љ—Л—Е –њ—А–Є–љ–Є–Љ–∞—О—В –≤ —З–Є—Б—В—Л–µ, –Ј–∞—А–∞–љ–µ–µ –њ—А–Њ–і–µ–Ј–Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є, —А–∞–Ј–Љ–µ—Й–∞—О—В –≤ –Ї–∞—А–∞–љ—В–Є–љ–љ–Њ–Љ –Њ—В–і–µ–ї–µ–љ–Є–Є —Б—А–Њ–Ї–Њ–Љ –љ–∞ 3 –і–љ—П –і–ї—П –∞–і–∞–њ—В–∞—Ж–Є–Є –Ї –љ–Њ–≤—Л–Љ —Г—Б–ї–Њ–≤–Є—П–Љ. –Т –њ–µ—А–Є–Њ–і –Ї–∞—А–∞–љ—В–Є–љ–∞ –Ј–∞ –ґ–Є–≤–Њ—В–љ—Л–Љ–Є –≤–µ–і–µ—В—Б—П —А–µ–≥—Г–ї—П—А–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ —Б –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є —В–µ—А–Љ–Њ–Љ–µ—В—А–Є–µ–є –Є —А–µ–≥–Є—Б—В—А–∞—Ж–Є–µ–є –Њ–±—Й–µ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–Љ –ґ—Г—А–љ–∞–ї–µ –њ–Њ –њ—А–Є–≤–Њ–і–Є–Љ–Њ–є –љ–Є–ґ–µ —Д–Њ—А–Љ–µ.
–Ґ–∞–±–ї–Є—Ж–∞ 1.
–Ц—Г—А–љ–∞–ї —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П –Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ-–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Ї–ї–Є–љ–Є–Ї–µ (–≤–Є–≤–∞—А–Є–Є)
| –Ф–∞—В–∞ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П
| –Т–Є–і –ґ–Є–≤–Њ—В–љ—Л—Е
| –Я–Њ–ї
| –Ь–∞—Б—Б–∞ —В–µ–ї–∞,
–≤–Њ–Ј—А–∞—Б—В
| –Я–Њ—Б—В–∞–≤-
—Й–Є–Ї
| –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ (No –Ї–ї–µ—В–Ї–Є)
| –Э–∞–±–ї—О–і–µ–љ–Є–µ
–≤–Њ –≤—А–µ–Љ—П –Ї–∞—А–∞–љ—В–Є–љ–∞
| –Ф–∞—В–∞ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї–∞—А–∞–љ—В–Є–љ–∞
| –Ъ–Њ–Љ—Г –≤—Л–і–∞–љ—Л
–ґ–Є–≤–Њ—В–љ—Л–µ
|
|
|
|
|
|
|
|
|
|
–Ф–ї—П –ґ–Є–≤–Њ—В–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –љ–µ –Є–Ј –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ–Є—В–Њ–Љ–љ–Є–Ї–Њ–≤, —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ —Б—А–Њ–Ї–Є –Ї–∞—А–∞–љ—В–Є–љ–Є—А–Њ–≤–∞–љ–Є—П: –і–ї—П –Љ—Л—И–µ–є –Є –Ї—А—Л—БвАФ14 –і–љ–µ–є, –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –Є –Ї—А–Њ–ї–Є–Ї–Њ–≤вАФ21 –і–µ–љ—М.
–Т —Ж–µ–ї—П—Е –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Ј–∞–љ–Њ—Б–∞ –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –≤–Є–≤–∞—А–Є–Є —Г—Е–Њ–і –Є –љ–∞–±–ї—О–і–µ–љ–Є–µ –Ј–∞ –ґ–Є–≤–Њ—В–љ—Л–Љ–Є, –љ–∞—Е–Њ–і—П—Й–Є–Љ–Є—Б—П –≤ –Ї–∞—А–∞–љ—В–Є–љ–µ, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—В—Б—П –њ–µ—А—Б–Њ–љ–∞–ї–Њ–Љ, –Ј–∞–Ї—А–µ–њ–ї–µ–љ–љ—Л–Љ –Ј–∞ –і–∞–љ–љ—Л–Љ –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ. –Я–Њ —Н—В–Є–Љ –ґ–µ —Б–Њ–Њ–±—А–∞–ґ–µ–љ–Є—П–Љ –Ј–∞–њ—А–µ—Й–∞–µ—В—Б—П –≤—Л–љ–Њ—Б–Є—В—М –Є–Ј –Ї–∞—А–∞–љ—В–Є–љ–љ–Њ–≥–Њ –Њ—В–і–µ–ї–µ–љ–Є—П –≤ –і—А—Г–≥–Є–µ –њ–Њ–Љ–µ—Й–µ–љ–Є—П –≤–Є–≤–∞—А–Є—П –Ї–Њ—А–Љ–∞, —Б–њ–µ—Ж–Њ–і–µ–ґ–і—Г –Є –Є–љ–≤–µ–љ—В–∞—А—М.
–І–Є—Б—В–Ї–∞ –Є –Љ–Њ–є–Ї–∞ –њ–Њ—Б—Г–і—Л, –Ї–ї–µ—В–Њ–Ї –Є –і—А—Г–≥–Њ–≥–Њ –Є–љ–≤–µ–љ—В–∞—А—П –Є–Ј –Ї–∞—А–∞–љ—В–Є–љ–љ–Њ–≥–Њ –њ–Њ–Љ–µ—Й–µ–љ–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –≤ –Њ–±—Й–µ–Љ –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–Љ–Њ–µ—З–љ–Њ–Љ –Њ—В–і–µ–ї–µ–љ–Є–Є –≤–Є–≤–∞—А–Є—П —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±–µ–Ј–Ј–∞—А–∞–ґ–Є–≤–∞–љ–Є—П. –Ь–µ—В–Њ–і—Л –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Є –≤ –Ї–∞–ґ–і–Њ–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ —Б–ї—Г—З–∞–µ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ —Б–њ–µ—Ж–Є—Д–Є–Ї–µ —А–∞–±–Њ—В—Л —Г—З—А–µ–ґ–і–µ–љ–Є—П.
–Т —Б–ї—Г—З–∞–µ –њ–Њ—П–≤–ї–µ–љ–Є—П –≤ –Ї–∞—А–∞–љ—В–Є–љ–љ–Њ–Љ –Њ—В–і–µ–ї–µ–љ–Є–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є—П –љ–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л–µ –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—О. –Я—А–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Є –≤—Б—П –њ–Њ—Б—В—Г–њ–Є–≤—И–∞—П –њ–∞—А—В–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е —Г–љ–Є—З—В–Њ–ґ–∞–µ—В—Б—П.
–Я—А–Є –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –Љ–∞—Б—Б–Њ–≤—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Б—А–µ–і–Є –ґ–Є–≤–Њ—В–љ—Л—Е, –љ–∞—Е–Њ–і—П—Й–Є—Е—Б—П –≤ –Ї–∞—А–∞–љ—В–Є–љ–µ, –Є–ї–Є –њ—А–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–Є –≤ –њ–µ—А–Є–Њ–і —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –Њ—В–і–µ–ї—М–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Њ—Б–Њ–±–Њ –Њ–њ–∞—Б–љ—Л—Е –і–ї—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –≤ –≤–Є¬≠–≤–∞—А–Є–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є. –Т —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Њ–њ—Л—В—Л –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –≤—А–µ–Љ–µ–љ–љ–Њ –њ—А–µ–Ї—А–∞—Й–∞—О—В—Б—П.
–Я—А–∞–≤–Є–ї–∞ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –≤–Є–≤–∞—А–Є–Є
–Я–Њ –Є—Б—В–µ—З–µ–љ–Є–Є –Ї–∞—А–∞–љ—В–Є–љ–љ–Њ–≥–Њ —Б—А–Њ–Ї–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –њ–µ—А–µ–≤–Њ–і—П—В –≤ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Г—О —Б–µ–Ї—Ж–Є—О. –Ь—Л—И–µ–є, –Ї—А—Л—Б, –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –Є –Ї—А–Њ–ї–Є–Ї–Њ–≤ —Б–Њ–і–µ—А–ґ–∞—В –≤ –Ї–ї–µ—В–Ї–∞—Е, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л—Е –љ–∞ –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є—Е —Б—В–µ–ї–ї–∞–ґ–∞—Е. –У—А—Л–Ј—Г–љ—Л —Б–Њ–і–µ—А–ґ–∞—В—Б—П –≤ –Ї–ї–µ—В–Ї–∞—Е —Б–Њ —Б–њ–ї–Њ—И–љ—Л–Љ –і–љ–Њ–Љ –љ–∞ –њ–Њ–і—Б—В–Є–ї–Ї–µ –Є–ї–Є —Б —Б–µ—В—З–∞—В—Л–Љ –і–љ–Њ–Љ-–њ–Њ–ї–Њ–Љ. –Я–Њ–і—Б—В–Є–ї–Њ—З–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –і—А–µ–≤–µ—Б–љ—Л–µ –Њ–њ–Є–ї–Ї–Є, —Б—В—А—Г–ґ–Ї–∞, –≤–Њ–ї–Њ–Ї–љ–Є—Б—В—Л–є —В–Њ—А—Д, –Љ—П–≥–Ї–∞—П —Б–Њ–ї–Њ–Љ–∞. –Я–Њ–і—Б—В–Є–ї–Ї–Є –Ј–∞—А–∞–љ–µ–µ –∞–≤—В–Њ–Ї–ї–∞–≤–Є—А—Г—О—В –Є–ї–Є –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—В –≤ —Б—Г—Е–Њ–ґ–∞—А–Њ–≤–Њ–є –њ–µ—З–Є –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 150вАФ180¬∞–° –≤ —В–µ—З–µ–љ–Є–µ 15вАФ20 –Љ–Є–љ. –Я—А–Є —А–∞–Ј–Љ–µ—Й–µ–љ–Є–Є –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ –Ї–ї–µ—В–Ї–∞–Љ —Б–ї–µ–і—Г–µ—В –Є—Б—Е–Њ–і–Є—В—М –Є–Ј –њ—А–Є–≤–Њ–і–Є–Љ—Л—Е –љ–Є–ґ–µ –љ–Њ—А–Љ–∞—В–Є–≤–Њ–≤ (—В–∞–±–ї. 2).
–Я—А–Є–Љ–µ—З–∞–љ–Є–µ. –Ф–ї—П –њ—А–Є–Љ–µ—А–љ–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ–Њ–є –њ–ї–Њ—Й–∞–і–Є —Б–ї–µ–і—Г–µ—В –Є—Б—Е–Њ–і–Є—В—М –Є–Ј —А–∞—Б—З–µ—В–∞, —З—В–Њ 1 —Б–Љ –њ–ї–Њ—Й–∞–і–Є –і–љ–∞ –Ї–ї–µ—В–Ї–Є –і–Њ–ї–ґ–µ–љ –њ—А–Є—Е–Њ–і–Є—В—М—Б—П –љ–∞ 1 –≥ –Љ–∞—Б—Б—Л –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –°—В–µ–ї–ї–∞–ґ–Є —А–∞–Ј–Љ–µ—Й–∞—О—В—Б—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≤–і–Њ–ї—М —Б—В–µ–љ –Є –і–Њ–ї–ґ–љ—Л –Ј–∞–љ–Є–Љ–∞—В—М –њ—А–Є–Љ–µ—А–љ–Њ 0,4 –Љ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ–Њ–є –њ–ї–Њ—Й–∞–і–Є.
–Т –Ї–∞–ґ–і–Њ–Љ –Њ—В–і–µ–ї—М–љ–Њ–Љ –њ–Њ–Љ–µ—Й–µ–љ–Є–Є –≤–Є–≤–∞—А–Є—П —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —Б–Њ–і–µ—А–ґ–∞—В—М —В–Њ–ї—М–Ї–Њ –Њ–і–Є–љ –≤–Є–і –ґ–Є–≤–Њ—В–љ—Л—Е. –Х—Б–ї–Є –њ–Њ —Г—Б–ї–Њ–≤–Є—П–Љ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞ –≤ –Њ–і–љ–Њ–є —Б–µ–Ї—Ж–Є–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б–Њ–і–µ—А–ґ–∞—В—Б—П –ґ–Є–≤–Њ—В–љ—Л–µ —А–∞–Ј–љ—Л—Е –≤–Є–і–Њ–≤, —А–∞–Ј–Љ–µ—Й–∞—В—М –Є—Е —Б–ї–µ–і—Г–µ—В –љ–∞ —А–∞–Ј–љ—Л—Е —Б—В–µ–ї–ї–∞–ґ–∞—Е. –Э–∞ –Ї–∞–ґ–і–Њ–є –Ї–ї–µ—В–Ї–µ —Б –ґ–Є–≤–Њ—В–љ—Л–Љ–Є –≤—Л–≤–µ—И–Є–≤–∞—О—В –њ–∞—Б–њ–Њ—А—В–∞, –Њ–±—А–∞–Ј–µ—Ж –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–Є–≤–Њ–і–Є—В—Б—П –љ–Є–ґ–µ.
–Ґ–∞–±–ї–Є—Ж–∞ 2.
–Э–Њ—А–Љ—Л –њ–ї–Њ—Й–∞–і–Є –і–ї—П —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
| –Т–Є–і
–ґ–Є–≤–Њ—В–љ—Л—Е
| –Ь–Є–љ–Є–Љ–∞–ї—М–љ–∞—П –њ–ї–Њ—Й–∞–і—М –і–љ–∞ –Ї–ї–µ—В–Ї–Є –љ–∞ –Њ–і–љ–Њ –ґ–Є–≤–Њ—В–љ–Њ–µ, —Б–Љ2
| –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –і–Њ–њ—Г—Б—В–Є–Љ–Њ–µ —З–Є—Б–ї–Њ –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –Ї–ї–µ—В–Ї–µ
| –І–Є—Б–ї–Њ –ґ–Є–≤–Њ—В–љ—Л—Е –љ–∞ 1 –Љ2 –њ–ї–Њ—Й–∞–і–Є –њ–Њ–ї–∞ –њ–Њ–Љ–µ—Й–µ–љ–Є—П (–≤–Ј—А–Њ—Б–ї—Л—Е / –Љ–Њ–ї–Њ–і–љ—П–Ї–∞)
| –Ь—Л—И–Є
| 40
| 15
| 65 / 240
| –Ъ—А—Л—Б—Л
| 150
| 10
| 20 / 100
| –Ь–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є
| 300
| 5
| 15вАФ18
| –Ъ—А–Њ–ї–Є–Ї–Є
| 2000
| 1
| 3вАФ4
|
–Э–∞ –Ї–ї–µ—В–Ї–∞—Е –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В —П–≤–Є—В—М—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –Ј–∞—А–∞–ґ–µ–љ–Є—П —З–µ–ї–Њ–≤–µ–Ї–∞, —Г–Ї—А–µ–њ–ї—П—О—В –њ–∞—Б–њ–Њ—А—В–∞ —П—А–Ї–Њ–≥–Њ —Ж–≤–µ—В–∞. –Ц–Є–≤–Њ—В–љ—Л–µ, –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л–µ –≤ —Б–Љ—Л—Б–ї–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Ј–∞—А–∞–ґ–µ–љ–Є—П –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е, —Б–Њ–і–µ—А–ґ–∞—В—Б—П –≤ –Є–Ј–Њ–ї—П—В–Њ—А–µ –≤ –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є—Е –Ї–ї–µ—В–Ї–∞—Е –Є–ї–Є —Б—В–µ–Ї–ї—П–љ–љ—Л—Е –±–∞–љ–Ї–∞—Е –≤ –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–є –Њ–њ—А–∞–≤–µ.
–Ю—В–і–µ–ї–µ–љ–Є–µ (–ї–∞–±–Њ—А–∞—В–Њ¬≠—А–Є—П)
|
| –Ъ–ї–µ—В–Ї–∞ вДЦ
|
| –Т–Є–і, –ї–Є–љ–Є—П, –њ–Њ–ї –ґ–Є–≤–Њ—В–љ—Л—Е
|
| –Т–Њ–Ј—А–∞—Б—В –Ф–∞—В–∞ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є—П
|
| (—Д–∞–Љ–Є–ї–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—В–Њ—А–∞)
|
| –Э–∞—З–∞–ї–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞
|
| –Ю–Ї–Њ–љ—З–∞–љ–Є–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞
|
| –Ю—Б–Њ–±—Л–µ –Њ—В–Љ–µ—В–Ї–Є
|
|
–†–Є—Б. –Ю–±—А–∞–Ј–µ—Ж —Н—В–Є–Ї–µ—В–Ї–Є (–њ–∞—Б–њ–Њ—А—В–∞)
–Я—А–Є —Г—Е–Њ–і–µ –Ј–∞ –ґ–Є–≤–Њ—В–љ—Л–Љ–Є, –Ј–∞—А–∞–ґ–µ–љ–љ—Л–Љ–Є –Њ—Б–Њ–±–Њ –Њ–њ–∞—Б–љ—Л–Љ–Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є, –њ–µ—А—Б–Њ–љ–∞–ї –і–Њ–ї–ґ–µ–љ –љ–∞–і–µ–≤–∞—В—М –і–≤–∞ —Е–∞–ї–∞—В–∞, —А–µ–Ј–Є–љ–Њ–≤—Л–є —Д–∞—А—В—Г–Ї, –љ–∞—А—Г–Ї–∞–≤–љ–Є–Ї–Є, —А–µ–Ј–Є–љ–Њ–≤—Л–µ –њ–µ—А—З–∞—В–Ї–Є, –Љ–∞—Б–Ї—Г –Є –≥–∞–ї–Њ—И–Є.
–Т –Ј–∞—А–∞–Ј–љ–Њ–µ –њ–Њ–Љ–µ—Й–µ–љ–Є–µ —А–∞–Ј—А–µ—И–∞–µ—В—Б—П –≤—Е–Њ–і–Є—В—М —В–Њ–ї—М–Ї–Њ —А–∞–±–Њ—З–Є–Љ, –Њ–±—Б–ї—Г–ґ–Є–≤–∞—О—Й–Є–Љ –ґ–Є–≤–Њ—В–љ—Л—Е, –Є –љ–∞—Г—З–љ–Њ-—В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ —Б–Њ—В—А—Г–і–љ–Є–Ї–∞–Љ, —Г—З–∞—Б—В–≤—Г—О—Й–Є–Љ –≤ –Њ–њ—Л—В–µ.
–Ґ—А—Г–њ—Л –ґ–Є–≤–Њ—В–љ—Л—Е, –њ–Њ–≥–Є–±—И–Є—Е –≤ —Е–Њ–і–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞, –і–Њ –≤—Б–Ї—А—Л—В–Є—П —Е—А–∞–љ—П—В—Б—П –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–Љ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї–µ (–љ–µ –±–Њ–ї–µ–µ —Б—Г—В–Њ–Ї). –Т—Б–Ї—А—Л—В–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—В–Њ—А–Њ–Љ. –Т —Б–ї—Г—З–∞–µ –≥–Є–±–µ–ї–Є –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Њ–њ—Л—В–∞ –љ–∞ –≤—Б–Ї—А—Л—В–Є–Є –њ—А–Є—Б—Г—В—Б—В–≤—Г–µ—В –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М –≤–Є–≤–∞—А–Є—П. –Ъ–∞–ґ–і—Л–є —Б–ї—Г—З–∞–є –њ–∞–і–µ–ґ–∞ –Є–ї–Є –≤—Л–љ—Г–ґ–і–µ–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ—П –ґ–Є–≤–Њ—В–љ—Л—Е —Д–Є–Ї—Б–Є—А—Г–µ—В—Б—П –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–Љ –ґ—Г—А–љ–∞–ї–µ –њ–Њ –њ—А–Є–≤–Њ–і–Є–Љ–Њ–є –љ–Є–ґ–µ —Д–Њ—А–Љ–µ.–Ґ–∞–±–ї–Є—Ж–∞ 3.
–Ґ–∞–±–ї–Є—Ж–∞ 3.
–Ц—Г—А–љ–∞–ї —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Є –њ–∞–≤—И–Є—Е –Є–ї–Є –≤—Л–љ—Г–ґ–і–µ–љ–љ–Њ –Ј–∞–±–Є—В—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
| –Ф–∞—В–∞
| –Т–Є–і
–ґ–Є–≤–Њ—В–љ—Л—Е
| –°–µ–Ї—Ж–Є—П
–ґ–Є–≤–Њ—В–љ—Л—Е
| –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–є –і–Є–∞–≥–љ–Њ–Ј
| –†–µ–Ј—Г–ї—М—В–∞—В –≤—Б–Ї—А—Л—В–Є—П
| –Ъ—В–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї –≤—Б–Ї—А—Л—В–Є–µ
| –†–µ–Ј—Г–ї—М—В–∞—В
—Н–Ї—Б–њ–µ—А—В–Є–Ј—Л
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–Я–Њ—Б–ї–µ –≤—Б–Ї—А—Л—В–Є—П —В—А—Г–њ—Л –Ј–∞—А–∞–Ј–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е —Б–ґ–Є–≥–∞—О—В –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ–≥–Њ –ї–Є—Ж–∞, –≤—Л–і–µ–ї–µ–љ–љ–Њ–≥–Њ –∞–і–Љ–Є–љ–Є—Б—В—А–∞—Ж–Є–µ–є, —В—А—Г–њ—Л –љ–µ–Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е —Б–і–∞—О—В —Г—В–Є–ї—М–Ј–∞–≤–Њ–і—Г –≤ –≤–Њ–і–Њ–љ–µ–њ—А–Њ–љ–Є—Ж–∞–µ–Љ—Л—Е –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є—Е —П—Й–Є–Ї–∞—Е —Б –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –Њ—Д–Њ—А–Љ–ї–µ–љ–Є–µ–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –і–Њ–Ї—Г–Љ–µ–љ—В–∞—Ж–Є–Є.
–†–∞–±–Њ—В–∞ –њ–Њ —Г—Е–Њ–і—Г –Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е —Б—В—А–Њ–Є—В—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–∞—Б–њ–Њ—А—П–і–Ї–Њ–Љ –і–љ—П –Є —А–µ–≥–ї–∞–Љ–µ–љ—В–Њ–Љ —А–∞–±–Њ—В—Л, —Г—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ —А—Г–Ї–Њ–≤–Њ–і–Є—В–µ–ї–µ–Љ —Г—З—А–µ–ґ–і–µ–љ–Є—П. –Т —А–∞—Б–њ–Њ—А—П–і–Ї–µ –і–љ—П –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤—А–µ–Љ—П –љ–∞ —Б–∞–љ–Є—В–∞—А–љ—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г –њ–Њ–Љ–µ—Й–µ–љ–Є—П –Є –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є—П, —А–∞–Ј–і–∞—З—Г –Ї–Њ—А–Љ–Њ–≤ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —А–∞–±–Њ—В –Є –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є–є.
–Ъ–ї–µ—В–Ї–Є –і–ї—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ –і–µ–ї–∞—О—В –Њ–±—Л—З–љ–Њ –і–µ—А–µ–≤—П–љ–љ—Л–Љ–Є, –і–ї–Є–љ–Њ–є 75 —Б–Љ, —И–Є—А–Є–љ–Њ–є 45-50 —Б–Љ –Є –≤—Л—Б–Њ—В–Њ–є 50-55 —Б–Љ, —Б —А–µ—И–µ—В—З–∞—В—Л–Љ –њ–Њ–ї–Њ–Љ, –њ–Њ–і –Ї–Њ—В–Њ—А—Л–Љ –і–Њ–ї–ґ–µ–љ –±—Л—В—М –ґ–µ–ї–µ–Ј–љ—Л–є –њ—А–Є–µ–Љ–љ–Є–Ї (–њ—А–Њ—В–Є–≤–µ–љ—М). –Я–µ—А–µ–і–љ—О—О —Б—В–µ–љ–Ї—Г –Ї–ї–µ—В–Ї–Є –Њ–±–Є–≤–∞—О—В –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Њ–є —Б–µ—В–Ї–Њ–є —Б –і–Є–∞–Љ–µ—В—А–Њ–Љ —П—З–µ–µ–Ї –≤ 2вАФ3 —Б–Љ.
–Ъ–ї–µ—В–Ї–Є –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї —В–∞–Ї–Є–µ –ґ–µ, –Ї–∞–Ї –Є –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤, –љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ–љ—М—И–Є—Е —А–∞–Ј–Љ–µ—А–Њ–≤ (65—Е55—Е40 —Б–Љ). –Т –Ї–ї–µ—В–Ї–∞—Е –Њ–і–љ–Њ—П—А—Г—Б–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –Њ–±–Є–≤–∞—О—В —Б–µ—В–Ї–Њ–є —Б–љ–Є–Љ–∞—О—Й–Є–є—Б—П –≤–µ—А—Е –Ї–ї–µ—В–Ї–Є, –∞ –њ—А–Є –і–≤—Г—Е—К—П—А—Г—Б–љ–Њ–ЉвАФ–Њ–і–љ—Г –Є–Ј –±–Њ–Ї–Њ–≤—Л—Е —Б—В–µ–љ–Њ–Ї.
–Ъ–ї–µ—В–Ї–Є –і–ї—П –±–µ–ї—Л—Е –Љ—Л—И–µ–є –і–µ–ї–∞—О—В –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–Љ–Є, —А–∞–Ј–Љ–µ—А–Њ–Љ 50—Е40—Е30 —Б–Љ, –≤—Б—В–∞–≤–ї—П–µ–Љ—Л–Љ–Є –≤ –њ—А–Њ—В–Є–≤–µ–љ—М, –љ–∞ –і–љ–Њ –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–∞—Б—Л–њ–∞—О—В –Љ–µ–ї–Ї–Є–є, —Б—Г—Е–Њ–є —В–Њ—А—Д –Є–ї–Є –Њ–њ–Є–ї–Ї–Є. –°—В–µ–љ–Ї–Є —В–∞–Ї–Њ–є –Ї–ї–µ—В–Ї–ЄвАФ–њ–µ—А–µ–і–љ—О—О (–і–≤–µ—А–Ї–∞), –Њ–і–љ—Г –±–Њ–Ї–Њ–≤—Г—О, –≤–µ—А—Е–љ—О—О –Є –і–љ–Њ –Њ–±—В—П–≥–Є–≤–∞—О—В –Љ–µ–ї–Ї–Њ–є —Б–µ—В–Ї–Њ–є. –Т–љ—Г—В—А–Є –Ї–ї–µ—В–Ї–Є –њ–Њ–Љ–µ—Й–∞–µ—В—Б—П —Б–µ—В—З–∞—В–Њ–µ –≥–љ–µ–Ј–і–Њ. –Я—А–Є –Њ—З–Є—Б—В–Ї–µ –Ї–ї–µ—В–Ї—Г –њ–Њ–і–љ–Є–Љ–∞—О—В, –Є –≤—Б–µ –љ–µ—З–Є—Б—В–Њ—В—Л —З–µ—А–µ–Ј —Б–µ—В–Ї—Г –њ–Њ–њ–∞–і–∞—О—В –≤ –њ—А–Њ—В–Є–≤–µ–љ—М. –Ф–ї—П –Љ—Л—И–µ–є –Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –і–µ—А–µ–≤—П–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є —В–Њ–≥–Њ –ґ–µ —А–∞–Ј–Љ–µ—А–∞, —З—В–Њ –Є –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–µ, —Б —Б–µ—В—З–∞—В—Л–Љ–Є –њ–µ—А–µ–і–љ–µ–є (–і–≤–µ—А–Ї–∞) –Є –≤–µ—А—Е–љ–µ–є —Б—В–µ–љ–Ї–∞–Љ–Є.
–С–µ–ї—Л—Е –Љ—Л—И–µ–є –њ–Њ–Љ–µ—Й–∞—О—В –≤ –Ї–ї–µ—В–Ї–Є –≥—А—Г–њ–њ–∞–Љ–Є, –Є–Ј —А–∞—Б—З–µ—В–∞ 6-8 —Б–∞–Љ–Њ–Ї –Є 1 —Б–∞–Љ–µ—Ж, –∞ –і–ї—П –Ї—А—Л—БвАФ2-4 —Б–∞–Љ–Ї–Є –Є 1 —Б–∞–Љ–µ—Ж –≤ –Ї–∞–ґ–і–Њ–є. –Ъ–ї–µ—В–Ї–Є –і–Њ–ї–ґ–љ—Л –Є–Љ–µ—В—М –Ј–∞—В–µ–Љ–љ–µ–љ–љ–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ –і–ї—П —Г—Б—В—А–Њ–є—Б—В–≤–∞ –≥–љ–µ–Ј–і–∞ –Є –Њ—В–і—Л—Е–∞ –±–µ–ї—Л—Е –Љ—Л—И–µ–є –Є –Ї—А—Л—Б.
–Ъ–ї–µ—В–Ї–Є —А–∞—Б–њ–Њ–ї–∞–≥–∞—О—В –љ–∞ —Б—В–µ–ї–ї–∞–ґ–∞—Е, —А—П–і–∞–Љ–Є, –≤ –Њ–і–Є–љ –Є–ї–Є 2вАФ3 —П—А—Г—Б–∞, –љ–∞ —А–∞—Б—Б—В–Њ—П–љ–Є–Є 40вАФ50 —Б–Љ –Њ—В –њ–Њ–ї–∞ –Є —Б—В–µ–љ –≤ —Ж–µ–ї—П—Е –Ј–∞—Й–Є—В—Л –ґ–Є–≤–Њ—В–љ—Л—Е –Њ—В –і–Є–Ї–Є—Е –≥—А—Л–Ј—Г–љ–Њ–≤ (–Ї—А—Л—Б, —Е–Њ—А—М–Ї–Њ–≤). –Ъ–ї–µ—В–Ї–Є –љ—Г–ґ–љ–Њ —А–µ–≥—Г–ї—П—А–љ–Њ, –љ–µ —А–µ–ґ–µ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ —В—А–Є –і–љ—П, –Њ—З–Є—Й–∞—В—М –Є –Љ—Л—В—М –≥–Њ—А—П—З–µ–є –≤–Њ–і–Њ–є. –Я–Њ—Б–ї–µ —В–∞–Ї–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –Ї–ї–µ—В–Ї–Є –≤—Л—Б—Г—И–Є–≤–∞—О—В –Њ–≥–љ–µ–Љ –њ–∞—П–ї—М–љ–Њ–є –ї–∞–Љ–њ—Л, –∞ –≤ –ї–µ—В–љ–µ–µ –≤—А–µ–Љ—ПвАФ–љ–∞ —Б–Њ–ї–љ—Ж–µ. –Т —Б—Л—А—Л–µ –Ї–ї–µ—В–Ї–Є –њ–Њ–Љ–µ—Й–∞—В—М –ґ–Є–≤–Њ—В–љ—Л—Е –љ–µ–ї—М–Ј—П. –Э–µ—З–Є—Б—В–Њ—В—Л –Є–Ј –њ–Є—В–Њ–Љ–љ–Є–Ї–∞ —Б–ї–µ–і—Г–µ—В —Г–і–∞–ї—П—В—М –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ –њ–Њ—Б–ї–µ —Г–±–Њ—А–Ї–Є –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–µ –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –Љ–µ—Б—В–Њ. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –Њ–±—Й–Є–µ —Б–≤–µ–і–µ–љ–Є—П –Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Љ—Л –њ—А–Є–≤–Њ–і–Є–Љ –≤ –≤–Є–і–µ —В–∞–±–ї–Є—Ж—Л 4.
–Ґ–∞–±–ї–Є—Ж–∞ 4,
–Ю–±—Й–Є–µ —Б–≤–µ–і–µ–љ–Є—П –Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
| –°–Њ–±–∞–Ї–∞
| –Ъ–Њ—И–Ї–∞
| –Ъ—А–Њ–ї–Є–Ї
| –Ь–Њ—А—Б–Ї. —Б–≤–Є–љ–Ї–∞
| –Ъ—А—Л—Б–∞
| –Ь—Л—И—М
| –Ъ—Г—А–Є—Ж–∞
| –У–Њ–ї—Г–±—М
| –Ы—П–≥—Г—И–Ї–∞
| –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М¬≠–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є
(–≤ –≥–Њ–і–∞—Е)
| 15-20
| 10-12
| 4-9
| 6-8
| 2-2,5
| 1,5-2
| 10-14
| 10
| 6-7
| –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –±–µ—А–µ–Љ–µ–љ¬≠–љ–Њ—Б—В–Є (–≤ –і–љ—П—Е)
| 60-63
| 56
| 30
| 60-68
| 20-30
| 20-25
| 21
| 18
|
| –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –і–µ—В–µ–љ—Л—И–µ–є
| 1-10
| 3-6
| 3-5-15
| 1-6
| 5-9
| 5-9
|
|
|
| –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–Њ¬≠–Љ–µ—В–Њ–≤ –≤ –≥–Њ–і
| 2
| 2-3
| 3-5
| 3-5
| 4-7
| 4-7
|
|
|
| –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М¬≠–љ–Њ—Б—В—М –ї–∞–Ї—В–∞¬≠—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–µ¬≠—А–Є–Њ–і–∞ —Г —Б–∞¬≠–Љ–Њ–Ї (–≤ –і–љ—П—Е)
| 30-40
| 30-40
| 30-50
| 30
| 30
| 25-35
|
|
|
| –Т—А–µ–Љ—П —Г–і–≤–Њ–µ¬≠–љ–Є—П –≤–µ—Б–∞ —В–µ¬≠–ї–∞ –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е (–≤ –і–љ—П—Е)
| 8
| 9
| 6
| 12
|
|
|
|
|
| –Т—А–µ–Љ—П –Њ—В–і–µ–ї–µ¬≠–љ–Є—П –Њ—В –Љ–∞—В–µ¬≠—А–Є –і–µ—В–µ–љ—Л¬≠—И–µ–є (–≤ –љ–µ–і–µ–ї—П—Е)
| 6-8
| 8
| 6-8
| 3-5
| 2,5-3
| 3-4
|
|
|
| –Ґ–Њ –ґ–µ, —Б–∞–Љ—Ж–Њ–≤ –Њ—В —Б–∞–Љ–Њ–Ї (–≤ –Љ–µ—Б—П—Ж–∞—Е)
|
|
| 4
| 2
| 1-1,5
| 1-1,5
|
|
|
| –°–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Ї–Њ¬≠–ї-–≤–∞ —Б–∞–Љ¬≠—Ж–Њ–≤ –Є —Б–∞–Љ–Њ–Ї –≤ –њ–Є—В–Њ–Љ–љ–Є–Ї–µ
|
|
| 1:10-12
| 1:5-10
| 1:1-4
| 1:5-8
|
|
|
| –Т–Њ–Ј—А–∞—Б—В –њ–µ—А–≤–Њ–є —Б–ї—Г—З–Ї–Є (–≤ –Љ–µ—Б—П—Ж–∞—Е)
| 12
| 6-8
| 6-10
| 4-6
| 3,5-4
| 2,5-3
|
|
|
| –Я—А–µ–і–µ–ї –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б–∞–Љ—Ж–Њ–≤ (–≤ –≥–Њ–і–∞—Е)
|
|
| 2-2,5
| 2,5-3
| 1-2
| 1-1,5
|
|
|
| –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞
| 37,5-39°
| 38-39°
| 38,5-39,5°
| 38-39°
| 38,5-39,3°
| 37-39°
| 40,5-42°
| 41-43°
|
| –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ —Г–і–∞—А–Њ–≤ —Б–µ—А–і—Ж–∞
(–≤ –Љ–Є–љ—Г—В—Г)
| 70-150
| 120-140
| 120-150
| 130-790
|
| 520-780
| 312
| 244
| 35
| –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї—А–Њ–≤–Є
(–Њ—В–љ–Њ—И–µ–љ–Є–µ –Ї –≤–µ—Б—Г —В–µ–ї–∞)
| 1:14,5
| 1:5
| 1:18
| 1:17
| 1:13
|
| 1:11
| 1:10
| 1:15
| –І–Є—Б–ї–Њ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –і–≤–Є–ґ–µ–љ–Є–є
(–≤ –Љ–Є–љ—Г—В—Г)
| 14-24
| 20-30
| 50-60
| 100-150
| ¬ї30
|
| 40-50
| 50-70
|
|
–£–±–Њ—А–Ї–∞ –Є –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є—П –≤–Є–≤–∞—А–Є—П
–£–±–Њ—А–Ї—Г –≤–Є–≤–∞—А–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ —Г—В—А–µ–љ–љ–Є–µ —З–∞—Б—Л, –њ—А–Є–і–µ—А–ґ–Є–≤–∞—П—Б—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В–Є. –Э–∞—З–Є–љ–∞—О—В —Б –Њ—Б–Љ–Њ—В—А–∞ –ґ–Є–≤–Њ—В–љ—Л—Е, –≤—Л—П–≤–ї—П—П –Ј–∞–±–Њ–ї–µ–≤—И–Є—Е –Є –њ–Њ–≥–Є–±—И–Є—Е. –Ш–Ј –Ї–ї–µ—В–Њ–Ї –≤—Л–љ–Є–Љ–∞—О—В –Ї–Њ—А–Љ—Г—И–Ї–Є –Є –њ–Њ–Є–ї–Ї–Є. –Я–Њ–ї –Ї–∞–ґ–і–Њ–є –Ї–ї–µ—В–Ї–Є —З–Є—Б—В—П—В –≤–µ–љ–Є–Ї–Њ–Љ –Є –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Ї—А–µ–±–Ї–Њ–Љ. –Э–∞—Е–Њ–і—П—Й–Є–µ—Б—П –≤ –Ї–ї–µ—В–Ї–∞—Е –Ї–∞–ї, –Њ—Б—В–∞—В¬≠–Ї–Є –њ–Є—Й–Є —Б–Њ—Б–Ї–∞–±–ї–Є–≤–∞—О—В –≤ —Б–Њ–≤–Њ–Ї, —Б–±—А–∞—Б—Л–≤–∞—О—В –≤ –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–є –±–∞–Ї —Б –њ–ї–Њ—В–љ–Њ –Ј–∞–Ї—А—Л–≤–∞—О—Й–µ–є—Б—П –Ї—А—Л—И–Ї–Њ–є. –Я–Њ—Б–ї–µ —З–Є—Б—В–Ї–Є –Ї–∞–ґ–і–Њ–є –Ї–ї–µ—В–Ї–Є —Б–Ї—А–µ–±–Њ–Ї –Њ–±–µ–Ј–Ј–∞—А–∞–ґ–Є–≤–∞—О—В, –њ–Њ–≥—А—Г–ґ–∞—П –µ–≥–Њ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–Є–љ—Г—В –≤ –±–∞–љ–Ї—Г —Б –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ. –Т—Л–љ—Г—В—Л–µ –Є–Ј –Ї–ї–µ—В–Њ–Ї –Ї–Њ—А–Љ—Г—И–Ї–Є –Є –њ–Њ–Є–ї–Ї–Є –Љ–Њ—О—В –≥–Њ—А—П—З–µ–є –≤–Њ–і–Њ–є —Б –Ј–Њ–ї—М–љ—Л–Љ —Й–µ–ї–Њ–Ї–Њ–Љ –Є–ї–Є —Б–Њ–і–Њ–є, –∞ –Ј–∞—В–µ–Љ –Њ–±–і–∞—О—В –Ї–Є–њ—П—В–Ї–Њ–Љ. –Я–µ—А–µ—Б—В–∞–≤–ї—П—В—М –Ї–Њ—А–Љ—Г—И–Ї–Є –Є –њ–Њ–Є–ї–Ї–Є –Є–Ј –Њ–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є –≤ –і—А—Г–≥—Г—О –љ–µ–ї—М–Ј—П.
–Ю—З–Є—Б—В–Є–≤ –Ї–ї–µ—В–Ї–Є, —Б–ї—Г–ґ–Є—В–µ–ї—М –≤–Є–≤–∞—А–Є—П –њ—А–Є—Б—В—Г–њ–∞–µ—В –Ї —Г–±–Њ—А–Ї–µ –њ–Њ–Љ–µ—Й–µ–љ–Є—П –≤–Є–≤–∞—А–Є—П: –њ—А–Њ—В–Є—А–∞–µ—В –њ–Њ–ї, —Б—В–µ–љ—Л –Є –њ–Њ–і–Њ–Ї–Њ–љ–љ–Є–Ї–Є –≥–Њ—А—П—З–µ–є –≤–Њ–і–Њ–є —Б –Љ—Л–ї—М–љ–Њ-–Ї–∞—А–±–Њ–ї–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ, 1% —А–∞—Б—В–≤–Њ—А–Њ–Љ —Е–ї–Њ—А–∞–Љ–Є–љ–∞ –Є–ї–Є –і—А—Г–≥–Є–Љ –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ.
–Ф–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —З–Є—Б—В–Њ—В—Л –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Ј–∞–љ–Њ—Б–∞ –Є–љ—Д–µ–Ї—Ж–Є–Є —Г –≤—Е–Њ–і–∞ –≤ –Ї–∞–ґ–і—Г—О –Ї–Њ–Љ–љ–∞—В—Г –≤–Є–≤–∞—А–Є—П –Ї–ї–∞–і—Г—В –њ–ї–Њ—В–љ—Г—О –Љ–µ—И–Ї–Њ–≤–Є–љ—Г, –љ–∞—В—П–љ—Г—В—Г—О –љ–∞ –ї–Є—Б—В –ґ–µ–ї–µ–Ј–∞. –Ю–і–Є–љ –Є–ї–Є 2 —А–∞–Ј–∞ –≤ –і–µ–љ—М –Љ–µ—И–Ї–Њ–≤–Є–љ—Г —Б–Љ–∞—З–Є–≤–∞—О—В 3вАФ5% —А–∞—Б—В–≤–Њ—А–Њ–Љ –і–µ–Ј–Є–љ—Д–µ–Ї—В–∞–љ—В–∞.
–†–∞–±–Њ—В—Г, —Б–≤—П–Ј–∞–љ–љ—Г—О —Б —Г–±–Њ—А–Ї–Њ–є –Ї–ї–µ—В–Њ–Ї –Є –њ–Њ–Љ–µ—Й–µ–љ–Є—П, —Б–ї—Г–ґ–Є—В–µ–ї–Є –≤–Є–≤–∞—А–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є –Њ–і–µ–ґ–і–µ: —Е–∞–ї–∞—В–µ, —Д–∞—А—В—Г–Ї–µ, –Ї–Њ—Б—Л–љ–Ї–µ –Є —А–µ–Ј–Є–љ–Њ–≤—Л—Е –њ–µ—А—З–∞—В–Ї–∞—Е.
–Я–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є, –њ—А–Є–Љ–µ—А–љ–Њ –Њ–і–Є–љ —А–∞–Ј –≤ 2 –љ–µ–і, –Ї–ї–µ—В–Ї–Є –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ—О—В –≥–Њ—А—П—З–µ–є –≤–Њ–і–Њ–є –Є –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—В 5% —А–∞—Б—В–≤–Њ—А–Њ–Љ –Ї–∞—А–±–Њ–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–ї–Є –≥–Њ—А—П—З–Є–Љ –Ј–Њ–ї—М–љ—Л–Љ —Й–µ–ї–Њ–Ї–Њ–Љ –Є–ї–Є –њ—А–Њ–ґ–Є–≥–∞—О—В –њ–ї–∞–Љ–µ–љ–µ–Љ –њ–∞—П–ї—М–љ–Њ–є –ї–∞–Љ–њ—Л –≤ —Ж–µ–ї—П—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –њ–∞—А–∞–Ј–Є—В–∞—А–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—П –љ–∞—Б–µ–Ї–Њ–Љ—Л—Е.
–Т –њ–µ—А–Є–Њ–і —В–µ–Ї—Г—Й–µ–є –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Є –ґ–Є–≤–Њ—В–љ—Л—Е –њ–µ—А–µ—Б–∞–ґ–Є–≤–∞—О—В –≤ —З–Є—Б—В—Л–µ, –Ј–∞—А–∞–љ–µ–µ –њ—А–Њ–і–µ–Ј–Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є —Б –њ–Њ–і–≥–Њ¬≠—В–Њ–≤–ї–µ–љ–љ—Л–Љ–Є –њ–Њ–і—Б—В–Є–ї–Ї–∞–Љ–Є, –Ї–Њ—А–Љ—Г—И–Ї–∞–Љ–Є –Є –њ–Њ–Є–ї–Ї–∞–Љ–Є. –Ю—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й–Є–µ—Б—П –њ—А–Є —Н—В–Њ–Љ –Ї–ї–µ—В–Ї–Є –њ–µ—А–µ–і–∞—О—В –і–ї—П –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Є –Є –Њ–±—А–∞–±–Њ—В–Ї–Є –≤ –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–Љ–Њ–µ—З–љ–Њ–µ –Њ—В–і–µ–ї–µ–љ–Є–µ. –І–Є—Б—В–Ї–∞, –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є—П, –Љ–Њ–є–Ї–∞ –Ї–ї–µ—В–Њ–Ї, –Ї–Њ—А–Љ—Г—И–µ–Ї –Є –њ–Њ–Є–ї–Њ–Ї –њ—А–Њ–Є–Ј–≤–Њ–і—П—В—Б—П —А–∞–±–Њ—З–Є–Љ–Є, —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –Ј–∞–Ї—А–µ–њ–ї–µ–љ–љ—Л–Љ–Є –Ј–∞ –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–Љ–Њ–µ—З–љ—Л–Љ –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ.
–Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є —Г–±–Њ—А–Ї–Є –≤–µ—Б—М —Б–Њ–±—А–∞–љ–љ—Л–є –≤ –≤–Є–≤–∞—А–Є–Є –Љ—Г—Б–Њ—А (–Ї–∞–ї, –Њ—Б—В–∞—В–Ї–Є –њ–Є—Й–Є, –Њ–њ–Є–ї–Ї–Є, —Б–µ–љ–Њ, —Б–Њ–ї–Њ–Љ–∞ –Є —В. –і.) —Б–ґ–Є–≥–∞—О—В –Є–ї–Є —Г—В–Є–ї–Є–Ј–Є—А—Г—О—В, —Б–Њ–≥–ї–∞—Б—Г—П —Н—В–Њ—В –≤–Њ–њ—А–Њ—Б –≤ –Ї–∞–ґ–і–Њ–Љ –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ —Б–ї—Г—З–∞–µ —Б –Љ–µ—Б—В–љ—Л–Љ–Є –Њ—А–≥–∞–љ–∞–Љ–Є –Є —Г—З—А–µ–ґ–і–µ–љ–Є—П–Љ–Є –°–≠–Э.
–Я—А–Є —А–∞–±–Њ—В–µ —Б –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ –Њ–±–µ–Ј–Ј–∞—А–∞–ґ–Є–≤–∞–љ–Є–µ –Њ—В—Е–Њ–і–Њ–≤ –∞–≤—В–Њ–Ї–ї–∞–≤–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Є–ї–Є –Њ–±—А–∞–±–Њ—В–Ї–Њ–є –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ–Є –≤–µ—Й–µ—Б—В–≤–∞–Љ–Є. –Я–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤–µ—Б—М —Б–Њ–±—А–∞–љ–љ—Л–є –≤ –≤–Є–≤–∞—А–Є–Є –Љ—Г—Б–Њ—А —Б–ґ–Є–≥–∞—О—В –≤ –њ–µ—З–Є
–Ы–Є—З–љ–∞—П –≥–Є–≥–Є–µ–љ–∞ —А–∞–±–Њ—В–љ–Є–Ї–Њ–≤ –њ–Є—В–Њ–Љ–љ–Є–Ї–∞ (–≤–Є–≤–∞—А–Є—П)
–Ъ–∞–ґ–і—Л–є —А–∞–±–Њ—В–љ–Є–Ї –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В—Б—П –њ–µ—А—Б–Њ–љ–∞–ї—М–љ–Њ–є —Б–њ–µ—Ж. –Њ–і–µ–ґ–і–Њ–є, —Б–њ–µ—Ж. –Њ–±—Г–≤—М—О, –њ–Њ–ї–Њ—В–µ–љ—Ж–µ–Љ, –Љ—Л–ї–Њ–Љ. –Ф–ї—П –Ї–∞–ґ–і–Њ–≥–Њ —Б–Њ—В—А—Г–і–љ–Є–Ї–∞ –і–Њ–ї–ґ–µ–љ –±—Л—В—М –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є —И–Ї–∞—Д —Б –і–≤—Г–Љ—П –Њ—В–і–µ–ї–µ–љ–Є—П–Љ–Є. –Ю–і–љ–Њ –Є–Ј –љ–Є—Е –њ—А–µ–і–љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –і–ї—П —Е—А–∞–љ–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ —А–∞–±–Њ—З–µ–≥–Њ –і–љ—П –і–Њ–Љ–∞—И–љ–µ–є –Њ–і–µ–ґ–і—Л –Є –Њ–±—Г–≤–Є, –Ї–Њ—В–Њ—А—Л–µ —А–∞–±–Њ—В–љ–Є–Ї –≤–Є–≤–∞—А–Є—П –Њ–±—П–Ј–∞–љ —Б–љ–Є–Љ–∞—В—М, –њ—А–Є—Е–Њ–і—П –љ–∞ —А–∞–±–Њ—В—Г; –≤ –і—А—Г–≥–Њ–Љ –Њ—В–і–µ–ї–µ–љ–Є–Є –≤–Њ –≤–љ–µ—А–∞–±–Њ—З–µ–µ –≤—А–µ–Љ—П –љ–∞—Е–Њ–і–Є—В—Б—П —Б–њ–µ—Ж–Њ–і–µ–ґ–і–∞. –Ш–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ —И–Ї–∞—Д—Л –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є, –љ–µ —А–µ–ґ–µ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ –Љ–µ—Б—П—Ж, –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—В—Б—П.
–Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –Ї–∞–ґ–і–Њ–≥–Њ —Н—В–∞–њ–∞ —А–∞–±–Њ—В—Л, –∞ —В–∞–Ї–ґ–µ –њ–µ—А–µ–і –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є —А–∞–±–Њ—В–љ–Є–Ї–Є –≤–Є–≤–∞—А–Є—П –і–Њ–ї–ґ–љ—Л –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –Љ—Л—В—М –Є –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞—В—М —А—Г–Ї–Є. –Ф–ї—П —Н—В–Њ–≥–Њ –≤ –Ї–∞–ґ–і–Њ–є —Б–µ–Ї—Ж–Є–Є –≤–Є–≤–∞¬≠—А–Є—П –Њ–Ї–Њ–ї–Њ —А–∞–Ї–Њ–≤–Є–љ—Л —Г–Љ—Л–≤–∞–ї—М–љ–Є–Ї–∞ –љ–∞ –њ–Њ–ї–Ї–∞—Е –љ–∞—Е–Њ–і—П—В—Б—П –±—Г¬≠—В—Л–ї–Є —Б –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ–Є —А–∞—Б—В–≤–Њ—А–∞–Љ–Є (2% —А–∞—Б—В–≤–Њ—А —Е–ї–Њ—А–∞–Љ–Є–љ–∞). –Я–Њ—Б–ї–µ –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є–Є —А—Г–Ї–Є –њ—А–Њ—В–Є—А–∞—О—В –≤–∞–Ј–µ–ї–Є–љ–Њ–Љ –Є–ї–Є –і–µ—В—Б–Ї–Є–Љ –Ї—А–µ–Љ–Њ–Љ, —З—В–Њ–±—Л –њ—А–µ–і—Г–њ—А–µ–і–Є—В—М –њ–Њ—П–≤–ї–µ–љ–Є–µ —В—А–µ—Й–Є–љ –љ–∞ –Ї–Њ–ґ–µ.
–Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є —А–∞–±–Њ—В—Л –њ–µ—А—Б–Њ–љ–∞–ї –≤–Є–≤–∞—А–Є—П –Њ–±—П–Ј–∞–љ –њ—А–Њ–є—В–Є –Њ–±—А–∞–±–Њ—В–Ї—Г –≤ —Б–∞–љ–Є—В–∞—А–љ–Њ–Љ –±–ї–Њ–Ї–µ (–њ—А–Є–љ—П—В—М –і—Г—И –Є–ї–Є –≤–∞–љ–љ—Г).
–Т—Б–µ –ї–Є—Ж–∞, –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л–µ –љ–∞ —А–∞–±–Њ—В—Г —Б –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –ґ–Є–≤–Њ—В–љ—Л–Љ–Є, –њ—А–Њ—Е–Њ–і—П—В –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–∞ –љ–Њ—Б–Є—В–µ–ї—М—Б—В–≤–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –Є –≤—Б–µ–є –≥—А—Г–њ–њ—Л –Ї–Є—И–µ—З–љ—Л—Е –Є–љ—Д–µ–Ї—Ж–Є–є. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і—П—В—Б—П –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є, –љ–µ —А–µ–ґ–µ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ –≥–Њ–і. –С–Њ–ї—М–љ—Л–µ —В—Г–±–µ—А–Ї—Г–ї–µ–Ј–Њ–Љ, –Ї–Њ–ґ–љ—Л–Љ–Є –Є –і—А—Г–≥–Є–Љ–Є –Ј–∞—А–∞–Ј–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Ї —А–∞–±–Њ—В–µ –≤ –≤–Є–≤–∞—А–Є–Є –љ–µ –і–Њ–њ—Г—Б–Ї–∞—О—В—Б—П. –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ —Б –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П–Љ–Є, –Њ–њ–∞—Б–љ—Л–Љ–Є –і–ї—П –ї—О–і–µ–є, –Њ–±—Б–ї—Г–ґ–Є–≤–∞—О—Й–Є–є –њ–µ—А—Б–Њ–љ–∞–ї –≤–Є–≤–∞—А–Є—П –њ–Њ–і–≤–µ—А–≥–∞–µ—В—Б—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Є–Љ–Љ—Г–љ–Є–Ј–∞—Ж–Є–Є.
–Ф–ї—П –≤—Б–µ—Е –њ—А–Є–љ–Є–Љ–∞–µ–Љ—Л—Е –≤ –≤–Є–≤–∞—А–Є–є —Б–Њ—В—А—Г–і–љ–Є–Ї–Њ–≤ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –Є–љ—Б—В—А—Г–Ї—В–∞–ґ –њ–Њ –≤–Њ–њ—А–Њ—Б–∞–Љ –Њ—Е—А–∞–љ—Л —В—А—Г–і–∞ –Є —В–µ—Е–љ–Є–Ї–Є –±–µ–Ј¬≠–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –њ—А–∞–≤–Є–ї–∞–Љ –≤–љ—Г—В—А–µ–љ–љ–µ–≥–Њ —А–∞—Б–њ–Њ—А—П–і–Ї–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л–њ–Њ–ї–љ—П–µ–Љ–Њ–є —А–∞–±–Њ—В—Л. –Ю—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ—Б—В—М –Ј–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Є–љ—Б—В—А—Г–Ї—В–∞–ґ–∞ –≤–Њ–Ј–ї–∞–≥–∞–µ—В—Б—П –љ–∞ –Ј–∞–≤–µ–і—Г—О—Й–µ–≥–Њ –≤–Є–≤–∞—А–Є–µ–Љ.
–Я—А–∞–≤–Є–ї–∞ –Ї–Њ—А–Љ–ї–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
–Т —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ—А–∞–≤–Є–ї—М–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Є –Ї–Њ—А–Љ–ї–µ–љ–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Ї–∞–Ї –і–Њ, —В–∞–Ї –Є –≤–Њ –≤—А–µ–Љ—П –Њ–њ—Л—В–∞ –Є–Љ–µ–µ—В –Њ—З–µ–љ—М –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ.
–Э–∞—А—Г—И–µ–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –Є —А–∞—Ж–Є–Њ–љ–∞ –њ–Є—В–∞–љ–Є—П, –љ–µ—Б–Њ–±–ї—О–і–µ–љ–Є–µ –≥–Є–≥–Є–µ–љ–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –њ—А–Є –Ї–Њ—А–Љ–ї–µ–љ–Є–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –Њ—Б–ї–∞–±–ї–µ–љ–Є—О –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Є –њ–Њ–≤—Л—И–µ–љ–Є—О –Є—Е –≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤–Њ—Б—В–Є –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ. –Т–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Є—Е –≤ —В–µ—З–µ–љ–Є–µ –Њ–њ—Л—В–∞ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –Є—Б–Ї–∞–ґ–µ–љ–Є—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Ї –љ–µ–њ—А–∞–≤–Є–ї—М–љ—Л–Љ –Ј–∞–Ї–ї—О—З–µ–љ–Є—П–Љ.
–Т –Ї–Њ—А–Љ–Њ–≤–Њ–є —А–∞—Ж–Є–Њ–љ –љ—Г–ґ–љ–Њ –≤–≤–Њ–і–Є—В—М –≤—Б–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –і–ї—П –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –≤–µ—Й–µ—Б—В–≤–∞ (–±–µ–ї–Ї–Є, —Г–≥–ї–µ–≤–Њ–і—Л, –ґ–Є—А—Л –Љ–Є–љ–µ—А–∞–ї—М–љ—Л–µ –≤–µ—Й–µ—Б—В–≤–∞, –≤–Є—В–∞–Љ–Є–љ—Л –Є –≤–Њ–і–∞). –Ш–Ј –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–Њ–≤ –Ї—А–Њ–ї–Є–Ї–Є –Є –Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є –њ–Њ–ї—Г—З–∞—О—В –њ—И–µ–љ–Њ, –Њ–≤–µ—Б, –њ—И–µ–љ–Є—Ж—Г, —П—З–Љ–µ–љ—М, –≥–Њ—А–Њ—Е, —З–µ—З–µ–≤–Є—Ж—Г, –≤–Є–Ї—Г –Ї—Г–Ї—Г—А—Г–Ј—Г. –°—Г—В–Њ—З–љ–∞—П –љ–Њ—А–Љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–Њ–≤: –і–ї—П –≤–Ј—А–Њ—Б–ї—Л—Е –Ї—А–Њ–ї–Є–Ї–Њ–≤вАФ80 –≥, –і–ї—П –Љ–Њ–ї–Њ–і–љ—П–Ї–∞вАФ60 –≥, –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–ЇвАФ20вАФ25 –≥. –Ц–µ–ї–∞—В–µ–ї—М–љ–Њ –і–∞–≤–∞—В—М –≤ —Б—Г—В–Њ—З–љ–Њ–є –љ–Њ—А–Љ–µ –ґ–Є–≤–Њ—В–љ—Л–Љ —Б–Љ–µ—Б—М —Б–µ–Љ—П–љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е (2вАФ3) –Ї—Г–ї—М—В—Г—А. –Ъ—А–Њ–ї–Є–Ї–Њ–≤ –Є —Б–≤–Є–љ–Њ–Ї –Љ–Њ–ґ–љ–Њ –Ї–Њ—А–Љ–Є—В—М –Њ—В—Е–Њ–і–∞–Љ–Є –њ–Є—Й–µ–≤–Њ–є –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ—Б—В–Є (–ї—М–љ—П–љ–Њ–є, –њ–Њ–і—Б–Њ–ї–љ–µ—З–љ—Л–є –Є –Ї–Њ–љ–Њ–њ–ї—П–љ—Л–є –ґ–Љ—Л—Е, –њ—И–µ–љ–Є—З–љ—Л–µ –Њ—В—А—Г–±–Є). –Ц–Љ—Л—Е —Б–Ї–∞—А–Љ–ї–Є–≤–∞—О—В –≤ –Ј–∞–њ–∞—А–µ–љ–љ–Њ–Љ –Є –і—А–Њ–±–ї–µ–љ–Њ–Љ –≤–Є–і–µ, –∞ –Њ—В—А—Г–±–Є —Б –Ї–Њ—А–љ–µ–њ–ї–Њ–і–∞–Љ–Є –Є–ї–Є –ґ–Љ—Л—Е–Њ–Љ. –°—Г—В–Њ—З–љ—Л–µ –љ–Њ—А–Љ—Л –Њ—В—Е–Њ–і–Њ–≤ –Є –Њ—В—А—Г–±–µ–євАФ15-20 –≥ –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є 5-10 –≥ –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї.
–Ш–Ј —Б–Њ—З–љ—Л—Е –Ї–Њ—А–Љ–Њ–≤ –Ї—А–Њ–ї–Є–Ї–∞–Љ –Є —Б–≤–Є–љ–Ї–∞–Љ –і–∞—О—В —Е–Њ—А–Њ—И–Њ –≤—Л–Љ—Л—В—Г—О –Є –љ–∞—А–µ¬≠–Ј–∞–љ–љ—Г—О –ї–Њ–Љ—В–Є–Ї–∞–Љ–Є –Ї—А–∞—Б–љ—Г—О –Љ–Њ—А–Ї–Њ–≤—М (–≤–Є—В–∞–Љ–Є–љ –Р), —А–µ–њ—Г, —Б–≤–µ–Ї–ї—Г, —В—Г—А–љ–µ–њ—Б –Є –±—А—О–Ї–≤—Г. –Т–≤–µ–і–µ–љ–Є–µ –≤ —А–∞—Ж–Є–Њ–љ —Б–Њ—З–љ—Л—Е –Ї–Њ—А–Љ–Њ–≤ –≤ –Њ—Б–µ–љ–љ–µ-–Ј–Є–Љ–љ–Є–є –њ–µ—А–Є–Њ–і –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ. –°—Г—В–Њ—З–љ–∞—П –љ–Њ—А–Љ–∞ –Ї–Њ—А–љ–µ–њ–ї–Њ–і–Њ–≤ –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ 100вАФ120 –≥, –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–ЇвАФ80вАФ100 –≥. –Э–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л–Љ –Ї–Њ—А–Љ–Њ–Љ –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є —Б–≤–Є–љ–Њ–Ї –≤ –ї–µ—В–љ–µ–µ –≤—А–µ–Љ—П —П–≤–ї—П–µ—В—Б—П —Б–≤–µ–ґ–∞—П —В—А–∞–≤–∞ –Є –Њ–≤–Њ—Й–љ–∞—П –Ј–µ–ї–µ–љ—М, –∞ –Ј–Є–Љ–Њ–євАФ–њ—А–Њ—А–∞—Й–µ–љ–љ–Њ–µ –Ј–µ—А–љ–Њ. –Ш–Ј –≥—А—Г–±—Л—Е –Ї–Њ—А–Љ–Њ–≤ –і–∞—О—В —Б–µ–љ–Њ —Е–Њ—А–Њ—И–µ–≥–Њ –Ї–∞—З–µ¬≠—Б—В–≤–∞, –∞ –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ —В–∞–Ї–ґ–µ –і—А–µ–≤–µ—Б–љ—Л–є –Ї–Њ—А–Љ (–≤–µ—В–Ї–Є –ї–Є–њ—Л, –±–µ—А–µ–Ј—Л, –Њ—Б–Є–љ—Л, –Ї–ї–µ–љ–∞, —В–Њ–њ–Њ–ї—П). –Я–Њ—П—В –ґ–Є–≤–Њ—В–љ—Л—Е –љ–∞—В—Г—А–∞–ї—М–љ—Л–Љ (–њ–∞—Б—В–µ—А–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –Є–ї–Є –Ї–Є–њ—П—З–µ–љ—Л–Љ –Є–ї–Є –∞—Ж–Є–і–Њ—Д–Є–ї—М–љ—Л–Љ) –Љ–Њ–ї–Њ–Ї–Њ–Љ –Є —З–Є—Б—В–Њ–є –љ–µ—Е–Њ–ї–Њ–і–љ–Њ–є –≤–Њ–і–Њ–є. –Ъ—А–Њ–ї–Є–Ї–∞–Љ –Љ–Њ–ї–Њ–Ї–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –Љ–Њ–ї–Њ–і–љ—П–Ї–∞, –љ–Њ –Є –і–ї—П –±–µ—А–µ–Љ–µ–љ–љ—Л—Е –Є –Ї–Њ—А–Љ—П—Й–Є—Е —Б–∞–Љ–Њ–Ї.
–С–µ–ї—Л–Љ –Љ—Л—И–∞–Љ –Є –Ї—А—Л—Б–∞–Љ –і–∞—О—В –Њ–≤–µ—Б, –њ—И–µ–љ–Є—Ж—Г, –њ—И–µ–љ–Њ, —П—З–Љ–µ–љ—М, –ї—М–љ—П–љ–Њ–µ, –Ї–Њ–љ–Њ–њ–ї—П–љ–Њ–µ, –њ–Њ–і—Б–Њ–ї–љ–µ—З–љ–Њ–µ —Б–µ–Љ—П. –Т–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –Њ–ґ–Є—А–µ–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е —Б–µ–Љ–µ–љ–∞ –Љ–∞—Б–ї–Є—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А –≤–≤–Њ–і—П—В –≤ —А–∞—Ж–Є–Њ–љ –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е. –°—Г—В–Њ—З–љ–∞—П –љ–Њ—А–Љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–Њ–≤: 3вАФ5 –≥ –і–ї—П –Љ—Л—И–µ–є –Є 12вАФ15 –≥ –і–ї—П –Ї—А—Л—Б. –Т –Ї–Њ—А–Љ –Є–і—Г—В —В–∞–Ї–ґ–µ –њ—И–µ–љ–Є—З–љ—Л–є —Е–ї–µ–± (–Ї–Є—Б–ї—Л–є —А–ґ–∞–љ–Њ–є —Е–ї–µ–± –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М –њ–Њ–љ–Њ—Б—Л), —Б—Г—Е–∞—А–Є, –Ї–∞—И–Є (–Њ–≤—Б—П–љ–∞—П, –њ–µ—А–ї–Њ–≤–∞—П, –њ—И–µ–љ–љ–∞—П), –Љ–Њ–ї–Њ–і–љ—П–Ї—ГвАФ–Љ–∞–љ–љ–∞—П –Ї–∞—И–∞ –љ–∞ –Љ–Њ–ї–Њ–Ї–µ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ —А–∞—Ж–Є–Њ–љ –≤—Е–Њ–і—П—В –Љ–Њ—А–Ї–Њ–≤—М, —П–±–ї–Њ–Ї–ЄвАФ–∞–љ—В–Њ–љ–Њ–≤–Ї–∞ (–њ–Њ—Б–ї–µ–і–љ–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –њ—А–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е) –Є –Ј–µ–ї–µ–љ—Л–µ –Ї–Њ—А–Љ–∞ (—Б–∞–ї–∞—В, —И–њ–Є–љ–∞—В, –Љ–Њ—А–Ї–Њ–≤–љ–∞—П –±–Њ—В–≤–∞).
–Ъ–Њ–≤–∞–ї–µ–≤—Б–Ї–Є–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –≤–≤–Њ–і–Є—В—М –≤ —А–∞—Ж–Є–Њ–љ –Ї—А—Л—Б–∞–Љ –≤–∞—А–µ–љ—Г—О —Б–≤–µ–Ї–ї—Г –Є –Ї–∞—А—В–Њ—Д–µ–ї—М–љ–Њ–µ –њ—О—А–µ. –°—Г—В–Њ—З–љ–∞—П –љ–Њ—А–Љ–∞ —Е–ї–µ–±–∞ –Є –Ї—А—Г–њ –і–ї—П –Љ—Л—И–µ–є 3-3,5 –≥, –і–ї—П –Ї—А—Л—БвАФ15-20 –≥, —Б–Њ—З–љ—Л—Е –Ї–Њ—А–Љ–Њ–≤-—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 0,5-1 –Є 2-3 –≥, –Ј–µ–ї–µ–љ—Л—Е –Ї–Њ—А–Љ–Њ–≤, –≤—Л–Љ—Л—В—Л—Е –Ї–Є–њ—П—З–µ–љ–Њ–є –≤–Њ–і–Њ–є –Є –љ–∞—А—Г–±–ї–µ–љ–љ—Л—Е,вАФ2-3 –Є 4-6 –≥, –Љ–Њ–ї–Њ–Ї–Њ –љ–∞—В—Г—А–∞–ї—М–љ–Њ–µ (–њ–∞—Б—В–µ—А–Є–Ј–Њ–≤–∞–љ–љ–Њ–µ –Є–ї–Є –Ї–Є–њ—П—З–µ–љ–љ–Њ–µ –≤ —В–µ—З–µ–љ–Є–µ 4-5 –Љ–Є–љ—Г—В) –Є–ї–Є –∞—Ж–Є–і–Њ—Д–Є–ї—М–љ–Њ–µвАФ–≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 4-5 –≥ –Љ—Л—И–∞–Љ –Є 6вАФ8 –≥ –Ї—А—Л—Б–∞–Љ (—З–∞—Б—В—М –Љ–Њ–ї–Њ–Ї–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –Ї–∞—И).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤—Б–µ –ґ–Є–≤–Њ—В–љ—Л–µ –і–Њ–ї–ґ–љ—Л –њ–Њ–ї—Г—З–∞—В—М –њ–Њ–≤–∞—А–µ–љ–љ—Г—О —Б–Њ–ї—М: –Љ—Л—И–Є-–њ–Њ 0,01 –≥, –Ї—А—Л—Б—Л-–њ–Њ 0,07 –≥ (–≤ –Ї–∞—И—Г), —Б–≤–Є–љ–Ї–Є-0,1 –≥, –Ї—А–Њ–ї–Є–Ї–Є-–њ–Њ 0,5 –≥ (–≤ –≤–Є–і–µ —А–∞—Б—В–≤–Њ—А–∞ —Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–∞–Љ–Є) –Є –Ї–Њ—Б—В—П–љ—Г—О –Љ—Г–Ї—Г, –њ—А–Є–Љ–µ—А–љ–Њ –≤ —В–∞–Ї–Є—Е –ґ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е. –Т –Ї–∞–ґ–і—Г—О –Ї–ї–µ—В–Ї—Г –і–ї—П –Љ—Л—И–µ–є –Є –Ї—А—Л—Б –Ї–ї–∞–і—Г—В –Ї—Г—Б–Њ–Ї 1-5 –≥) –Љ–µ–ї–∞ –Є–Ј —А–∞—Б—З–µ—В–∞ –љ–∞ 3-4 –і–љ—П. –Ф–ї—П –Њ–±–Њ–≥–∞—Й–µ–љ–Є—П –Ї–Њ—А–Љ–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞–Љ–Є –≤ –Њ—Б–µ–љ–љ–µ-–Ј–Є–Љ–љ–Є–є –њ–µ—А–Є–Њ–і –і–∞—О—В —А—Л–±–Є–є –ґ–Є—А, —Б—Г—Е–Є–µ –Њ–±–ї—Г—З–µ–љ–љ—Л–µ –і—А–Њ–ґ–ґ–Є, —В–Њ–Љ–∞—В¬≠–љ—Л–є —Б–Њ–Ї, –∞ —Б–≤–Є–љ–Ї–∞–Љ, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–Њ–Ї —З–µ—А–љ–Њ–є —Б–Љ–Њ—А–Њ–і–Є–љ—Л, –љ–∞—Б—В–Њ–є–Ї—Г —И–Є–њ–Њ–≤¬≠–љ–Є–Ї–∞ (–≤–Є—В–∞–Љ–Є–љ –°) –Є —В.–њ.
–°—Г—В–Њ—З–љ–∞—П –љ–Њ—А–Љ–∞ —А—Л–±—М–µ–≥–Њ –ґ–Є—А–∞: 0,5 –≥ –Ї—А–Њ–ї–Є–Ї–∞–Љ, 0,3 –≥ —Б–≤–Є–љ–Ї–∞–Љ, 0,2 –≥ –Ї—А—Л—Б–∞–Љ –Є 0,1 –≥ –Љ—Л—И–∞–Љ (—Б –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–∞–Љ–Є –Є–ї–Є –љ–∞ —Е–ї–µ–±–µ). –Т –Ї–∞—З–µ—Б—В–≤–µ –њ–Њ–і—Б—В–Є–ї–Ї–Є –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ –њ—А–Є–Љ–µ–љ—П—О—В —Б–Њ–ї–Њ–Љ—Г, —В–Њ—А—Д; –і–ї—П –Љ—Л—И–µ–є –Є –Ї—А—Л—Б-–Љ–µ–ї–Ї–Њ–µ —Б–µ–љ–Њ.
–Ъ–Њ—А–Љ—П—В –Є –њ–Њ—П—В –ґ–Є–≤–Њ—В–љ—Л—Е –і–≤–∞ —А–∞–Ј–∞, –∞ –Ї–Њ—А–Љ—П—Й–Є—Е —Б–∞–Љ–Њ–Ї-—В—А–Є —А–∞–Ј–∞ –≤ —Б—Г—В–Ї–Є, –≤ —В–Њ—З–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–µ –≤—А–µ–Љ—П. –Ъ–Њ—А–Љ—Г—И–Ї–Є –ї—Г—З—И–µ –≤—Б–µ–≥–Њ –≥–ї–Є–љ—П–љ—Л–µ (–Є–Ј –Њ–±–Њ–ґ–ґ–µ–љ–љ–Њ–є –≥–ї–Є–љ—Л), –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –≤–µ—Б–∞ –≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –њ–µ—А–µ–≤–µ—А—В—Л–≤–∞–љ–Є—П –Є—Е –ґ–Є–≤–Њ—В–љ—Л–Љ–Є –Є —Г–і–Њ–±–љ—Л–µ –і–ї—П —З–Є—Б—В–Ї–Є (–Љ–Њ–є–Ї–Є). –Ъ–Њ—А–Љ—Г—И–Ї–Є –µ–ґ–µ–і–љ–µ–≤–љ–Њ –Њ—З–Є—Й–∞—О—В –Є –Љ–Њ—О—В –≥–Њ—А—П—З–µ–є –≤–Њ–і–Њ–є. –Т –Ї–∞–ґ–і–Њ–є –Ї–ї–µ—В–Ї–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –њ–Њ –і–≤–µ –Ї–Њ—А–Љ—Г—И–Ї–Є: –і–ї—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–Њ–≤ –Є –і–ї—П –њ–Њ–є–ї–∞. –Ъ–Њ—А–Љ–∞ –Ј–∞–і–∞—О—В —В–Њ–ї—М–Ї–Њ —Б–≤–µ–ґ–Є–µ.
–Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
–Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є –Ј–∞—А–∞–Ј–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е —П–≤–ї—П—О—В—Б—П –њ–∞—Б—В–µ—А–µ–ї–ї–µ–Ј, –њ–∞—А–∞—В–Є—Д (—Б–∞–ї—М–Љ–Њ–љ–µ–ї–ї–µ–Ј), —В—Г–ї—П—А–µ–Љ–Є—П, –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П, –њ—Б–µ–≤–і–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј –Є –Ї–Њ–Ї—Ж–Є–і–Є–Њ–Ј.
–Я–∞—Б—В–µ—А–µ–ї–ї–µ–Ј. –Ч–∞–±–Њ–ї–µ–≤–∞—О—В –Ї—А–Њ–ї–Є–Ї–Є, –Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є, –Љ—Л—И–Є –Є –Ї—А—Л—Б—Л. –°–≤–Є–љ–Ї–Є –±–Њ–ї–µ—О—В —З–∞—Й–µ –≤ –Њ—Б—В—А–Њ–є —Д–Њ—А–Љ–µ, –∞ –Њ—Б—В–∞–ї—М–љ—Л–µ –≤–Є–і—Л вАФ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –њ–Њ–і–Њ—Б—В—А–Њ–є –Є–ї–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–µ.
–Ъ–ї–Є–љ–Є–Ї–∞ –њ—А–Є –Њ—Б—В—А–Њ–є —Д–Њ—А–Љ–µ: —Б–ї–∞–±–Њ—Б—В—М, –њ–Њ–≤—Л—И–µ–љ–Є–µ —В–µ–Љ–њ–µ¬≠—А–∞—В—Г—А—Л, –љ–µ—А–≤–љ—Л–µ —П–≤–ї–µ–љ–Є—П, –њ–Њ–љ–Њ—Б. –°–Љ–µ—А—В—М –Њ–±—Л—З–љ–Њ —З–µ—А–µ–Ј 12вАФ48 —З–∞—Б–Њ–≤. –Т —Б–Ї—А—Л—В–Є–µ: –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є—П (—З–∞—Б—В–Њ —В–Њ—З–µ—З–љ—Л–µ) –≤–Њ –≤—Б–µ—Е –њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е –Є –љ–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –≥–Њ—А—В–∞–љ–Є –Є —В—А–∞—Е–µ–Є.
–Я—А–Є –њ–Њ–і–Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ–µ: —Г—З–∞—Й–µ–љ–љ–Њ–µ, –Ј–∞—В—А—Г–і–љ–µ–љ–љ–Њ–µ, —Б–≤–Є—Б—В—П—Й–µ–µ –і—Л—Е–∞–љ–Є–µ, –љ–∞—Б–Љ–Њ—А–Ї, –Ї–∞—И–µ–ї—М, —З–Є—Е–∞–љ–Є–µ. –С–Њ–ї–µ–Ј–љ—М –Ј–∞—В—П–≥–Є–≤–∞–µ—В—Б—П –і–Њ –і–≤—Г—Е –Є –±–Њ–ї–µ–µ –љ–µ–і–µ–ї—М. –Т—Б–Ї—А—Л—В–Є–µ: –Ї–∞—В–∞—А–∞–ї—М–љ—Л–є –Є–ї–Є –≥–љ–Њ–є–љ–Њ-–Ї–∞—В–∞—А–∞–ї—М–љ—Л–є —А–Є–љ–Є—В, –±—А–Њ–љ—Е–Њ–њ–љ–µ–≤–Љ–Њ–љ–Є—П (–Є–љ–Њ–≥–і–∞ –Ї—А—Г–њ–Њ–Ј–љ–∞—П), —Б–µ—А–Њ–Ј–љ–Њ-—Д–Є–±—А–Є–љ–Њ–Ј–љ—Л–є –њ–ї–µ–≤—А–Є—В.
–Ф–Є–∞–≥–љ–Њ–Ј –њ–Њ–і—В–≤–µ—А–ґ–і–∞–µ—В—Б—П –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞: –≤—Л–і–µ–ї–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–љ–Њ—Б–Є—В–µ–ї–µ–є –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Б–∞–љ–Є—В–∞—А–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є.
–Я–∞—А–∞—В–Є—Д –њ–Њ—А–∞–ґ–∞–µ—В —З–∞—Й–µ –≤—Б–µ–≥–Њ –Ї—А—Л—Б –Є –Љ—Л—И–µ–є, –љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –њ–µ—А–µ–і–∞—З–∞ –Є–љ—Д–µ–Ї—Ж–Є–Є –Љ–Њ—А—Б–Ї–Є–Љ —Б–≤–Є–љ–Ї–∞–Љ –Є –Ї—А–Њ–ї–Є–Ї–∞–Љ. –У–ї–∞–≤–љ—Л–µ —А–∞–Ј–љ–Њ—Б—З–Є–Ї–Є –Є–љ—Д–µ–Ї—Ж–Є–ЄвАФ–ґ–Є–≤–Њ—В–љ—Л–µ-–±–∞–Ї—В–µ—А–Є–Њ–љ–Њ—Б–Є—В–µ–ї–Є. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ—А–Њ—В–µ–Ї–∞–µ—В –≤ –≤–Є–і–µ —Б–µ–њ—В–Є—Ж–µ–Љ–Є–Є (–Њ—Б—В—А–∞—П —Д–Њ—А–Љ–∞) —Б –Ї–ї–Є–љ–Є–Ї–Њ–є –њ–Њ–љ–Њ—Б–∞ (—Д–µ–Ї–∞–ї—М–љ—Л–µ –Љ–∞—Б—Б—Л –ґ–µ–ї—В–Њ–≤–∞—В–Њ-–Ј–µ–ї–µ–љ–Њ–≤–∞—В–Њ–≥–Њ —Ж–≤–µ—В–∞), –Њ—В–Ї–∞–Ј–∞ –Њ—В –Ї–Њ—А–Љ–∞ –Є –Њ–±—Й–µ–≥–Њ —Г–≥–љ–µ—В–µ–љ–Є—П. –°–Љ–µ—А—В—М –љ–∞—Б—В—Г–њ–∞–µ—В –Њ–±—Л—З–љ–Њ —З–µ—А–µ–Ј 24вАФ48 —З–∞—Б–Њ–≤. –Я—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ —В–µ—З–µ–љ–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –≤—Л—А–∞–ґ–µ–љ—Л –љ–µ—П—Б–љ–Њ: –∞–њ–∞—В–Є—П, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –∞–њ–њ–µ¬≠—В–Є—В–∞, –≤–Ј—К–µ—А–Њ—И–µ–љ–љ–Њ—Б—В—М —И–µ—А—Б—В–Є, –њ–Њ–љ–Њ—Б, —Г —Б–∞–Љ–Њ–Ї —З–∞—Б—В–Њ –∞–±–Њ—А—В—Л.
–Ъ–∞—А—В–Є–љ–∞ –≤—Б–Ї—А—Л—В–Є—П –њ—А–Є –Њ—Б—В—А–Њ–є —Д–Њ—А–Љ–µ вАФ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є –Є –Љ–µ–Ј–µ–љ—В–µ—А–Є–∞–ї—М–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤; —Б–ї–Є–Ј–Є—Б—В–∞—П –Ї–Є—И–µ—З–љ–Є–Ї–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–∞, —Б –љ–∞–ї–Є—З–Є–µ–Љ –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є –Є –Љ–µ–ї–Ї–Є—Е –њ—А–Њ—Б–Њ–≤–Є–і–љ—Л—Е —Г–Ј–µ–ї–Ї–Њ–≤; –њ—А–Є —Е—А–Њ–љ–Є—З–µ¬≠—Б–Ї–Њ–є —Д–Њ—А–Љ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —В–µ –ґ–µ, —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–µ –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–µ, –њ–µ–љ–Є—Б—В–Њ–µ, –ґ–µ–ї—В–Њ–≤–∞—В–Њ–≥–Њ —Ж–≤–µ—В–∞. –Ф–Є–∞–≥–љ–Њ–Ј —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞: –≤—Л—П–≤–ї–µ–љ–Є–µ –±–∞–Ї—В–µ—А–Є–Њ–љ–Њ—Б–Є—В–µ–ї–µ–є –њ—Г—В–µ–Љ —А–µ–∞–Ї—Ж–Є–Є –∞–≥–≥–ї—О¬≠—В–Є–љ–∞—Ж–Є–Є (—В–Є—В—А 1:200 –Є –≤—Л—И–µ —Б—З–Є—В–∞–µ—В—Б—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–µ–є); –Ї–∞—А–∞–љ—В–Є–љ –≤ —В–µ—З–µ–љ–Є–µ 20 —Б—Г—В–Њ–Ї –і–ї—П –≤–љ–Њ–≤—М –њ–Њ—Б—В—Г–њ–∞—О—Й–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е, —Б–Њ–±–ї—О–і–µ–љ–Є–µ –Ј–Њ–Њ–≥–Є–≥–Є–µ–љ–Є—З–µ—Б–Ї–Є—Е –Є –≤–µ—В–µ—А–Є–љ–∞—А–љ–Њ-—Б–∞–љ–Є—В–∞—А–љ—Л—Е –њ—А–∞–≤–Є–ї.
–Ґ—Г–ї—П—А–µ–Љ–Є—П. –Ч–∞–±–Њ–ї–µ–≤–∞—О—В –Ї—А—Л—Б—Л, –Љ—Л—И–Є, —А–µ–ґ–µ –Ї—А–Њ–ї–Є–Ї–Є –Є –Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є. –Я—А–Є –≤—Б–Ї—А—Л—В–Є–Є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –ї–Є–Љ—Д–∞¬≠—В–Є—З–µ—Б–Ї–Є—Е –ґ–µ–ї–µ–Ј –Є —Б–µ–ї–µ–Ј–µ–љ–Ї–Є —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–µ–ї–Ї–Њ–≤. –Ґ–∞–Ї–Є–µ –ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –љ–∞—Е–Њ–і—П—В –≤ –њ–µ—З–µ–љ–Є –Є –≤ –ї–µ–≥–Ї–Є—Е, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і–Ї–Њ–ґ–љ—Л–µ –≥–љ–Њ–є–љ–Є–Ї–Є (–Њ—Б–Њ¬≠–±–µ–љ–љ–Њ —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤). –Ф–ї—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞: –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е –Є–Ј –Ј–∞–≤–µ–і–Њ–Љ–Њ –±–ї–∞–≥–Њ–њ–Њ–ї—Г—З–љ—Л—Е —Е–Њ–Ј—П–є—Б—В–≤, –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–є –Ї–∞—А–∞–љ—В–Є–љ –њ—А–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–Є –ґ–Є–≤–Њ—В¬≠–љ—Л—Е, –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є–µ –≤–µ—В–µ—А–Є–љ–∞—А–љ—Л–µ –Њ—Б–Љ–Њ—В—А—Л. –С–Њ–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ —Г–±–Є–≤–∞—О—В. –Ф–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є—П.
–Ш–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–∞—П –њ–љ–µ–≤–Љ–Њ–љ–Є—П —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ–Њ—А–∞–ґ–∞–µ—В –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї. –Я—А–µ–і-—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–µ —Д–∞–Ї—В–Њ—А—Л: —Б–Ї—Г—З–µ–љ–љ–Њ—Б—В—М, –њ—А–Њ—Б—В—Г–і–∞, —Б—Л—А–Њ—Б—В—М –њ–Њ–Љ–µ—Й–µ–љ–Є–є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –≤–µ–љ—В–Є–ї—П—Ж–Є–Є, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ–Є—В–∞–љ–Є—П, –∞–≤–Є—В–∞–Љ–Є–љ–Њ–Ј (–Р –Є –°), –±–∞—Ж–Є–ї–ї–Њ–љ–Њ—Б–Є—В–µ–ї—М—Б—В–≤–Њ. –Ъ–ї–Є–љ–Є–Ї–∞: –Є—Б—В–µ—З–µ–љ–Є–µ –Є–Ј –љ–Њ—Б–Њ–≤—Л—Е –Њ—В–≤–µ—А—Б—В–Є–є, –Ї–∞—И–µ–ї—М, –Ј–∞—В—А—Г–і–љ–µ–љ–љ–Њ–µ –і—Л—Е–∞–љ–Є–µ, —Е—А–Є–њ—Л, –ї–Є—Е–Њ—А–∞–і–Ї–∞, –∞–њ–∞—В–Є—П, –Є—Б—В–Њ—Й–µ–љ–Є–µ, —Г —Б–∞–Љ–Њ–Ї —З–∞—Б—В–Њ –∞–±–Њ—А—В—Л. –Я–∞—В–Њ–ї–Њ–≥–Њ-–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞: –Њ—З–∞–≥–Њ–≤–∞—П –≥–µ–њ–∞—В–Є–Ј–∞—Ж–Є—П –ї–µ–≥–Ї–Є—Е (¬Ђ–Љ—А–∞–Љ–Њ—А–љ–Њ—Б—В—М¬ї), –≤ –≥—А—Г–і–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –Ј–љ–∞—З–Є—В–µ–ї—М¬≠–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ—Г—В–љ–Њ–≥–Њ, —Б –њ—А–Є–Љ–µ—Б—М—О —Д–Є–±—А–Є–љ–∞, —Н–Ї—Б—Б—Г–і–∞—В–∞, –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –≤–µ—А—Е¬≠–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є –Є –њ–ї–µ–≤—А—Л, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Б–µ–ї–µ–Ј–µ–љ–Ї–Є. –Я—А–Є –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ –і–Є–∞–≥–љ–Њ–Ј–∞ —Б–ї–µ–і—Г–µ—В –Є–Љ–µ—В—М –≤ –≤–Є–і—Г —В–∞–Ї–ґ–µ –њ–љ–µ–≤–Љ–Њ–љ–Є–Є –Є–љ–≤–∞–Ј–Є–Њ–љ–љ–Њ–≥–Њ –Є –≥—А–Є–±–Ї–Њ–≤–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П. –Ы–µ—З–µ–љ–Є–µ: –њ–Њ–і–Ї–Њ–ґ–љ–ЊвАФ–≥–ї—О–Ї–Њ–Ј–∞ (40%) —Б 4 –Љ–≥ –∞—Б–Ї–Њ—А–±–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ –і–Њ–Ј–µ 0,5вАФ1,5 –≥ –≤ —В–µ—З–µ–љ–Є–µ 5вАФ6 –і–љ–µ–є. –Я—А–Є¬≠–Љ–µ–љ–µ–љ–Є–µ –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤, –µ—Б–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –Є —Б—Г–ї—М—Д–∞–љ–Є–ї–∞–Љ–Є–і–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Я—А–Њ—Д–Є¬≠–ї–∞–Ї—В–Є–Ї–∞: –Њ–±—Й–Є–µ –Ј–Њ–Њ–≥–Є–≥–Є–µ–љ–Є—З–µ—Б–Ї–Є–µ –Є –≤–µ—В–µ—А–Є–љ–∞—А–љ–Њ-—Б–∞–љ–Є—В–∞—А–љ—Л–µ –Љ–µ—А–Њ–њ—А–Є—П¬≠—В–Є—П, –Є–Ј–Њ–ї—П—Ж–Є—П –±–Њ–ї—М–љ—Л—Е, –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є—П.
–Я—Б–µ–≤–і–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј. –І–∞—Й–µ –Ј–∞–±–Њ–ї–µ–≤–∞—О—В –Ї—А–Њ–ї–Є–Ї–Є –Є –Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є. –Т–Њ–Ј–±—Г–і–Є—В–µ–ї—МвАФ–њ–∞–ї–Њ—З–Ї–∞ –њ—Б–µ–≤–і–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–∞ –≥—А—Л–Ј—Г–љ–Њ–≤. –Ъ–ї–Є–љ–Є–Ї–∞ –љ–µ —Е–∞—А–∞–Ї—В–µ—А¬≠–љ–∞: —Г–≥–љ–µ—В–µ–љ–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ, –Њ—В–Ї–∞–Ј –Њ—В –Ї–Њ—А–Љ–∞, –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –Є—Б—Е—Г–і–∞–љ–Є–µ, –Є–љ–Њ–≥–і–∞ –Њ–њ—Г—Е–∞–љ–Є–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –њ–Њ–љ–Њ—Б—Л, –њ–∞—А–∞–ї–Є—З–Є. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є –і–Њ 5вАФ6 –љ–µ–і–µ–ї—М; —Б–Љ–µ—А—В—М –Њ—В –Є—Б—В–Њ—Й–µ–љ–Є—П. –Т—Б–Ї—А—Л—В–Є–µ: –њ–Њ—А–∞–ґ–µ–љ–Є–µ –њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤, –Ї–Є—И–µ—З–љ–Є–Ї–∞, –Є–љ–Њ–≥–і–∞ –Љ—Л—И—Ж, –≤ –≤–Є–і–µ –Љ–µ–ї–Ї–Є—Е —Г–Ј–µ–ї–Ї–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –ї—Г—З–Є—Б—В—Г—О —Д–Њ—А–Љ—Г —Б–µ—А–Њ-–±–µ–ї–Њ–≥–Њ —Ж–≤–µ—В–∞. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤, –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ, –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є. –Ф–Є–∞–≥–љ–Њ–Ј —Б—В–∞–≤—П—В –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–∞—В–Њ–ї–Њ–≥–Њ-–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Є —А–µ¬≠–Ј—Г–ї—М—В–∞—В–Њ–≤ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ь–µ—А—Л –±–Њ—А—М–±—Л: —Г–±–Њ–є –±–Њ–ї—М–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –Ї–∞—А–∞–љ—В–Є–љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ–і–Њ–Ј—А–µ–≤–∞–µ–Љ—Л—Е –≤ –Ј–∞—А–∞–ґ–µ–љ–Є–Є, –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є—П.
–Ъ–Њ–Ї—Ж–Є–і–Є–Њ–Ј. –І–∞—Й–µ –≤—Б–µ–≥–Њ –њ–Њ—А–∞–ґ–∞—О—В—Б—П –Ї—А–Њ–ї–Є–Ї–Є. –†–∞–Ј–ї–Є—З–∞—О—В –Ї–Є—И–µ—З–љ—Г—О, –њ–µ—З–µ–љ–Њ—З–љ—Г—О –Є —Б–Љ–µ—И–∞–љ–љ—Г—О —Д–Њ—А–Љ—Л. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –њ—А–Њ—В–µ–Ї–∞–µ—В –Њ—Б—В—А–Њ –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є (–њ–Њ—Б–ї–µ–і–љ–µ–µ —З–∞—Й–µ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Ї—А–Њ–ї–Є–Ї–Њ–≤, –Њ—Б—В—А–Њ–µ вАФ —Г –Љ–Њ–ї–Њ–і–љ—П–Ї–∞). –Ч–∞—А–∞–ґ–µ–љ–Є–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —З–µ—А–µ–Ј –Ї–Њ—А–Љ –Є –≤–Њ–і—Г, –Ј–∞–≥—А—П–Ј–љ–µ–љ–љ—Г—О —Д–µ–Ї–∞–ї–Є—П–Љ–Є, —Б–Њ–і–µ—А–ґ–∞—Й–Є–Љ–Є –Ј—А–µ–ї—Л–µ –Њ–Њ—Ж–Є—Б—В—Л –Ї–Њ–Ї—Ж–Є–і–Є–є.
–Ъ—А–Њ–ї–Є–Ї–Є вАФ –њ–Њ—Б—В–Њ—П–љ–љ—Л–µ –љ–Њ—Б–Є—В–µ–ї–Є –Є –≤—Л–і–µ–ї–Є—В–µ–ї–Є –Ї–Њ–Ї—Ж–Є–і–Є–є, –Ї–Њ—В–Њ—А—Л–µ, –≤—Л–і–µ¬≠–ї—П—П—Б—М –≤ –≤–Є–і–µ –Њ–Њ—Ж–Є—Б—В —Б –Ї–∞–ї–Њ–Љ, —З–µ—А–µ–Ј 2вАФ3 –і–љ—П —Б–Њ–Ј—А–µ–≤–∞—О—В –Є —Б—В–∞–љ–Њ–≤—П—В—Б—П —Б–њ–Њ—Б–Њ–±–љ—Л–Љ–Є –Ї –Ј–∞—А–∞–ґ–µ–љ–Є—О –ґ–Є–≤–Њ—В–љ—Л—Е.
–Ъ–ї–Є–љ–Є–Ї–∞: –њ—А–Є –Њ—Б—В—А–Њ–є —Д–Њ—А–Љ–µ вАФ –Є—Б—В–Њ—Й–µ–љ–Є–µ, –≤–Ј–і—Г—В–Є–µ –ґ–Є–≤–Њ—В–∞, –њ–Њ–љ–Њ—Б, –Ї—А–Њ–ї–Є–Ї–Њ–≤вАФ–њ–Њ—В–µ—А—П –∞–њ–њ–µ—В–Є—В–∞, –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –Є—Б—Е—Г–і–∞–љ–Є–µ, –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Њ–µ –њ–Њ—П–≤–ї–µ–љ–Є–µ –ґ–Є–і–Ї–Њ–≥–Њ –Ї–∞–ї–∞.
–Я—А–Є –≤—Б–Ї—А—Л—В–Є–Є вАФ –Ї–∞—В–∞—А —Б–ї–Є–Ј–Є—Б—В–Њ–є –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Є–ї–Є –љ–∞–ї–Є—З–Є–µ –≤ –њ–µ—З–µ–љ–Є –±–µ–ї—Л—Е —Г–Ј–µ–ї–Ї–Њ–≤ –≤–µ–ї–Є—З–Є–љ–Њ–є –Њ—В –±—Г–ї–∞–≤–Њ—З–љ–Њ–є –≥–Њ–ї–Њ–≤–Ї–Є –і–Њ –≥–Њ—А–Њ—И–Є–љ—Л. –Ф–Є–∞–≥–љ–Њ–Ј вАФ –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –Њ–Њ—Ж–Є—Б—В –Ї–Њ–Ї—Ж–Є–і–Є–є. –Ь–µ—А—Л –±–Њ—А—М–±—Л –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞: –ї–µ—З–µ–љ–Є–µ, —Б–Њ–Ј–і–∞–љ–Є–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Г—Б–ї–Њ–≤–Є–є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е, —Б—Г—Е–Њ—Б—В—М –≤ –Ї–ї–µ—В–Ї–∞—Е, –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–µ –Ї–Њ—А–Љ–ї–µ–љ–Є–µ, –µ–ґ–µ–і–љ–µ–≤–љ–∞—П —З–Є—Б—В–Ї–∞ –Ї–ї–µ—В–Њ–Ї, –Є–љ–≤–µ–љ—В–∞—А—П, –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–∞—П –Є—Е –і–µ–Ј–Є–љ—Д–µ–Ї—Ж–Є—П, –±–Є–Њ—В–µ—А¬≠–Љ–Є—З–µ—Б–Ї–Њ–µ –Њ–±–µ–Ј–≤—А–µ–ґ–Є–≤–∞–љ–Є–µ –љ–∞–≤–Њ–Ј–∞.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ –Љ–Њ–≥—Г—В –њ–Њ—А–∞–ґ–∞—В—М—Б—П —Б–њ–Є—А–Њ—Е–µ—В–Њ–Ј–Њ–Љ (–Ї—А–Њ–ї–Є–Ї–Є), —Б–µ–њ—В–Є–Ї–Њ–њ–Є—Н–Љ–Є–µ–є, —Н–љ—В–µ—А–Њ—В–Њ–Ї—Б–µ–Љ–Є–µ–є, –ї–Є—Б—В–µ—А–Є–Њ–Ј–Њ–Љ, —А—П–і–Њ–Љ –≥–ї–Є—Б—В–љ—Л—Е –Є–љ–≤–∞–Ј–Є–є, –≥—А–Є–±–Ї–∞–Љ–Є –Є –љ–∞–Ї–Њ–ґ–љ—Л–Љ–Є –њ–∞—А–∞–Ј–Є—В–∞–Љ–Є (—З–µ—Б–Њ—В–Ї–∞, –њ–∞—А—И–∞, —Б—В—А–Є–≥—Г—Й–Є–є –ї–Є—И–∞–є –Є –і—А.).
–Ф–ї—П –±–Њ–ї–µ–µ –і–µ—В–∞–ї—М–љ–Њ–≥–Њ –Њ–Ј–љ–∞–Ї–Њ–Љ–ї–µ–љ–Є—П —Б –Ј–∞—В—А–Њ–љ—Г—В—Л–Љ –≤–Њ–њ—А–Њ—Б–Њ–Љ –Њ—В—Б—Л–ї–∞–µ–Љ –Є–љ—В–µ—А–µ—Б—Г—О—Й–Є—Е—Б—П –Ї —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤—Г ¬Ђ–°–Њ–і–µ—А–ґ–∞–љ–Є–µ –Љ–µ–ї–Ї–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –≤–Є–≤–∞—А–Є—П—Е¬ї.
| –Я–Њ–і–≥–Њ—В–Њ–≤–Ї–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Ї –Ј–∞—А–∞–ґ–µ–љ–Є—О
–Я–µ—А–µ–і –Њ–њ—Л—В–Њ–Љ –ґ–Є–≤–Њ—В–љ–Њ–µ –Ї–ї–µ–є–Љ—П—В, –≤–Ј–≤–µ—И–Є–≤–∞—О—В, –Њ–њ—А–µ–і–µ–ї—П—О—В, –µ—Б–ї–Є –љ—Г–ґ–љ–Њ, –µ–≥–Њ –њ–Њ–ї, –≤–Њ–Ј—А–∞—Б—В –Є –Є–Ј–Љ–µ—А—П—О—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Г —В–µ–ї–∞.
–Ъ–ї–µ–є–Љ–µ–љ–Є–µ –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –≥–Њ—В–Њ–≤—Л—Е –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є—Е –±–Є—А–Њ–Ї —Б –љ–Њ–Љ–µ—А–∞–Љ–Є –Є–ї–Є –љ–∞–ї–Њ–ґ–µ–љ–Є–µ–Љ —В–∞–≤—А–∞ —В–∞—В—Г–Є—А–Њ–≤–Њ—З–љ—Л–Љ–Є —Й–Є–њ—Ж–∞–Љ–Є.
–Ь–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–µ –љ–Њ–Љ–µ—А–Ї–Є –Є–Љ–µ—О—В –Ј–∞–Њ—Б—В—А–µ–љ–љ—Л–µ –Ї–Њ–љ—Ж—Л, –Ї–Њ—В–Њ—А—Л–Љ–Є –Є –њ—А–Њ–Ї–∞–ї—Л–≤–∞—О—В —Г—И–љ—Г—О —А–∞–Ї–Њ–≤–Є–љ—Г –ґ–Є–≤–Њ—В–љ—Л—Е —Б –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б—В–Њ—А–Њ–љ—Л; –љ–∞ –≤—Л–њ—Г–Ї–ї–Њ–є —Б—В–Њ—А–Њ–љ–µ —Г—Е–∞ –Ї–Њ–љ—Ж—Л –љ–Њ–Љ–µ—А–Ї–Њ–≤ –Ј–∞–≥–Є–±–∞—О—В—Б—П. –Э–Њ–Љ–µ—А–Ї–Є –Љ–Њ–ґ–љ–Њ –њ—А–Є–≥–Њ—В–Њ–≤–Є—В—М —Б–≤–Њ–Є–Љ–Є —Б–Є–ї–∞–Љ–Є –Є–Ј –љ–∞—А–µ–Ј–∞–љ–љ—Л—Е –Ї—Г—Б–Њ—З–Ї–Њ–≤ –Љ—П–≥–Ї–Њ–є –ґ–µ—Б—В–Є.
–Э–Њ–Љ–µ—А –љ–∞–і–њ–Є—Б—Л–≤–∞—О—В –ґ–Є–і–Ї–Њ—Б—В—М—О, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј —Б–Љ–µ—Б–Є 5 —З–∞—Б—В–µ–є –љ–∞—Б—Л—Й–µ–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –Љ–µ–і–љ–Њ–≥–Њ –Ї—Г–њ–Њ—А–Њ—Б–∞ –Є 1 —З–∞—Б—В–Є –Ї—А–µ–њ–Ї–Њ–є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –Я–Є—И—Г—В –љ–∞ –Љ–µ—В–∞–ї–ї–µ –Ј–∞–Њ—Б—В—А–µ–љ–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Њ–є –Є —В–Њ—В—З–∞—Б –ґ–µ –љ–∞–і–њ–Є—Б—М –≤—Л—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є.
–Я–µ—А–µ–і –Ї–ї–µ–є–Љ–µ–љ–Є–µ–Љ —В–∞—В—Г–Є—А–Њ–≤–Њ—З–љ—Л–Љ–Є —Й–Є–њ—Ж–∞–Љ–Є —Г—Е–Њ –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б—В–Њ—А–Њ–љ—Л –њ—А–Њ—В–Є—А–∞—О—В —Б–њ–Є—А—В–Њ–Љ, –љ–∞–Ї–∞–ї—Л–≤–∞—О—В —Й–Є–њ—Ж–∞–Љ–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–є –љ–Њ–Љ–µ—А, –∞ –Ј–∞—В–µ–Љ –Љ–µ—Б—В–Њ –њ—А–Њ–Ї–Њ–ї–∞ –≤—В–Є—А–∞—О—В —В—Г—И—М –Є–ї–Є —Б–њ–Є—А—В–Њ–≤–Њ–є —А–∞—Б—В–≤–Њ—А –Ї–Њ–њ–Њ—В–Є. –Т –Ї—А–∞–є–љ–Є—Е —Б–ї—Г—З–∞—П—Е, –њ—А–Є –Њ—Б—В—А—Л—Е –Њ–њ—Л—В–∞—Е, –Љ–Њ–ґ–љ–Њ –Љ–µ—В–Є—В—М –ґ–Є–≤–Њ—В–љ—Л—Е –њ—Г—В–µ–Љ –≤—Л—Б—В—А–Є–≥–∞–љ–Є—П —И–µ—А—Б—В–Є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е —Г—З–∞—Б—В–Ї–∞—Е —В–µ–ї–∞.
–Ь—Л—И–µ–є –Є –Ї—А—Л—Б –Љ–µ—В—П—В –љ–∞–і—А–µ–Ј–Њ–Љ —Г—И–µ–є –Є–ї–Є –ґ–µ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е —З–∞—Б—В–µ–є —В–µ–ї–∞ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –њ–Є–Ї—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–і–Њ–ї–≥–Њ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П) –Є–ї–Є 0,5% —Б–њ–Є—А—В–Њ–≤—Л–Љ–Є —А–∞—Б—В–≤–Њ—А–∞–Љ–Є –∞–љ–Є–ї–Є–љ–Њ–≤—Л—Е –Ї—А–∞—Б–Њ–Ї. –≠—В–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–ґ–љ–Њ –љ—Г–Љ–µ—А–Њ–≤–∞—В—М –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤–Њ –≤—А–µ–Љ—П –Њ–њ—Л—В–∞, –њ–Њ–ї—М–Ј—Г—П—Б—М –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –Ї—А–∞—Б–Ї–∞–Љ–Є, –і–∞—О—Й–Є–Љ–Є —Б—В–Њ–є–Ї–Њ–µ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ, –љ–∞–њ—А–Є–Љ–µ—А –љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ —Д—Г–Ї—Б–Є–љ–∞, –љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ –≤–Њ–і–љ—Л–Љ –Є–ї–Є —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –њ–Є–Ї—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–ї–Є –љ–∞—Б—Л—Й–µ–љ–љ—Л–Љ –≤–Њ–і–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –њ–µ—А–Љ–∞–љ–≥–∞–љ–∞—В–∞ –Ї–∞–ї–Є—П. –£ –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Њ–Ї—А–∞—И–Є–≤–∞—О—В —А–∞–Ј–љ—Л–µ —З–∞—Б—В–Є —В–µ–ї–∞. –Ю–і–љ–Њ–є –Ї—А–∞—Б–Ї–Њ–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Љ–µ—В—П—В –њ–µ—А–≤—Л–µ 9 –љ–Њ–Љ–µ—А–Њ–≤. –°–Њ—З–µ—В–∞–љ–Є–µ –і–≤—Г—Е —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї—А–∞—Б–Њ–Ї –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–Љ–µ—В–Є—В—М –і–Њ 100 –ґ–Є–≤–Њ—В–љ—Л—Е.
–Э–Є–ґ–µ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є–Љ–µ—А–∞ –њ—А–Є–≤–Њ–і–Є—В—Б—П –Њ–і–љ–∞ –Є–Ј —Б—Е–µ–Љ –љ—Г–Љ–µ—А–∞—Ж–Є–Є. –Ь–µ—В–Ї–Є –њ–Є–Ї—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –µ–і–Є–љ–Є—Ж–∞–Љ, –Љ–µ—В–Ї–Є —Д—Г–Ї—Б–Є–љ–Њ–Љ –Њ–±–Њ–Ј–љ–∞—З–∞—О—В –і–µ—Б—П—В–Ї–Є. –Ю–Ї—А–∞—И–µ–љ–љ—Л–µ —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –ґ–Є–≤–Њ—В–љ—Л–µ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–µ—Б—В–∞ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є—П –њ—П—В–љ–∞ –Є –µ–≥–Њ –Њ–Ї—А–∞—Б–Ї–Є –±—Г–і—Г—В –Є–Љ–µ—В—М —Б–ї–µ–і—Г—О—Й–Є–µ —Г—Б–ї–Њ–≤–љ—Л–µ –љ–Њ–Љ–µ—А–∞:
–ї–µ–≤–∞—П –њ–µ—А–µ–і–љ—П—П –ї–∞–њ–∞вАФNo1, –ї–µ–≤—Л–є –±–Њ–ЇвАФNo2, –ї–µ–≤–∞—П –Ј–∞–і–љ—П—П –ї–∞–њ–∞вАФNo3, –≥–Њ–ї–Њ–≤–∞вАФNo4, —Б–њ–Є–љ–∞вАФNo5, –Њ–±–ї–∞—Б—В—М –Ї—А–µ—Б—В—Ж–∞вАФNo6, –њ—А–∞–≤–∞—П –њ–µ—А–µ–і–љ—П—П –ї–∞–њ–∞вАФNo7, –њ—А–∞–≤—Л–є –±–Њ–ЇвАФNo8, –њ—А–∞–≤–∞—П –Ј–∞–і–љ—П—П –ї–∞–њ–∞вАФNo9. –Э–∞–љ–µ—Б–µ–љ–Є–µ —Д—Г–Ї¬≠—Б–Є–љ–∞ –љ–∞ —В–µ –ґ–µ –Љ–µ—Б—В–∞ (–≤–Љ–µ—Б—В–Њ –њ–Є–Ї—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л) –±—Г–і–µ—В –Њ–Ј–љ–∞—З–∞—В—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ: 10, 20, 30, 40, 50, 60, 70, 80, 90.
–Я—А–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –і–≤—Г—Е –Ї—А–∞—Б–Њ–Ї –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ –ї—О–±–Њ–є –і–≤—Г–Ј–љ–∞—З–љ—Л–є –љ–Њ–Љ–µ—А, –љ–∞–њ—А–Є–Љ–µ—А: –ї–∞–њ–∞ –ї–µ–≤–∞—П –њ–µ—А–µ–і–љ—П—П (—Д—Г–Ї—Б–Є–љ) + –ї–∞–њ–∞ –ї–µ–≤–∞—П –њ–µ—А–µ–і–љ—П—П (–њ–Є–Ї—А–Є–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞)вАФNo11, –ї–∞–њ–∞ –њ—А–∞–≤–∞—П –Ј–∞–і–љ—П—П (—Д—Г–Ї—Б–Є–љ) + –ї–∞–њ–∞ –ї–µ–≤–∞—П –Ј–∞–і–љ—П—П (–њ–Є–Ї—А–Є–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞)вАФNo93.
–£ –њ—В–Є—Ж –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–µ –љ–Њ–Љ–µ—А–∞ (–±—А–∞—Б–ї–µ—В—Л) –љ–∞–і–µ–≤–∞—О—В –љ–∞ –Њ–і–љ—Г –Є–Ј –љ–Њ–ґ–µ–Ї.
–Т–Ј–≤–µ—И–Є–≤–∞–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і—П—В, —Б–Љ–Њ—В—А—П –њ–Њ –Є—Е –≤–µ–ї–Є—З–Є–љ–µ, –Є–ї–Є –≤ —П—Й–Є–Ї–µ –љ–∞ –Њ–±—Л—З–љ—Л—Е —Б—В–Њ–ї–Њ–≤—Л—Е –≤–µ—Б–∞—Е (–С–µ—А–∞–љ–ґ–µ), –Є–ї–Є –љ–∞ –≤–µ—Б–∞—Е –і–ї—П –≤–Ј–≤–µ—И–Є–≤–∞–љ–Є—П –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –і–µ—В–µ–є (–њ–Њ –Ь–µ—В–µ–ї–Ї–Є–љ—Г). –Ь–µ–ї–Ї–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –љ–∞–њ—А–Є–Љ–µ—А, –Љ—Л—И–µ–є, –≤–Ј–≤–µ—И–Є–≤–∞—О—В –љ–∞ —А—Г—З–љ—Л—Е (–∞–њ—В–µ–Ї–∞—А—Б–Ї–Є—Е) –≤–µ—Б–∞—Е —Б —А–Њ–≥–Њ–≤—Л–Љ–Є —З–∞—И–Ї–∞–Љ–Є.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ–Њ–ї–∞.
–Ю–±—Й–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є: —Б–∞–Љ—Ж—Л –Ї—А—Г–њ–љ–µ–µ —Б–∞–Љ–Њ–Ї –њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –Є –≥—А—Г–±–µ–µ –њ–Њ –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Є; –њ–µ—А–µ–і–љ—П—П —З–∞—Б—В—М —В—Г–ї–Њ–≤–Є—Й–∞ —Б–∞–Љ—Ж–Њ–≤ —А–∞–Ј–≤–Є—В–∞ —Б–Є–ї—М–љ–µ–µ –Ј–∞–і–љ–µ–є.
–Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–Њ–ї–∞ —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В –Є—Е –ї–µ–≤–Њ–є —А—Г–Ї–Њ–є –Ј–∞ –Ї–Њ–ґ—Г –≤ –Њ–±–ї–∞—Б—В–Є —И–µ–Є –≤–Љ–µ—Б—В–µ —Б —Г—И–∞–Љ–Є, –∞ –і—А—Г–≥–Њ–є —А—Г–Ї–Њ–є, –Њ—В—В—П–љ—Г–≤ —Е–≤–Њ—Б—В, –љ–∞—В—П–≥–Є–≤–∞—О—В —Б–≤–Њ–±–Њ–і–љ—Л–Љ–Є –њ–∞–ї—М—Ж–∞–Љ–Є –Ї–Њ–ґ—Г —Г –њ–Њ–ї–Њ–≤–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є—П: —Г —Б–∞–Љ–Њ–Ї –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Й–µ–ї—М, —Б—Г–ґ–∞—О—Й–∞—П—Б—П –Ї —Б–њ–Є–љ–µ, –∞ —Г —Б–∞–Љ—Ж–Њ–≤ –Њ—В–Ї—А—Л–≤–∞–µ—В—Б—П –Ї—А—Г–≥–ї–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ —Б –≤—Л—Б—В—Г–њ–∞—О—Й–Є–Љ –Є–Ј –љ–µ–≥–Њ –њ–Њ–ї–Њ–≤—Л–Љ —З–ї–µ–љ–Њ–Љ. –Ґ–∞–Ї–Є–Љ –ґ–µ –Њ–±—А–∞–Ј–Њ–Љ –Њ–њ—А–µ–і–µ–ї—П—О—В –њ–Њ–ї —Г –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї. –£ —Б–∞–Љ—Ж–Њ–≤ –Љ—Л—И–µ–є –Є –Ї—А—Л—Б —А–∞—Б—Б—В–Њ—П–љ–Є–µ –Љ–µ–ґ–і—Г –Ј–∞–і–љ–µ–њ—А–Њ—Е–Њ–і–љ—Л–Љ –Њ—В–≤–µ—А—Б—В–Є–µ–Љ –Є –њ–Њ–ї–Њ–≤—Л–Љ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –і–ї–Є–љ–љ–µ–µ, —З–µ–Љ —Г —Б–∞–Љ–Њ–Ї; –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –њ–Њ—Б–ї–µ–і–љ–Є—Е —Е–Њ—А–Њ—И–Њ –Ј–∞–Љ–µ—В–љ—Л –≥—А—Г–і–љ—Л–µ —Б–Њ—Б–Ї–Є.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≤–Њ–Ј—А–∞—Б—В–∞ —Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–њ–Є—Б–µ–є –і–Њ–≤–Њ–ї—М–љ–Њ —В—А—Г–і–љ–Њ. –£ —Б—В–∞—А—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е —А–µ–і–Ї–Є–є, –±–µ–Ј –≥–ї—П–љ—Ж–∞ —И–µ—А—Б—В–љ—Л–є –њ–Њ–Ї—А–Њ–≤, –і–ї–Є–љ–љ—Л–µ –Ї–Њ–≥—В–Є, —В—Г—Б–Ї–ї—Л–є –≤–Ј–≥–ї—П–і –Є —В–µ–Љ–љ—Л–є –љ–∞–њ–µ—В –љ–∞ –Ј—Г–±–∞—Е. –Я—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –≤–Њ–Ј—А–∞—Б—В–∞ —Г –љ–Њ—А–Љ–∞–ї—М–љ–Њ —Г–њ–Є—В–∞–љ–љ—Л—Е, –Ј–і–Њ—А–Њ¬≠–≤—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–Њ –Є—Е –ґ–Є–≤–Њ–Љ—Г –≤–µ—Б—Г.
–Ш–Ј–Љ–µ—А–µ–љ–Є–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞ —Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –Њ–±—Л—З–љ—Л–Љ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ —В–µ—А–Љ–Њ–Љ–µ—В—А–Њ–Љ –њ–µ—А–µ–і –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Њ–є –Њ–њ—Л—В–∞, –∞ –Є–љ–Њ–≥–і–∞ –Є –≤–Њ –≤—А–µ–Љ—П –љ–∞—Е–Њ–ґ–і–µ–љ–Є—П –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ–Њ–і –Њ–њ—Л—В–Њ–Љ. –Ъ–Њ–ї–µ–±–∞–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞ —Г –ґ–Є–≤–Њ—В–љ—Л—Е –Ј–∞–≤–Є—Б—П—В –Њ—В –Љ–љ–Њ–≥–Є—Е –њ—А–Є—З–Є–љ: –≥–ї—Г–±–Є–љ—Л –≤–≤–µ–і–µ–љ–Є—П —В–µ—А–Љ–Њ–Љ–µ—В—А–∞ –≤ –њ—А—П–Љ—Г—О –Ї–Є—И–Ї—Г, –≤—А–µ–Љ–µ–љ–Є –≥–Њ–і–∞, —Б—Г—В–Њ–Ї, –њ–Є—Й–µ–≤–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –Є —В. –і. –Э–Њ—А–Љ–∞–ї—М–љ–Њ–є –≥–ї—Г–±–Є–љ–Њ–є –і–ї—П –≤–≤–µ–і–µ–љ–Є—П —В–µ—А–Љ–Њ–Љ–µ—В—А–∞ –њ—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М 3,5 —Б–Љ. (—Г–і–Њ–±–љ–Њ –љ–∞–і–µ–≤–∞—В—М –љ–∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –≤—Л—Б–Њ—В–µ —В–µ—А–Љ–Њ–Љ–µ—В—А–∞ —А–µ–Ј–Є–љ–Њ–≤–Њ–µ –Ї–Њ–ї–µ—З–Ї–Њ). –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞ –≥–ї—Г–±–Є–љ–µ 3 —Б–Љ —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞ —Г –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї —А–∞–≤–љ–∞ 37,6¬∞, –љ–∞ –≥–ї—Г–±–Є–љ–µ 4 —Б–Љ 38,3¬∞, –∞ –њ—А–Є 7,5 —Б–Љ 39,4¬∞. –Ф–ї—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –љ–Њ—А–Љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —Г –ґ–Є–≤–Њ—В–љ—Л—Е –і–Њ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –Њ–њ—Л—В–∞. –Ш–Ј–Љ–µ—А–µ–љ–Є–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞ —Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ —Б–ї–µ–і—Г–µ—В –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—М –њ–Њ—Б—В–Њ—П–љ–љ–Њ –≤ –Њ–і–љ–Є –Є —В–µ –ґ–µ —З–∞—Б—Л, –Њ–і–љ–Є–Љ —В–µ—А–Љ–Њ–Љ–µ—В—А–Њ–Љ, –≤–≤–Њ–і—П –µ–≥–Њ –љ–∞ –Њ–і–љ—Г –Є —В—Г –ґ–µ –≥–ї—Г–±–Є–љ—Г.
–Ґ–µ—А–Љ–Њ–Љ–µ—В—А –њ–µ—А–µ–і –≤–≤–µ–і–µ–љ–Є–µ–Љ –≤ –њ—А—П–Љ—Г—О –Ї–Є—И–Ї—Г –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г–µ—В—Б—П —Б–њ–Є—А—В–Њ–Љ, –≤—Л—В–Є—А–∞–µ—В—Б—П –і–Њ—Б—Г—Е–∞, –∞ –Ј–∞—В–µ–Љ —Б–Љ–∞–Ј—Л–≤–∞–µ—В—Б—П (–≤–≤–Њ–і–Є–Љ—Л–є –µ–≥–Њ –Ї–Њ–љ–µ—Ж) –≤–∞–Ј–µ–ї–Є–љ–Њ–Љ.
–Ь–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –і–ї—П –Є–Ј–Љ–µ—А–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–Њ–Љ–µ—Й–∞—О—В –≤ –≥–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М¬≠–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –љ–∞ –ї–∞–і–Њ–љ—М —Б–Њ–≥–љ—Г—В–Њ–є –≤ –ї–Њ–Ї—В–µ–≤–Њ–Љ —Б–≥–Є–±–µ –ї–µ–≤–Њ–є —А—Г–Ї–Є, –љ–∞–ґ–Є–Љ–∞—П –±–Њ–ї—М—И–Є–Љ –њ–∞–ї—М—Ж–µ–Љ –љ–∞ –њ–∞—Е–Њ–≤—Г—О –Њ–±–ї–∞—Б—В—М. –Я–∞–ї—М—Ж–µ–Љ –і—А—Г–≥–Њ–є —А—Г–Ї–Є –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –њ–Њ–≥–ї–∞–ґ–Є–≤–∞–љ–Є–µ (–љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј) –њ–Њ —И–µ—А—Б—В–Є –Њ—В —И–µ–Є –і–Њ —Б–Є–Љ—Д–Є–Ј–∞. –°–њ—Г—Б—В—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–µ–Ї—Г–љ–і –Љ–Њ—А—Б–Ї–∞—П —Б–≤–Є–љ–Ї–∞ –Њ—Б—В–∞–µ—В—Б—П –ї–µ–ґ–∞—В—М —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –љ–µ–њ–Њ–і–≤–Є–ґ–љ–Њ. –Ґ–µ—А–Љ–Њ–Љ–µ—В—А –≤–≤–Њ–і—П—В –≤ –њ—А—П–Љ—Г—О –Ї–Є—И–Ї—Г —Б–љ–∞—З–∞–ї–∞ –њ–Њ—З—В–Є –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ, –∞ –Ј–∞—В–µ–Љ –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –ї–Є–љ–Є–µ–є –Њ—Б–Є —В–µ–ї–∞ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Ч–∞–Љ–µ—З–∞—О—В –≤—А–µ–Љ—П –Є —Б–ї–µ–і—П—В –Ј–∞ —Б—В–Њ–ї–±–Є–Ї–Њ–Љ —А—В—Г—В–Є.
–Ъ—А–Њ–ї–Є–Ї–Њ–≤ –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ –Ї–Њ–ї–µ–љ–Є, –Њ—Е–≤–∞—В—Л–≤–∞—О—В –ї–µ–≤–Њ–є —А—Г–Ї–Њ–є —Б —Г–њ–Њ—А–Њ–Љ –≥–Њ–ї–Њ–≤—Л –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –≤ –ї–Њ–Ї—В–µ–≤–Њ–є —Б–≥–Є–± –Є —В–Њ–є –ґ–µ —А—Г–Ї–Њ–є –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В –Є –њ–Њ–і–љ–Є–Љ–∞—О—В —Е–≤–Њ—Б—В; –њ—А–∞–≤–Њ–є —А—Г–Ї–Њ–є –≤–≤–Њ–і—П—В —В–µ—А–Љ–Њ–Љ–µ—В—А. –Ш–ї–Є –ґ–µ –Ї—А–Њ–ї–Є–Ї–∞ –Ј–∞–≤–µ—А—В—Л–≤–∞—О—В –≤ –Ї—Г—Б–Њ–Ї –Ї–∞–Ї–Њ–≥–Њ-–ї–Є–±–Њ –њ–ї–Њ—В–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ (¬Ђ–њ–µ–ї–µ–љ–∞—О—В¬ї), –њ–Њ–і—В—П–≥–Є–≤–∞—П –Ї–Њ–љ–µ—З–љ–Њ—Б—В–Є –њ–Њ–і –ґ–Є–≤–Њ—В. –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л —Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Є–≤–µ–і–µ–љ—Л –≤—Л—И–µ, –≤ —В–∞–±–ї–Є—Ж–µ 4.
–Я–Њ–і–≥–Њ—В–Њ–≤–Ї–∞ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤ –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П.
–Ь–∞—В–µ—А–Є–∞–ї–Њ–Љ –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є–є –Њ–±—Л—З–љ–Њ —Б–ї—Г–ґ–∞—В —Н–Љ—Г–ї—М—Б–Є–Є, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–µ –Є–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є –њ—А–Є—Б–ї–∞–љ–љ–Њ–≥–Њ –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П –Љ–Њ–≥—Г—В –±—Л—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ –Є—Б—В–µ—З–µ–љ–Є—П, –Љ–Њ–Ї—А–Њ—В–∞, –Ї—А–Њ–≤—М, –Њ—В–і–µ–ї–µ–љ–Є—П —А–∞–љ, —П–Ј–≤ –Є —В. –њ., –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –Њ—В –±–Њ–ї—М–љ—Л—Е. –≠–Љ—Г–ї—М—Б–Є–Є –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ (—В–Ї–∞–љ–µ–є) –Њ–±—Л—З–љ–Њ –≥–Њ—В–Њ–≤—П—В—Б—П –љ–∞ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ, –њ—А–Є–Љ–µ—А–љ–Њ –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:10. –Ф–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –±–µ—А—Г—В—Б—П –љ–µ–±–Њ–ї—М—И–Є–µ –Ї—Г—Б–Њ—З–Ї–Є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ—А–∞–ґ–µ–љ–љ—Л—Е —Г—З–∞—Б—В–Ї–Њ–≤ –Є —А–∞—Б—В–Є—А–∞—О—В—Б—П —Б —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –≤ —Б—В–µ—А–Є–ї—М–љ–Њ–є —Б—В—Г–њ–Ї–µ –і–Њ –њ–Њ–ї—Г—З–µ–љ–Є—П —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ–є –≤–Ј–≤–µ—Б–Є. –Я–Њ—Б–ї–µ–і–љ—П—П –≤–≤–Њ–і–Є—В—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –ґ–Є–≤–Њ—В–љ—Л–Љ –Є–ї–Є –ґ–µ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ —Д–Є–ї—М—В—А—Г–µ—В—Б—П –≤ –њ—А–Њ—Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Г—О –њ–Њ—Б—Г–і—Г —З–µ—А–µ–Ј –Љ–∞—А–ї—О (–≤–∞—В—Г). –Я—А–Є –љ–∞–ї–Є—З–Є–Є —В—А—Г–і–љ–Њ —А–∞—Б—В–Є—А–∞–µ–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–Њ–±–∞–≤–ї—П—О—В –њ—А–Њ–Ї–∞–ї–µ–љ–љ—Л–є –њ–µ—Б–Њ–Ї, –Є –њ–Њ—Б–ї–µ –њ–Њ–ї—Г—З–µ–љ–Є—П —Н–Љ—Г–ї—М—Б–Є–Є —Д–Є–ї—М—В—А—Г—О—В –µ–µ —З–µ—А–µ–Ј –Љ–∞—А–ї—О.
–С–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Г—О –Ї—Г–ї—М—В—Г—А—Г –≥–Њ—В–Њ–≤—П—В –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П —Б–Њ–≥–ї–∞—Б–љ–Њ —Б—Е–µ–Љ–µ –Њ–њ—Л—В–∞ –Є–ї–Є –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ –≤—Л–і–µ–ї–µ–љ–Є—О –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —З—В–Њ —Г–Ї–∞–Ј–∞–љ–Њ –≤ —Б—Е–µ–Љ–µ –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є. –Ъ—А–Њ–Љ–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П, —Б–ї–µ–і—Г–µ—В –њ–Њ–і–≥–Њ—В–Њ–≤–Є—В—М –±–µ–ї—Г—О –≤–∞—В—Г, —Б–њ–Є—А—В, –Ј–∞–≥–Њ—В–Њ–≤–Є—В—М —Н—В–Є–Ї–µ—В–Ї–Є –љ–∞ –Ї–ї–µ—В–Ї–Є –њ–Њ–і–Њ–њ—Л—В–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –∞ —В–∞–Ї–ґ–µ –Ј–∞—А–∞–љ–µ–µ –њ—А–Њ—Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ –Љ–∞–ї–µ–љ—М–Ї–Є–µ –њ–∞–Ї–µ—В–Є–Ї–Є —Б –≤–∞—В–Њ–є –Є —В.–і. –Э–∞ —Н—В–Є–Ї–µ—В–Ї–∞—Е –і–ї—П –Ї–ї–µ—В–Њ–Ї (–±–∞–љ–Њ–Ї) —Г–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П —Д–∞–Љ–Є–ї–Є—П –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–∞ –і–∞–љ–љ—Л–є –Њ–њ—Л—В —Б–Њ—В—А—Г–і–љ–Є–Ї–∞, –і–∞—В–∞, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є –≤–Є–і –ґ–Є–≤–Њ—В–љ—Л—Е, —З–µ–Љ –њ—А–Є–≤–Є—В—Л, –Љ–µ—В–Њ–і –њ—А–Є–≤–Є–≤–Ї–Є –Є –≤–≤–Њ–і–Є–Љ–∞—П –і–Њ–Ј–∞.
–Я–Њ–і–≥–Њ—В–Њ–≤–Ї–∞ —И–њ—А–Є—Ж–Њ–≤ –Ї –Ј–∞—А–∞–ґ–µ–љ–Є—О.
–Ф–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є –Ј–∞—А–∞–ґ–µ–љ–Є–Є –ґ–Є–≤–Њ—В–љ—Л—Е —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ –њ—А–Є—С–Љ—Л, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –≤ —Б–µ–±—П:
–Я–Њ–і–≥–Њ—В–Њ–≤–Ї—Г —И–њ—А–Є—Ж–Њ–≤ –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П,
| –Э–∞–њ–Њ–ї–љ–µ–љ–Є–µ —И–њ—А–Є—Ж–Њ–≤ –Ј–∞—А–∞–Ј–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ,
| –Ч–∞—А–∞–ґ–µ–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е,
| –†–∞–Ј–±–Њ—А–Ї–∞ —И–њ—А–Є—Ж–Њ–≤ –њ–Њ—Б–ї–µ –Ј–∞—А–∞–ґ–µ–љ–Є—П,
| –Ю–±–µ–Ј–Ј–∞—А–∞–ґ–Є–≤–∞–љ–Є–µ.
|
¬Ј
–®–њ—А–Є—Ж—Л –і–Њ–ї–ґ–љ—Л –Њ—В–≤–µ—З–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–Љ —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ: –њ–Њ—А—И–µ–љ—М –і–Њ–ї–ґ–µ–љ –њ–ї–Њ—В–љ–Њ –≤—Е–Њ–і–Є—В—М –≤ —Ж–Є–ї–Є–љ–і—А, –љ–µ –≤—Л–њ–∞–і–∞—В—М –Є–Ј –љ–µ–≥–Њ, —Б–≤–Њ–±–Њ–і–љ–Њ –і–≤–Є–≥–∞—В—М—Б—П –≤ –љ—С–Љ, –љ–µ –њ—А–Њ–њ—Г—Б–Ї–∞—В—М –љ–∞–±—А–∞–љ–љ—Г—О –і–ї—П –Ї–Њ–љ—В—А–Њ–ї—П –≤–Њ–і—Г –Ј–∞ –њ–Њ—А—И–µ–љ—М, —Ж–Є–ї–Є–љ–і—А –љ–µ –і–Њ–ї–ґ–µ–љ –Є–Љ–µ—В—М —В—А–µ—Й–Є–љ.
–Я—А–Є —Б–±–Њ—А–Ї–µ —И–њ—А–Є—Ж–∞ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ—А–Ї–Є –Є–≥–ї—Л –љ–∞ –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В—М, –Њ–њ—А–µ–і–µ–ї—П—О—В –њ—А–Є—В—С—А—В–Њ—Б—В—М –Є–≥–ї—Л –Ї –Ї–∞–љ—О–ї–µ —Ж–Є–ї–Є–љ–і—А–∞ вАУ —И–њ—А–Є—Ж –љ–∞—Б—Г—Е–Њ –≤—Л—В–Є—А–∞—О—В —Б—В–µ—А–Є–ї—М–љ—Л–Љ –≤–∞—В–љ—Л–Љ —В–∞–Љ–њ–Њ–љ–Њ–Љ, –љ–∞–њ–Њ–ї–љ—П—О—В —З–µ—А–µ–Ј –Є–≥–ї—Г –≤–Њ–і–Њ–є –Є–Ј —Б—В–µ—А–Є–ї–Є–Ј–∞—В–Њ—А–∞, –≤–Њ–і—Г –њ–Њ–і –±–Њ–ї—М—И–Є–Љ –і–∞–≤–ї–µ–љ–Є–µ–Љ –≤—Л–њ—Г—Б–Ї–∞—О—В –Є –њ—А–Њ–≤–µ—А—П—О—В –Љ–µ—Б—В–Њ –љ–∞—Б–∞–і–Ї–Є –Є–≥–ї—Л вАУ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Ї–∞–њ–µ–ї—М –≤ —Н—В–Њ–Љ –Љ–µ—Б—В–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ—А–∞–≤–Є–ї—М–љ–Њ–є —Б–±–Њ—А–Ї–µ —И–њ—А–Є—Ж–∞, –њ–ї–Њ—В–љ–Њ–є –њ—А–Є—В—С—А—В–Њ—Б—В–Є –Є–≥–ї—Л –Ї –Ї–∞–љ—О–ї–µ –Є –њ—А–Є–≥–Њ–і–љ–Њ—Б—В–Є –µ–≥–Њ –Ї —А–∞–±–Њ—В–µ —Б –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ. –Э–∞–њ–Њ–ї–љ–µ–љ–Є–µ —И–њ—А–Є—Ж–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ –њ—А–Њ–≤–Њ–і—П—В –љ–∞–і —С–Љ–Ї–Њ—Б—В—М—О —Б –і–µ–Ј—А–∞—Б—В–≤–Њ—А–Њ–Љ. –Я—А–Є –љ–∞–њ–Њ–ї–љ–µ–љ–Є–Є —И–њ—А–Є—Ж–∞ —Б–ї–µ–і—Г–µ—В –Є–Ј–±–µ–≥–∞—В—М –њ–Њ–њ–∞–і–∞–љ–Є—П –≤ –љ–µ–≥–Њ –њ—Г–Ј—Л—А—М–Ї–Њ–≤ –≤–Њ–Ј–і—Г—Е–∞. –Я—Г–Ј—Л—А—М–Ї–Є –≤–Њ–Ј–і—Г—Е–∞ –Є–Ј —И–њ—А–Є—Ж–∞ —Б –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ —Г–і–∞–ї—П—В—М –Ї–∞—В–µ–≥–Њ—А–Є—З–µ—Б–Ї–Є –Ј–∞–њ—А–µ—Й–∞–µ—В—Б—П. –Т–≤–Њ–і–Є—В—М –ґ–Є–≤–Њ—В–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї —Б –њ—Г–Ј—Л—А—М–Ї–∞–Љ–Є –≤–Њ–Ј–і—Г—Е–∞ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П, —В.–Ї. —Н—В–Њ –Љ–Њ–ґ–µ—В –њ–Њ–≤–ї–µ—З—М –Ј–∞ —Б–Њ–±–Њ–є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Ї–∞–њ–µ–ї—М –њ—А–Є –Є–Ј–≤–ї–µ—З–µ–љ–Є–µ –Є–≥–ї—Л –њ–Њ—Б–ї–µ –Ј–∞—А–∞–ґ–µ–љ–Є—П. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї —Б–ї–µ–і—Г–µ—В –≤—Л–њ—Г—Б—В–Є—В—М –≤ —В–∞–Љ–њ–Њ–љ, –њ–Њ–≥—А—Г–ґ—С–љ–љ—Л–є –≤ –і–µ–Ј—А–∞—Б—В–≤–Њ—А, —И–њ—А–Є—Ж —А–∞–Ј–Њ–±—А–∞—В—М –Є –њ–Њ–Љ–µ—Б—В–Є—В—М –≤ —С–Љ–Ї–Њ—Б—В—М –і–ї—П –Ї–Є–њ—П—З–µ–љ–Є—П. –Ф–ї—П –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ј–∞–њ–∞—Б–љ–Њ–є —И–њ—А–Є—Ж. –®–њ—А–Є—Ж —Б –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ —Б–ї–µ–і—Г–µ—В –і–µ—А–ґ–∞—В—М –љ–∞–і —С–Љ–Ї–Њ—Б—В—М—О —Б –і–µ–Ј. —А–∞—Б—В–≤–Њ—А–Њ–Љ –≥–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М–љ–Њ –Љ–µ–ґ–і—Г —Г–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л–Љ –Є —Б—А–µ–і–љ–Є–Љ –њ–∞–ї—М—Ж–µ–Љ —Б–љ–Є–Ј—Г –Є –±–Њ–ї—М—И–Є–Љ –њ–∞–ї—М—Ж–µ–Љ —Б–≤–µ—А—Е—Г, –љ–µ –Ї–∞—Б–∞—П—Б—М –њ–Њ—А—И–љ—П.
–†–∞–Ј–±–Њ—А–Ї–∞ —И–њ—А–Є—Ж–Њ–≤ –њ–Њ—Б–ї–µ –Ј–∞—А–∞–ґ–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є—В—Б—П –љ–∞–і —С–Љ–Ї–Њ—Б—В—М—О, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є –і–ї—П –Ї–Є–њ—П—З–µ–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е. –Ф–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П —А–∞–Ј–±—А—Л–Ј–≥–Є–≤–∞–љ–Є—П –њ—А–Є —А–∞–Ј–±–Њ—А–Ї–µ —И–њ—А–Є—Ж –і–Њ–ї–ґ–µ–љ –±—Л—В—М –Њ–њ—Г—Й–µ–љ –≤ —С–Љ–Ї–Њ—Б—В—М –Є–≥–ї–Њ–є –≤–љ–Є–Ј. –Ю—Б—В–Њ—А–Њ–ґ–љ–Њ –њ–Є–љ—Ж–µ—В–Њ–Љ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ —Б–љ–Є–Љ–∞–µ—В—Б—П –Є –Њ–њ—Г—Б–Ї–∞–µ—В—Б—П –Є–≥–ї–∞, –њ–Њ—А—И–µ–љ—М –Є —Ж–Є–ї–Є–љ–і—А. –Я–Є–љ—Ж–µ—В –њ–Њ—Б–ї–µ —А–∞–Ј–±–Њ—А–Ї–Є –Њ–њ—Г—Б–Ї–∞—О—В –≤ —Б—В–∞–Ї–∞–љ —Б–Њ —Б–њ–Є—А—В–Њ–Љ. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –≤ —И–њ—А–Є—Ж–µ –Њ—Б—В–∞—В–Ї–Њ–≤ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –µ–≥–Њ –њ–µ—А–µ–і —А–∞–Ј–±–Њ—А–Ї–Њ–є —И–њ—А–Є—Ж–∞ –≤—Л–њ—Г—Б–Ї–∞—О—В –≤ —В–∞–Љ–њ–Њ–љ, –њ–Њ–≥—А—Г–ґ—С–љ–љ—Л–є –≤ –і–µ–Ј. —А–∞—Б—В–≤–Њ—А.
–Ш–љ—Б—В—А—Г–Љ–µ–љ—В—Л —В–Њ—В—З–∞—Б –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Є–љ—К–µ–Ї—Ж–Є–Є —А–∞–Ј–±–Є—А–∞—О—В—Б—П (—И–њ—А–Є—Ж—Л) –Є –≤–љ–Њ–≤—М –Ї–Є–њ—П—В—П—В—Б—П 10 –Љ–Є–љ—Г—В –Є –±–Њ–ї—М—И–µ (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Є–≤–Є–≤–Њ—З–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞). –Ш–љ—Б—В—А—Г–Љ–µ–љ—В—Л –њ–Њ—Б–ї–µ –Ї–Є–њ—П—З–µ–љ–Є—П –≤—Л—В–Є—А–∞—О—В –і–Њ—Б—Г—Е–∞ –Є —Е—А–∞–љ—П—В –≤ –Ї–Њ—А–Њ–±–Ї–∞—Е –≤ —И–Ї–∞—Д—Г. –Ш–≥–ї—Л –њ–Њ—Б–ї–µ –Ї–Є–њ—П—З–µ–љ–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–і—Г—В—М, –Ј–∞—В–µ–Љ –≤—Б—В–∞–≤–Є—В—М –Љ–∞–љ–і—А–µ–љ, —В. –µ. –љ–µ—А–ґ–∞–≤–µ—О—Й—Г—О –ї–∞—В—Г–љ–љ—Г—О –њ—А–Њ–≤–Њ–ї–Њ—З–Ї—Г. –°—В–∞–ї—М–љ—Л–µ –Є–≥–ї—Л (—Б –Љ–∞–љ–і—А–µ–љ–∞–Љ–Є), –≤ —Ж–µ–ї—П—Е –њ—А–µ–і–Њ—Е—А–∞–љ–µ–љ–Є—П –Є—Е –Њ—В —А–ґ–∞–≤—З–Є–љ—Л, –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М —В–∞–Ї–ґ–µ –≤ –љ–∞—Б—Л—Й–µ–љ–љ–Њ–Љ –љ–∞ —Е–Њ–ї–Њ–і—Г –Є –њ—А–Њ—Д–Є–ї—М—В—А–Њ–≤–∞–љ–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –±—Г—А—Л –Є–ї–Є –ґ–µ –≤ –ґ–Є–і–Ї–Њ—Б—В–Є —Б–ї–µ–і—Г—О—Й–µ–≥–Њ —Б–Њ—Б—В–∞–≤–∞: –Ї–∞—А–±–Њ–ї–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ (–ґ–Є–і–Ї–∞—П) 0,3 –Љ–ї + —Б–Њ–і–∞ –і–≤—Г—Г–≥–ї–µ–Ї–Є—Б–ї–∞—П 1,5 –≥ + —Д–Њ—А–Љ–∞–ї–Є–љ 2 –Љ–ї + –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–∞—П –≤–Њ–і–∞ 100 –Љ–ї.
–§–Є–Ї—Б–∞—Ж–Є—П, –Љ–µ—В–Њ–і—Л –Ј–∞—А–∞–ґ–µ–љ–Є—П –Є –≤–Ј—П—В–Є—П –Ї—А–Њ–≤–Є —Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
–§–Є–Ї—Б–∞—Ж–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е. –Я—А–Є –Ј–∞—А–∞–ґ–µ–љ–Є–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Є–Љ–µ–љ—П—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ, –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Є–і–∞ –ґ–Є–≤–Њ—В–љ—Л—Е –Є –Љ–µ—В–Њ–і–∞ –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞, —Б–њ–Њ—Б–Њ–±—Л —Д–Є–Ї—Б–∞—Ж–Є–Є. –Ф–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –і–Њ–≤–Њ–ї—М–љ–Њ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –≤—Б—П–Ї–Њ–≥–Њ —А–Њ–і–∞ —Б—В–∞–љ–Ї–Њ–≤, –і–Њ—Б–Њ–Ї-—Д–Є–Ї—Б–∞—В–Њ—А–Њ–≤ –Є —В.–њ., –љ–Њ –≤ –Њ–±—Л—З–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —А–∞–±–Њ—В–µ –≤–њ–Њ–ї–љ–µ –Љ–Њ–ґ–љ–Њ –Њ–±–Њ–є—В–Є—Б—М –±–µ–Ј –њ–Њ–і–Њ–±–љ—Л—Е –њ—А–Є—Б–њ–Њ—Б–Њ–±–ї–µ–љ–Є–є.
–Ш—Б–Ї–ї—О—З–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–ї—П–µ—В —В–Њ–ї—М–Ї–Њ –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Ї—А–Њ–ї–Є–Ї–Њ–≤ –≤ –Љ–Њ–Ј–≥ –Є–ї–Є –њ–Њ–і —В–≤–µ—А–і—Г—О –Љ–Њ–Ј–≥–Њ–≤—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г, –Ї–Њ–≥–і–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ —Д–Є–Ї—Б–Є—А—Г—О—Й–Є–є —Б—В–Њ–ї–Є–Ї.
–Т –Њ–±—Л—З–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е —Д–Є–Ї—Б–∞—Ж–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ. –Ъ—А–Њ–ї–Є–Ї–Њ–≤ –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ —Б—В–Њ–ї –≤ –ї–µ–≤–Њ–Љ –±–Њ–Ї–Њ–≤–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, –≥–Њ–ї–Њ–≤–Њ–є –≤–њ—А–∞–≤–Њ –Њ—В –Њ–њ–µ—А–∞—В–Њ—А–∞. –Т —Н—В–Њ—В –Љ–Њ–Љ–µ–љ—В —Д–Є–Ї—Б–Є—А—Г—О—В –Ї—А–Њ–ї–Є–Ї–∞ –њ—А–∞–≤–Њ–є —А—Г–Ї–Њ–є –Ј–∞ –Ї–Њ–ґ–љ—Г—О —Б–Ї–ї–∞–і–Ї—Г –љ–∞ —Б–њ–Є–љ–µ; –ї–µ–≤—Г—О –ґ–µ —А—Г–Ї—Г –ї–∞–і–Њ–љ—М—О –≤–≤–µ—А—Е –њ–Њ–і–≤–Њ–і—П—В –њ–Њ–і –ґ–Є¬≠–≤–Њ—В –Ї—А–Њ–ї–Є–Ї–∞, –±–ї–Є–ґ–µ –Ї –Ј–∞–і–љ–Є–Љ –Ї–Њ–љ–µ—З–љ–Њ—Б—В—П–Љ. –Ч–∞—В–µ–Љ –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В –Љ–µ–ґ–і—Г —Г–Ї–∞¬≠–Ј–∞—В–µ–ї—М–љ—Л–Љ–Є —Б—А–µ–і–љ–Є–Љ –њ–∞–ї—М—Ж–∞–Љ–Є –ї–µ–≤–Њ–µ –±–µ–і—А–Њ (–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –≤—Л—И–µ), –∞ –±–Њ–ї—М—И–Њ–є –њ–∞¬≠–ї–µ—Ж –Њ—Е–≤–∞—В—Л–≤–∞–µ—В —В–µ–ї–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –њ—А–∞–≤–Њ–≥–Њ –њ–∞—Е–∞. –Я—А–Є–њ–Њ–і–љ—П–≤ –Ј–∞–і–љ—О—О —З–∞—Б—В—М –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Є, –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—П –њ—А–∞–≤—Г—О —А—Г–Ї—Г, –њ–Њ–і–≤–Њ–і—П—В –µ–µ (–ї–∞–і–Њ–љ—М—О –≤–≤–µ—А—Е) –њ–Њ–і –≥—А—Г–і–љ—Г—О –Ї–ї–µ—В–Ї—Г –њ–Њ–Ј–∞–і–Є –њ–µ—А–µ–і–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є. –Ч–∞—В–µ–Љ –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В —Г–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л–Љ –Є —Б—А–µ–і–љ–Є–Љ –њ–∞–ї—М—Ж–∞–Љ–Є –≤—Л—И–µ –ї–Њ–Ї—В—П –ї–µ–≤—Г—О –љ–Њ–≥—Г, –∞ –±–Њ–ї—М—И–Є–Љ –њ–∞–ї—М—Ж–µ–Љ –Њ—Е–≤–∞—В—Л–≤–∞—О—В –≥—А—Г–і—М –≤ –Њ–±–ї–∞—Б—В–Є –њ—А–∞–≤–Њ–є –њ–Њ–і–Љ—Л—И–Ї–Є —В–∞–Ї, —З—В–Њ–±—Л –њ—А–∞–≤–∞—П –љ–Њ–≥–∞ –±—Л–ї–∞ –≤—Л–љ–µ—Б–µ–љ–∞ –≤–њ–µ—А–µ–і. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Ї—А–Њ–ї–Є–Ї–∞ —Б–љ–Є–Љ–∞—О—В —Б–Њ —Б—В–Њ–ї–∞ –Є –≤—Л—В—П–≥–Є–≤–∞—О—В –≤–Њ –≤—Б—О –і–ї–Є–љ—Г.
–Ф–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л—Е –Є–љ—К–µ–Ї—Ж–Є–є —Г–і–Њ–±–љ–µ–µ –≤—Б–µ–≥–Њ –Ј–∞–≤–µ—А—В—Л–≤–∞—В—М (¬Ђ–њ–µ–ї–µ–љ–∞—В—М¬ї) –Ї—А–Њ–ї–Є–Ї–∞ –≤ –Ї—Г—Б–Њ–Ї –њ–ї–Њ—В–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –њ–Њ–і–Њ–≥–љ—Г–≤ –µ–Љ—Г –љ–Њ–≥–Є –њ–Њ–і –ґ–Є–≤–Њ—В; –≥–Њ–ї–Њ–≤—Г –Ї—А–Њ–ї–Є–Ї–∞ –Њ—Б—В–∞–≤–ї—П—О—В —Б–≤–Њ–±–Њ–і–љ–Њ–є. –Ц–Є–≤–Њ—В–љ–Њ–µ –њ—А–Є —Н—В–Є—Е —Б–њ–Њ—Б–Њ–±–∞—Е —Д–Є–Ї—Б–∞—Ж–Є–Є –і–µ—А–ґ–Є—В –њ–Њ–Љ–Њ—Й–љ–Є–Ї.
–Ф–ї—П —Н—В–Њ–є —Ж–µ–ї–Є —Б—Г—Й–µ—Б—В–≤—Г—О—В —В–∞–Ї–ґ–µ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Ј–∞–Ї—А—Л—В—Л–µ —П—Й–Є–Ї–Є (–±–Њ–Ї—Б—Л) —Б –Њ—В–≤–µ—А—Б—В–Є–µ–Љ —В–Њ–ї—М–Ї–Њ –і–ї—П –≥–Њ–ї–Њ–≤—Л.
–Ґ—Г–ї–Њ–≤–Є—Й–µ –Ї—А–Њ–ї–Є–Ї–∞ –њ–ї–Њ—В–љ–Њ –Ј–∞–ґ–Є–Љ–∞—О—В –Љ–µ–ґ–і—Г –Ї–Њ–ї–µ–љ—П–Љ–Є –Є–ї–Є –њ—А–Є–ґ–Є–Љ–∞—О—В –ї–Њ–Ї—В–µ–Љ –ї–µ–≤–Њ–є —А—Г–Ї–Є, –Њ—Б—В–∞–≤–ї—П—П —Б–≤–Њ–±–Њ–і–љ–Њ–є –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –љ–µ–Њ–±¬≠—Е–Њ–і–Є–Љ—Л—Е –Љ–∞–љ–Є–њ—Г–ї—П—Ж–Є–є –≥–Њ–ї–Њ–≤—Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, –њ–Њ–≤–µ—А–љ—Г—В—Г—О –≤–њ—А–∞–≤–Њ.
–§–Є–Ї—Б–∞—Ж–Є—П –≥–Њ–ї–Њ–≤—Л –Ї—А–Њ–ї–Є–Ї–∞. –Ф–ї—П —Н—В–Њ–≥–Њ —Г–і–Њ–±–љ–Њ –њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –±–Њ–Ї—Б–Њ–Љ (—А–Є—Б.8), –Є–Љ–µ—О—Й–Є–Љ –≤–Є–і —П—Й–Є–Ї–∞ —Б –≤–µ—А—Е–љ–µ–є –≤—Л–і–≤–Є–ґ–љ–Њ–є –Ї—А—Л—И–Ї–Њ–є. –Я–µ—А–µ–і–љ—П—П —Б—В–µ–љ–Ї–∞ —П—Й–Є–Ї–∞ —Б–Њ—Б—В–Њ–Є—В –Є–Ј –і–≤—Г—Е —З–∞—Б—В–µ–є: —Г–Ї—А–µ–њ–ї–µ–љ–љ–Њ–є –љ–µ–њ–Њ–і–≤–Є–ґ–љ–Њ –љ–Є–ґ–љ–µ–є, –Є –≤—Л–і–≤–Є–≥–∞—О—Й–µ–є—Б—П –≤–µ—А—Е–љ–µ–є. –Я–Њ—Б–µ—А–µ–і–Є–љ–µ –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є –Є–Љ–µ–µ—В—Б—П –Ї—А—Г–≥–ї–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ –і–Є–∞–Љ–µ—В—А–Њ–Љ 5 —Б–Љ, —Б–Њ—Б—В–Њ—П—Й–µ–µ –Є–Ј –і–≤—Г—Е –њ–Њ–ї–Њ–≤–Є–љ: –Њ–і–љ–∞ –њ–Њ–ї–Њ–≤–Є–љ–∞ –≤—Л—А–µ–Ј–∞–љ–∞ –љ–∞ –љ–Є–ґ–љ–µ–є, –і—А—Г–≥–∞—ПвАФ–љ–∞ –≤–µ—А—Е–љ–µ–є –≤—Л–і–≤–Є–≥–∞—О—Й–µ–є—Б—П —З–∞—Б—В–Є –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є. –І–µ—А–µ–Ј —Н—В–Њ –Њ—В–≤–µ—А—Б—В–Є–µ –≤—Л–≤–Њ–і—П—В –љ–∞—А—Г–ґ—Г –Є —Д–Є–Ї—Б–Є—А—Г—О—В –≥–Њ–ї–Њ–≤—Г –Ї—А–Њ–ї–Є–Ї–∞. –Т –Ј–∞–і–љ–µ–є —З–∞—Б—В–Є —П—Й–Є–Ї–∞ —Б –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б—В–Њ—А–Њ–љ—Л –љ–∞ –Њ–±–µ–Є—Е –±–Њ–Ї–Њ–≤—Л—Е —Б—В–µ–љ–Ї–∞—Е –љ–∞–±–Є—В–Њ –њ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї—Г –≤–µ—А—В–Є–Ї–∞–ї—М–љ—Л—Е –њ–ї–∞–љ–Њ–Ї, –Љ–µ–ґ–і—Г –Ї–Њ—В–Њ—А—Л–Љ–Є –љ–∞—Е–Њ–і—П—В—Б—П –њ–∞–Ј—Л. –Т—Б—В–∞–≤–ї—П—П –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ —Д–∞–љ–µ—А–љ—Г—О –і–Њ—Й–µ—З–Ї—Г –≤ —В–Њ—В –Є–ї–Є –Є–љ–Њ–є –њ–∞–Ј, –Љ–Њ–ґ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М –Є–ї–Є —Г–Љ–µ–љ—М—И–∞—В—М –і–ї–Є–љ—Г –±–Њ–Ї—Б–∞.
–†–Є—Б. 8. –С–Њ–Ї—Б –і–ї—П —Д–Є–Ї—Б–∞—Ж–Є–Є –≥–Њ–ї–Њ–≤—Л –Ї—А–Њ–ї–Є–Ї–∞.
–Ф–ї–Є–љ–∞ –±–Њ–Ї—Б–∞ 40 —Б–Љ, —И–Є—А–Є–љ–∞ 15 —Б–Љ, –≤—Л—Б–Њ—В–∞ 15,5 —Б–Љ (–≤—Л—Б–Њ¬≠—В–∞ –љ–Є–ґ–љ–µ–є –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є 9 —Б–Љ, –≤–µ—А—Е–љ–µ–євАФ6,5 —Б–Љ). –§–Є–Ї—Б–∞—Ж–Є—П –Ї—А–Њ–ї–Є–Ї–∞ –≤ –±–Њ–Ї—Б–µ –Њ–њ–Є—Б–∞–љ–љ–Њ–є –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ. –Т—Л–і–≤–Є–≥–∞—О—В –≤–µ—А—Е–љ—О—О –Ї—А—Л—И–Ї—Г –±–Њ–Ї—Б–∞ –Є –≤—Л–љ–Є–Љ–∞—О—В –≤–µ—А—Е–љ—О—О –њ–Њ–ї–Њ–≤–Є–љ—Г –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є. –Т —П—Й–Є–Ї —Б–∞–ґ–∞—О—В –Ї—А–Њ–ї–Є–Ї–∞ —В–∞–Ї, —З—В–Њ–±—Л —И–µ—П –µ–≥–Њ –њ—А–Њ—Е–Њ–і–Є–ї–∞ —З–µ—А–µ–Ј –≤—Л–µ–Љ–Ї—Г –љ–Є–ґ–љ–µ–є –њ–Њ–ї–Њ–≤–Є–љ—Л –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –≥–Њ–ї–Њ–≤—Г –ґ–Є–≤–Њ—В¬≠–љ–Њ–≥–Њ —Д–Є–Ї—Б–Є—А—Г—О—В, –Њ–њ—Г—Б–Ї–∞—П –љ–∞ –љ–µ–µ –≤–µ—А—Е–љ—О—О –њ–Њ–ї–Њ–≤–Є–љ—Г –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є. –Т –Њ–і–Є–љ –Є–Ј –њ–∞–Ј–Њ–≤ –≤–і–≤–Є–≥–∞—О—В —Д–∞–љ–µ—А–љ—Г—О –і–Њ—Й–µ—З–Ї—Г; –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—П —В–µ–Љ —Б–∞–Љ—Л–Љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –і–≤–Є–ґ–µ–љ–Є–є –Ї—А–Њ–ї–Є–Ї–∞ –≤ —П—Й–Є–Ї–µ, –∞ –Ј–∞—В–µ–Љ –Ј–∞–Ї—А—Л–≤–∞—О—В –≤–µ—А—Е–љ—О—О –Ї—А—Л—И–Ї—Г, –Ї–Њ—В–Њ—А–∞—П —Д–Є–Ї—Б–Є¬≠—А—Г–µ—В –њ–Њ–і–≤–Є–ґ–љ—Г—О —З–∞—Б—В—М –њ–µ—А–µ–і–љ–µ–є —Б—В–µ–љ–Ї–Є.
–§–Є–Ї—Б–∞—Ж–Є—П –Ї—А–Њ–ї–Є–Ї–∞ –Є –і—А—Г–≥–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е (–Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є, –Ї—А—Л—Б—Л) –≤ –ї–µ–ґ–∞—З–µ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –љ–∞ —Б–њ–Є–љ–µ –Є–ї–Є –ґ–Є–≤–Њ—В–µ.
–Ф–ї—П —Д–Є–Ї—Б–∞—Ж–Є–Є –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є –і—А—Г–≥–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е (–Љ–Њ—А—Б–Ї–Є–µ —Б–≤–Є–љ–Ї–Є, –Ї—А—Л—Б—Л) –≤ –ї–µ–ґ–∞—З–µ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –љ–∞ —Б–њ–Є–љ–µ –Є–ї–Є –ґ–Є–≤–Њ—В–µ –њ–Њ–ї—М–Ј—Г—О—В—Б—П —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–Љ–Є —Б—В–∞–љ–Ї–∞–Љ–Є. –Э–∞–Є–±–Њ–ї–µ–µ –њ—А–Њ—Б—В–Њ —Г—Б—В—А–Њ–µ–љ–љ—Л–є —Б—В–∞–љ–Њ–Ї –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –Њ–±—Л—З–љ—Г—О –і–Њ—Б–Ї—Г –љ–∞ –љ–Є–Ј–Ї–Є—Е –љ–Њ–ґ–Ї–∞—Е, –њ–Њ —А–∞–Ј–Љ–µ—А–∞–Љ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й—Г—О —В–Њ–Љ—Г –Є–ї–Є –і—А—Г–≥–Њ–Љ—Г –≤–Є–і—Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Э–∞ —А–µ–±—А–∞—Е –±–Њ–Ї–Њ–≤—Л—Е —Б—В–Њ—А–Њ–љ –і–Њ—Б–Ї–Є –Є–Љ–µ–µ—В—Б—П –њ–Њ 2 –Ї—А—О—З–Ї–∞ –Є–ї–Є –њ–µ—В–ї–Є. –£ –Њ–і–љ–Њ–≥–Њ –Є–Ј —Г–Ј–Ї–Є—Е –Ї—А–∞–µ–≤ –љ–∞—Е–Њ–і–Є—В—Б—П –њ—А–Є—Б–њ–Њ—Б–Њ–±–ї–µ–љ–Є–µ –і–ї—П —Д–Є–Ї—Б–∞¬≠—Ж–Є–Є –≥–Њ–ї–Њ–≤—Л –ґ–Є–≤–Њ—В–љ–Њ–≥–ЊвАФ–≥–Њ–ї–Њ–≤–Њ–і–µ—А–ґ–∞—В–µ–ї—М. –Ю–љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –љ–∞–і–µ–≤–∞–µ–Љ–Њ–µ –љ–∞ –≥–Њ–ї–Њ–≤—Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Ї–Њ–ї—М—Ж–Њ, —Б–Њ–µ–і–Є–љ–µ–љ–љ–Њ–µ —Б–Њ —И—В–∞—В–Є–≤–Њ–Љ. –Я—А–Є –њ–Њ–Љ–Њ—Й–Є –≤–Є–љ—В–Њ–≤ –≤—Л—Б–Њ—В—Г –Ї–Њ–ї—М—Ж–∞ –љ–∞ —Б—В–Њ–є–Ї–µ —И—В–∞—В–Є–≤–∞ –Љ–Њ–ґ–љ–Њ —А–µ–≥—Г–ї–Є—А–Њ–≤–∞—В—М.
–Ц–Є–≤–Њ—В–љ–Њ–µ –Ї–ї–∞–і—Г—В –≤ —Г–і–Њ–±–љ–Њ–Љ –і–ї—П –Њ–њ—Л—В–∞ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, —Б–њ–Є¬≠–љ–Њ–є –Є–ї–Є –ґ–Є–≤–Њ—В–Њ–Љ –Ї–≤–µ—А—Е—Г. –Т—Б–µ 4 –ї–∞–њ—Л –њ—А–Њ–і–µ–≤–∞—О—В –≤ –њ–µ—В–ї–Є, —Б–і–µ–ї–∞–љ–љ—Л–µ –Є–Ј –±–Є–љ—В–∞, –Ї–Њ—В–Њ—А—Л–µ –Ј–∞—В–µ–Љ –њ–ї–Њ—В–љ–Њ –Ј–∞—В—П–≥–Є–≤–∞—О—В. –°–≤–Њ–±–Њ–і–љ—Л–µ –Ї–Њ–љ—Ж—Л —В–µ—Б–µ–Љ–Њ–Ї –Є–Ј –±–Є–љ—В–∞ (–≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Њ—В –њ–µ—А–µ–і–љ–Є—Е –ї–∞–њ –Є –≤–Њ –≤—В–Њ—А—Г—ОвАФ–Њ—В –Ј–∞–і–љ–Є—Е) –њ—А–Є–≤—П–Ј—Л–≤–∞—О—В –Ї –Ї—А—О—З–Ї–∞–Љ –Є–ї–Є –њ–µ—В–ї—П–Љ –і–Њ—Б–Ї–Є. –§–Є–Ї—Б–∞—Ж–Є—О –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Ї —Б—В–∞–љ–Ї—Г –њ—А–Њ–Є–Ј–≤–Њ–і—П—В —Б –њ–Њ–Љ–Њ—Й–љ–Є–Ї–Њ–Љ.
–§–Є–Ї—Б–∞—Ж–Є—П –Љ–Њ—А—Б–Ї–Њ–є —Б–≤–Є–љ–Ї–Є —А—Г–Ї–∞–Љ–Є. –Ь–Њ—А—Б–Ї—Г—О —Б–≤–Є–љ–Ї—Г –±—А—О—И–Ї–Њ–Љ –Ї–≤–µ—А—Е—Г –Є–ї–Є –љ–∞—А—Г–ґ—Г (—А–Є—Б. 9) –±–µ—А—Г—В –ї–µ–≤–Њ–є —А—Г–Ї–Њ–є —В–∞–Ї, —З—В–Њ–±—Л II –њ–∞–ї–µ—Ж –љ–∞—Е–Њ–і–Є–ї—Б—П –њ–Њ–і —И–µ–µ–є, –∞ I –Є III –њ–∞–ї—М—Ж—ЛвАФ–њ–Њ–і –њ–µ—А–µ–і–љ–Є–Љ–Є –Ї–Њ–љ–µ—З–љ–Њ—Б—В—П–Љ–Є –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Я—А–∞–≤–Њ–є —А—Г–Ї–Њ–є —Б–≤–Є–љ–Ї—Г –њ–Њ–≥–ї–∞–ґ–Є–≤–∞—О—В –њ–Њ –ґ–Є–≤–Њ—В—Г –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –Њ–љ–∞ –љ–µ —Г—Б–њ–Њ–Ї–Њ–Є—В—Б—П, –Є —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞—О—В –Ї –љ–∞–Љ–µ—З–µ–љ–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є, –њ—А–Є–і–µ—А–ґ–Є–≤–∞—П –Ј–∞–і–љ–Є–µ –ї–∞–њ—Л –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ—А–∞–≤–Њ–є —А—Г–Ї–Њ–є.
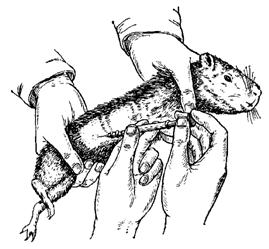
–†–Є—Б. 9. –§–Є–Ї—Б–∞—Ж–Є—П –Љ–Њ—А—Б–Ї–Њ–є —Б–≤–Є–љ–Ї–Є —А—Г–Ї–∞–Љ–Є
–§–Є–Ї—Б–∞—Ж–Є—П –Ї—А—Л—Б. –°–Ї–ї–∞–і–Ї—Г –Ї–Њ–ґ–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ј–∞—В—Л–ї–Ї–∞ –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В –Ї–Њ—А–љ—Ж–∞–љ–≥–Њ–Љ, –њ–ї–Њ—В–љ–Њ –њ—А–Є–ґ–Є–Љ–∞—П –≥–Њ–ї–Њ–≤—Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–Њ–ї–∞. –Ф—А—Г–≥–Њ–є —А—Г–Ї–Њ–є –±–µ—А—Г—В —Е–≤–Њ—Б—В –Ї—А—Л—Б—Л –Є, –њ—А–Є–њ–Њ–і–љ—П–≤ –µ–µ –љ–∞–і –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М—О —Б—В–Њ–ї–∞, –і–µ—А–ґ–∞—В –≤ —В–∞–Ї–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, —З—В–Њ–±—Л –≥–Њ–ї–Њ–≤–∞ —Б–ї–µ–≥–Ї–∞ –Њ—В—В—П–≥–Є–≤–∞–ї–∞—Б—М –Ї–Њ—А–љ—Ж–∞–љ–≥–Њ–Љ (—А–Є—Б. 10).

–†–Є—Б. 10. –§–Є–Ї—Б–∞—Ж–Є—П –Ї—А—Л—Б—Л –Ї–Њ—А–љ—Ж–∞–љ–≥–Њ–Љ
–§–Є–Ї—Б–∞—Ж–Є—П –Љ—Л—И–µ–є. –Ь—Л—И—М –њ—Г—Б–Ї–∞—О—В –њ–Њ —Б—В–Њ–ї—Г, –њ—А–Є–і–µ—А¬≠–ґ–Є–≤–∞—П –µ–µ I –Є II –њ–∞–ї—М—Ж–∞–Љ–Є –њ—А–∞–≤–Њ–є —А—Г–Ї–Є –Ј–∞ –Ї–Њ–љ—З–Є–Ї —Е–≤–Њ—Б—В–∞. –Ъ–Њ–≥–і–∞, –њ—А–Њ–і–≤–Є–≥–∞—П—Б—М –≤ –Ї–∞–Ї–Њ–Љ-–ї–Є–±–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є, –Љ—Л—И—М –љ–∞—В—П–љ–µ—В —Е–≤–Њ—Б—В, –±—Л—Б—В—А—Л–Љ –і–≤–Є–ґ–µ–љ–Є–µ–Љ –ї–µ–≤–Њ–є —А—Г–Ї–Є —Е–≤–∞—В–∞—О—В –µ–µ –Ј–∞ —Б–Ї–ї–∞–і–Ї—Г –Ї–Њ–ґ–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ј–∞—В—Л–ї–Ї–∞, –±–ї–Є–ґ–µ –Ї —Г—И–∞–Љ, —З—В–Њ–±—Л –Њ–љ–∞ –љ–µ –Љ–Њ–≥–ї–∞ –њ–Њ–≤–Њ—А–∞—З–Є–≤–∞—В—М –≥–Њ–ї–Њ–≤—Г (—А–Є—Б. 11, –∞). –Я–Њ–і–љ—П–≤ –Љ—Л—И—М –љ–∞–і —Б—В–Њ–ї–Њ–Љ, –њ–Њ–Љ–Њ—Й–љ–Є–Ї –і–µ—А–ґ–Є—В –µ–µ –љ–∞ –≤–µ—Б—Г –Њ–і–љ–Њ–є —А—Г–Ї–Њ–є –Ј–∞ —Е–≤–Њ—Б—В, –і—А—Г–≥–Њ–євАФ–Ј–∞ —Б–Ї–ї–∞–і–Ї—Г –Ї–Њ–ґ–Є –љ–∞ –Ј–∞—В—Л–ї–Ї–µ, –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞—Б—В—П–≥–Є–≤–∞—П –≤ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є, —Г–і–Њ–±–љ–Њ–Љ –і–ї—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞—В–Њ—А–∞.
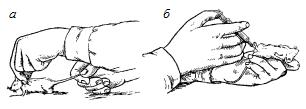
| –†–Є—Б. 11. –§–Є–Ї—Б–∞—Ж–Є—П –Љ—Л—И–Є
|
–†–∞–±–Њ—В–∞—В—М —Б –Љ—Л—И–∞–Љ–Є –Љ–Њ–ґ–љ–Њ –Є –±–µ–Ј –њ–Њ–Љ–Њ—Й–љ–Є–Ї–∞, —Д–Є–Ї—Б–Є—А—Г—П –Є—Е –ї–µ–≤–Њ–є —А—Г–Ї–Њ–є: I –Є II –њ–∞–ї—М—Ж–∞–Љ–Є –ї–µ–≤–Њ–є —А—Г–Ї–Є –ґ–Є–≤–Њ—В–љ–Њ–µ –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В –Ј–∞ —Б–Ї–ї–∞–і–Ї—Г –Ї–Њ–ґ–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ј–∞—В—Л–ї–Ї–∞, –∞ –Њ—Б—В–∞–ї—М–љ—Л–Љ–Є 3 –њ–∞–ї—М—Ж–∞–Љ–Є, –њ—А–Є–ґ–∞–≤ –Є—Е –Ї –Ј–∞–њ—П—Б—В—М—О, –њ—А–Є–і–µ—А–ґ–Є–≤–∞—О—В —Е–≤–Њ—Б—В –Є –Ї–Њ–ґ—Г –≤ –Њ–±–ї–∞—Б—В–Є –Ї—А–µ—Б—В—Ж–∞ (—А–Є—Б. 11, –±). –Я—А–Є —В–∞–Ї–Њ–Љ —Б–њ–Њ—Б–Њ–±–µ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–Є—П –њ—А–∞–≤–Њ–є —Б–≤–Њ–±–Њ–і–љ–Њ–є —А—Г–Ї–Њ–є –Љ–Њ–ґ–љ–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ –Њ–њ–µ—А–∞—Ж–Є–Є.
–°–њ–Њ—Б–Њ–±—Л –Ј–∞—А–∞–ґ–µ–љ–Є—П
–Т –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Ж–µ–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї—М–Ј—Г—О—В—Б—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є –Ј–∞—А–∞–ґ–µ–љ–Є—П: –≤–љ—Г—В—А–Є–Ї–Њ–ґ–љ—Л–Љ, –њ–Њ–і–Ї–Њ–ґ–љ—Л–Љ, –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ—Л–Љ, –≤–љ—Г—В—А–Є–±—А—О—И–Є–љ–љ—Л–Љ, –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ, –њ–µ—А–Њ—А–∞–ї—М–љ—Л–Љ –Є–ї–Є –Є–љ—В—А–∞–љ–∞–Ј–∞–ї—М–љ—Л–Љ –Є –і—А. –Я—А–Є –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е —Б–њ–Њ—Б–Њ–±–∞—Е, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–≥–Њ –Є –Є–љ—В—А–∞–љ–∞–Ј–∞–ї—М–љ–Њ–≥–Њ, –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О —И–њ—А–Є—Ж–∞.
–Т–Ј–≤–µ—Б—М –Љ–Є–Ї—А–Њ–±–љ–Њ–є –Ї—Г–ї—М—В—Г—А—Л, —Н–Љ—Г–ї—М—Б–Є—О –Є–Ј –Ј–∞—А–∞–ґ–µ–љ–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є–ї–Є –Ї—А–Њ–≤—М –±–Њ–ї—М–љ–Њ–≥–Њ –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –љ–∞–±–Є—А–∞—О—В –≤ —И–њ—А–Є—Ж, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –Ї–Њ–љ–µ—Ж –Є–≥–ї—Л –Ј–∞–Ї—А—Л–≤–∞—О—В –Ї—Г—Б–Њ—З–Ї–Њ–Љ –≤–∞—В—Л, —Б–Љ–Њ—З–µ–љ–љ—Л–Љ 5% —А–∞—Б—В–≤–Њ—А–Њ–Љ —Е–ї–Њ—А–∞–Љ–Є–љ–∞, 5% —А–∞—Б—В–≤–Њ—А–Њ–Љ –Ї–∞—А–±–Њ–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–ї–Є —Б–њ–Є—А—В–Њ–Љ. –Я–Њ–≤–µ—А–љ—Г–≤ —И–њ—А–Є—Ж –Є–≥–ї–Њ–є –Ї–≤–µ—А—Е—Г, –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –≤—Л–њ—Г—Б–Ї–∞—О—В –Є–Ј –љ–µ–≥–Њ –њ—Г–Ј—Л—А—М–Ї–Є –≤–Њ–Ј–і—Г—Е–∞. –Ч–∞–≥—А—П–Ј–љ–µ–љ–љ—Г—О –≤–∞—В—Г –±—А–Њ—Б–∞—О—В –≤ –±–∞–љ–Ї—Г —Б –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ.
–Э–∞—А–Ї–Њ–Ј –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
–Ф–ї—П –љ–∞—А–Ї–Њ–Ј–∞ —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Є–Љ–µ–љ—П—О—В —Н—Д–Є—А –Є–ї–Є —Е–ї–Њ—А–Њ—Д–Њ—А–Љ. –Ь—Л—И–µ–є —Г—Б—Л–њ–ї—П—О—В –≤ –±–∞–љ–Ї–µ —Б –њ—А–Є—В–µ—А—В–Њ–є –њ—А–Њ–±–Ї–Њ–є, –Ї—Г–і–∞ –Њ–њ—Г—Б–Ї–∞—О—В –Ї—Г—Б–Њ—З–µ–Ї –≤–∞—В—Л, —Б–Љ–Њ—З–µ–љ–љ–Њ–є —Н—Д–Є—А–Њ–Љ –Є–ї–Є —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ.
–≠—Д–Є—А–Њ–Љ —З–∞—Й–µ –≤—Б–µ–≥–Њ –њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –љ–∞—А–Ї–Њ–Ј–∞ –Љ—Л—И–µ–є, –Ї—А—Л—Б, –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є¬≠–љ–Њ–Ї, –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є —Б–Њ–±–∞–Ї. –Ъ–Њ—И–µ–Ї –Њ–±—Л—З–љ–Њ –љ–∞—А–Ї–Њ—В–Є–Ј–Є—А—Г—О—В —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ, –љ–Њ –Љ–Њ–ґ–љ–Њ –њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є —Б–Љ–µ—Б—М—О —Б–њ–Є—А—В–∞ —Б —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ –Є —Н—Д–Є—А–Њ–Љ (–≤ —А–∞–≤–љ—Л—Е –Њ–±—К–µ–Љ–∞—Е).
–Я—А–Є–Љ–µ–љ—П—О—В —В–∞–Ї–ґ–µ 10% —А–∞—Б—В–≤–Њ—А —Г—А–µ—В–∞–љ–∞ –њ–Њ–і –Ї–Њ–ґ—Г –≤ –і–Њ–Ј–∞—Е: –і–ї—П –Љ—Л—И–µ–євАФ0,15 –Љ–ї, –і–ї—П –Ї—А—Л—БвАФ2-3 –Љ–ї, –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–ЇвАФ1,5-3 –Љ–ї –Є –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤вАФ8-12 –Љ–ї. –Э–∞—А–Ї–Њ–Ј –љ–∞—Б—В—Г–њ–∞–µ—В –Њ–±—Л—З–љ–Њ —З–µ—А–µ–Ј 45вАФ60 –Љ–Є–љ—Г—В. –Э–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —Б—Г—Й–µ—Б—В–≤—Г—О—В –Є –±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Б—Е–µ–Љ—Л –Є –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П –Є –љ–∞—А–Ї–Њ–Ј–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е.
–Т–љ—Г—В—А–Є–Ї–Њ–ґ–љ—Л–є –Љ–µ—В–Њ–і
–Я—А–Є —Н—В–Њ–Љ —Б–њ–Њ—Б–Њ–±–µ –њ—А–Є–Љ–µ–љ—П—О—В —В–Њ–љ–Ї–Є–µ (No18-20) –Њ—Б—В—А—Л–µ –Є–≥–ї—Л —Б –љ–µ–±–Њ–ї—М—И–Є–Љ —Б–Ї–Њ—Б–Њ–Љ.
–Я–Њ—Б–ї–µ —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –≤—Л—Б—В—А–Є–≥–∞–љ–Є—П –Є–ї–Є –±—А–Є—В—М—П –Љ–µ—Б—В–Њ –Є–љ—К–µ–Ї—Ж–Є–Є –њ—А–Њ—В–Є—А–∞—О—В —Б–њ–Є—А—В–Њ–Љ, –Ј–∞—Е–≤–∞—В—Л–≤–∞—О—В –њ–∞–ї—М—Ж–∞–Љ–Є –ї–µ–≤–Њ–є —А—Г–Ї–Є –Ї–Њ–ґ–љ—Г—О —Б–Ї–ї–∞–і–Ї—Г, –≤ –Ї–Њ—В–Њ—А—Г—О –Є –≤–≤–Њ–і—П—В, –њ–Њ—З—В–Є –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ —Б–Ї–ї–∞–і–Ї–µ, –Њ—З–µ–љ—М —В–Њ–љ–Ї—Г—О –Є–≥–ї—Г. –Я—А–Є –њ–Њ–њ–∞–і–∞–љ–Є–Є –≤ –Ї–Њ–ґ—Г –Љ–∞—В–µ—А–Є–∞–ї –њ–Њ—Б—В—Г–њ–∞–µ—В —В–Њ–ї—М–Ї–Њ –њ—А–Є –і–Њ–≤–Њ–ї—М–љ–Њ —Б–Є–ї—М–љ–Њ–Љ –љ–∞–і–∞–≤–ї–Є–≤–∞–љ–Є–Є –љ–∞ –њ–Њ—А—И–µ–љ—М —И–њ—А–Є—Ж–∞ –Є –Њ–±—А–∞–Ј—Г–µ—В –љ–∞ –Љ–µ—Б—В–µ –Є–љ—К–µ–Ї—Ж–Є–Є –≤–Њ–Ј–≤—Л—И–µ–љ–Є–µ —Н–њ–Є–і–µ—А–Љ–Є—Б–∞ –≤ –≤–Є–і–µ –њ—Г–Ј—Л—А—М–Ї–∞ (–≥–Њ—А–Њ—И–Є–љ—Л). –Х—Б–ї–Є —В–∞–Ї–Њ–≥–Њ –њ—Г–Ј—Л—А—М–Ї–∞ –љ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–ї–Њ—Б—М, –Ј–љ–∞—З–Є—В –≤–≤–µ–і–µ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –њ–Њ–њ–∞–ї –љ–µ –≤ —В–Њ–ї—Й—Г –Ї–Њ¬≠–ґ–Є, –∞ –≤ –њ–Њ–і–Ї–Њ–ґ–љ—Г—О –Ї–ї–µ—В—З–∞—В–Ї—Г. –Ь–∞—В–µ—А–Є–∞–ї –≤–љ—Г—В—А–Є–Ї–Њ–ґ–љ–Њ –≤–≤–Њ–і—П—В –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е (0,1вАФ 0,2 –Љ–ї).
–Ш–љ–Њ–≥–і–∞ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –≤—В–Є—А–∞—О—В –≤ –љ–µ–њ–Њ–≤—А–µ–ґ–і–µ–љ–љ—Г—О –Є–ї–Є —Б–Ї–∞—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Г—О –Ї–Њ–ґ—Г, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–є —Г—З–∞—Б—В–Њ–Ї –Ї–Њ—В–Њ—А–Њ–є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –Њ—В —И–µ—А—Б—В–Є, –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В —Б–њ–Є—А—В–Њ–Љ –Є —Е–Њ—А–Њ—И–Њ –≤—Л—Б—Г—И–Є–≤–∞—О—В. –°–Ї–∞—А–Є—Д–Є–Ї–∞—Ж–Є—О –Ї–Њ–ґ–Є –њ—А–Њ–Є–Ј–≤–Њ–і—П—В —Б–Ї–∞–ї—М–њ–µ–ї–µ–Љ, –Њ—Б–њ–µ–љ–љ—Л–Љ –њ–µ—А–Њ–Љ –Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Є–≥–ї–Њ–є –њ—Г—В–µ–Љ –љ–∞–љ–µ—Б–µ–љ–Є—П –љ–∞—Б–µ—З–µ–Ї, —Ж–∞—А–∞–њ–Є–љ. –Ь–∞—В–µ—А–Є–∞–ї (1вАФ2 –Ї–∞–њ–ї–Є) –≤—В–Є—А–∞—О—В —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Њ–є –Є–ї–Є —И–њ–∞—В–µ–ї–µ–Љ –≤ –љ–µ–і–Њ—Б—В—Г–њ–љ—Л—Е —Б–ї–Є–Ј—Л–≤–∞–љ–Є—О –Љ–µ—Б—В–∞—Е.
–Я–Њ–і–Ї–Њ–ґ–љ—Л–є —Б–њ–Њ—Б–Њ–± –Ј–∞—А–∞–ґ–µ–љ–Є—П
–Ъ–Њ–ґ—Г –≤ –Љ–µ—Б—В–µ –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ –±–µ—А—Г—В —Г –µ–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П, –њ—А–Є–њ–Њ–і–љ–Є–Љ–∞—О—В I –Є II –њ–∞–ї—М—Ж–∞–Љ–Є –ї–µ–≤–Њ–є —А—Г–Ї–Є. –Ш–≥–ї—Г —И–њ—А–Є—Ж–∞ –≤–Ї–∞–ї—Л–≤–∞—О—В —Б–љ–Є–Ј—Г –Њ–±—А–∞–Ј–Њ–≤–∞–≤—И–µ–є—Б—П —Б–Ї–ї–∞–і–Ї–Є. –Я—А–Њ–Ї–Њ–ї–Њ–≤ –Ї–Њ–ґ—Г –Є –њ—А–Њ–є–і—П –≤–≥–ї—Г–±—М –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–Є–ї–ї–Є–Љ–µ—В—А–Њ–≤, –Є–≥–ї—Г –Њ—В–Ї–ї–Њ–љ—П—О—В –≤–њ—А–∞–≤–Њ –Є–ї–Є –≤–ї–µ–≤–Њ –Є –Ј–∞—В–µ–Љ –Љ–µ–і–ї–µ–љ–љ–Њ –≤–≤–Њ–і—П—В –Љ–∞—В–µ—А–Є–∞–ї, —Б–Њ–і–µ—А–ґ–∞—Й–Є–є—Б—П –≤ —И–њ—А–Є—Ж–µ. –Ш–Ј–Љ–µ–љ—П—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ –Є–≥–ї—Л –њ–Њ–і –Ї–Њ–ґ–µ–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –≤–≤–µ–і–µ–љ–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –љ–µ –≤—Л—Б—В—Г–њ–∞–ї–Њ —З–µ—А–µ–Ј –њ—А–Њ–Ї–Њ–ї –Ї–Њ–ґ–Є –љ–∞—А—Г–ґ—Г. –Ч–∞—В–µ–Љ —Б–Ї–ї–∞–і–Ї—Г –Ї–Њ–ґ–Є –Њ–њ—Г—Б–Ї–∞—О—В, –љ–∞ –Љ–µ—Б—В–Њ —Г–Ї–Њ–ї–∞ –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В –≤–∞—В–љ—Л–є —В–∞–Љ–њ–Њ–љ, —Б–Љ–Њ—З–µ–љ–љ—Л–є —Б–њ–Є—А—В–Њ–Љ –Є–ї–Є —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ, –∞ –Є–≥–ї—Г –±—Л—Б—В—А–Њ –≤—Л–љ–Є–Љ–∞—О—В. –Э–∞–Є–±–Њ–ї–µ–µ —Г–і–Њ–±–љ—Л–Љ–Є –Љ–µ—Б—В–∞–Љ–Є –і–ї—П –њ–Њ–і–Ї–Њ–ґ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї —П–≤–ї—П—О—В—Б—П –Њ–±–ї–∞—Б—В—М —Б–њ–Є–љ—Л –Є –±–Њ–Ї–Њ–≤—Л–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–Є–ґ–µ –њ–Њ–і–Љ—Л—И–µ—З–љ—Л—Е –≤–њ–∞–і–Є–љ, —Г –Ї—А—Л—Б –Є –Љ—Л—И–µ–є-–Њ–±–ї–∞—Б—В—М —Б–њ–Є–љ—Л, –Ї—А–µ—Б—В—Ж–∞ –Є –Ј–∞—В—Л–ї–Ї–∞. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–Є–і–Ї–Њ—Б—В–Є, –≤–≤–Њ–і–Є–Љ–Њ–є –њ–Њ–і–Ї–Њ–ґ–љ–Њ, –љ–µ –і–Њ–ї–ґ–љ–Њ –њ—А–µ–≤—Л—И–∞—В—М 30 –Љ–ї –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤, 15 –Љ–ї вАФ –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї, 10 –Љ–ївАФ–і–ї—П –Ї—А—Л—Б –Є 1 –Љ–ї вАФ –і–ї—П –Љ—Л—И–µ–є.
–Т–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ—Л–є —Б–њ–Њ—Б–Њ–± –Ј–∞—А–∞–ґ–µ–љ–Є—П
–Т—Л–±–Є—А–∞—О—В —Г—З–∞—Б—В–Њ–Ї —В–µ–ї–∞ —Б –љ–∞–Є–±–Њ–ї–µ–µ —А–∞–Ј–≤–Є—В—Л–Љ –Љ—Л—И–µ—З–љ—Л–Љ —Б–ї–Њ–µ–Љ. –£ –Ї—А–Њ–ї–Є–Ї–Њ–≤, –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї, –Ї—А—Л—Б –Є –Љ—Л—И–µ–є —В–∞–Ї–Є–Љ –Љ–µ—Б—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П –љ–∞¬≠—А—Г–ґ–љ–∞—П –≤–µ—А—Е–љ—П—П —В—А–µ—В—М –±–µ–і—А–∞ –Ј–∞–і–љ–µ–є –ї–∞–њ—Л. –Ч–∞—Е–≤–∞—В—Л–≤–∞—О—В I –Є II –њ–∞–ї—М—Ж–∞–Љ–Є –ї–µ–≤–Њ–є —А—Г–Ї–Є —В–Њ–ї—Б—В—Г—О –Љ—Л—И–µ—З–љ—Г—О —Б–Ї–ї–∞–і–Ї—Г –Є –≤–≤–Њ–і—П—В –Є–≥–ї—Г –њ–Њ—З—В–Є –њ–Њ–і –њ—А—П–Љ—Л–Љ —Г–≥–ї–Њ–Љ –≤ –≥–ї—Г–±—М –Љ—Л—И—Ж. –Ю–±—К–µ–Љ –ґ–Є–і–Ї–Њ—Б—В–Є, –і–Њ–њ—Г—Б—В–Є–Љ—Л–є –і–ї—П –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П, —Б–Њ¬≠—Б—В–∞–≤–ї—П–µ—В –і–ї—П –Ї—А–Њ–ї–Є–Ї–Њ–≤ 8 –Љ–ї, –і–ї—П –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї-5 –Љ–ї, –і–ї—П –Ї—А—Л—Б-3 –Љ–ї, –і–ї—П –Љ—Л—И–µ–є-0,5 –Љ–ї.
–Т–љ—Г—В—А–Є–±—А—О—И–Є–љ–љ—Л–є —Б–њ–Њ—Б–Њ–± –Ј–∞—А–∞–ґ–µ–љ–Є—П
–Я–Њ–Љ–Њ—Й–љ–Є–Ї –і–µ—А–ґ–Є—В –ґ–Є–≤–Њ—В–љ–Њ–µ –≤–љ–Є–Ј –≥–Њ–ї–Њ–≤–Њ–є. –Т —Н—В–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї —Б–Љ–µ—Й–∞–µ—В—Б—П –≤ —Б—В–Њ—А–Њ–љ—Г –і–Є–∞—Д—А–∞–≥–Љ—Л, —З—В–Њ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ —Г–Љ–µ–љ—М—И–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –µ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –≤ –Љ–Њ–Љ–µ–љ—В –њ—А–Њ–Ї–Њ–ї–∞. –£ –ґ–Є–≤–Њ—В–љ—Л—Е (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Љ—Л—И–µ–є) –≤ –љ–Є–ґ–љ–µ–є —В—А–µ—В–Є –ґ–Є–≤–Њ—В–∞, –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Њ—В—Б—В—Г–њ—П –Њ—В —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є, –і–µ–ї–∞—О—В —Б–Ї–∞–ї—М–њ–µ–ї–µ–Љ –Є–ї–Є –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л–Љ–Є –љ–Њ–ґ–љ–Є—Ж–∞–Љ–Є –љ–∞–і—Б–µ—З–Ї—Г –Ї–Њ–ґ–Є –і–ї–Є–љ–Њ–є 2вАФ3 –Љ–Љ –Є —З–µ—А–µ–Ј –љ–µ–µ –≤–≤–Њ–і—П—В –њ—А–Є—В—Г–њ–ї–µ–љ–љ—Г—О –Є–≥–ї—Г, –і–µ—А–ґ–∞ —И–њ—А–Є—Ж –њ–µ—А–њ–µ–љ–і–Є–Ї—Г–ї—П—А–љ–Њ –Ї –±—А—О—И–љ–Њ–є —Б—В–µ–љ–Ї–µ. –Я—А–µ–Њ–і–Њ–ї–µ–≤–∞—П —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є–µ, –Њ—З–µ–љ—М –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ, –±—Г—А–∞–≤—П—Й–Є–Љ–Є –і–≤–Є–ґ–µ–љ–Є—П–Љ–Є –Є–≥–ї—Г –њ—А–Њ–і–≤–Є–≥–∞—О—В –≤–≥–ї—Г–±—М. –І—Г–≤—Б—В–≤–Њ ¬Ђ–њ—А–Њ–≤–∞–ї–∞¬ї, –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є–µ –Њ—Й—Г—Й–µ–љ–Є—П —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П –љ–∞ –њ—Г—В–Є –≥–Њ–≤–Њ—А—П—В –Њ –њ—А–Њ–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –Є–≥–ї—Л –≤ –±—А—О—И–љ—Г—О –њ–Њ¬≠–ї–Њ—Б—В—М. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Є–≥–ї—Г –њ–µ—А–µ–≤–Њ–і—П—В –≤ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Є –≤–≤–Њ–і—П—В —Б–Њ–і–µ—А–ґ–∞—Й–Є–є—Б—П –≤ —И–њ—А–Є—Ж–µ –Љ–∞—В–µ—А–Є–∞–ї –≤ –њ–Њ–ї–Њ—Б—В—М –±—А—О¬≠—И–Є–љ—Л. –Т–љ—Г—В—А–Є–±—А—О—И–Є–љ–љ–Њ –Љ–Њ–ґ–љ–Њ –≤–≤–Њ–і–Є—В—М –і–Њ 30 –Љ–ї –ґ–Є–і–Ї–Њ—Б—В–Є –Ї—А–Њ–ї–Є–Ї–∞–Љ, –і–Њ 10 –Љ–ївАФ–Љ–Њ—А—Б–Ї–Є–Љ —Б–≤–Є–љ–Ї–∞–Љ, –і–Њ 5 –Љ–ївАФ–Ї—А—Л—Б–∞–Љ, –і–Њ 2 –Љ–ївАФ –Љ—Л—И–∞–Љ.
–Т–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Ї—А–Њ–ї–Є–Ї–Њ–≤
–Ъ—А–Њ–ї–Є–Ї–Њ–≤ –Ј–∞—А–∞–ґ–∞—О—В –≤ –Ї—А–∞–µ–≤—Г—О –≤–µ–љ—Г —Г—Е–∞. –Т–і–Њ–ї—М –љ–∞—А—Г–ґ–љ–Њ–≥–Њ –Ї—А–∞—П —Г—Е–∞ –≤—Л—Й–Є–њ—Л–≤–∞—О—В —И–µ—А—Б—В—М, –Ј–∞—В–µ–Љ —Н—В–Њ –Љ–µ—Б—В–Њ —Б–ї–µ–≥–Ї–∞ –њ–Њ—Й–µ–ї–Ї–Є–≤–∞—О—В –Ї–Њ–љ—З–Є–Ї–∞–Љ–Є –њ–∞–ї—М—Ж–µ–≤, —З—В–Њ–±—Л –≤—Л–Ј–≤–∞—В—М –≥–Є–њ–µ—А–µ–Љ–Є—О —Б–Њ—Б—Г–і–Њ–≤, –Є –њ—А–Њ—В–Є—А–∞—О—В –≤–∞—В–Њ–є, —Б–Љ–Њ—З–µ–љ–љ–Њ–є –≤ 70% —Б–њ–Є—А—В–µ –Є–ї–Є –Ї—Б–Є–ї–Њ–ї–Њ–Љ.
–Э–Њ –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї—Б–Є–ї–Њ–ї–∞ –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –≤–≤–Є–і—Г —Б–Є–ї—М–љ–Њ–≥–Њ —А–∞–Ј–і—А–∞–ґ–µ–љ–Є—П –Ї–Њ–ґ–Є. –Я–Њ—Б–ї–µ –Њ–±—А–∞–±–Њ—В–Ї–Є –Ї–Њ–ґ–Є –Ї—Б–Є–ї–Њ–ї–Њ–Љ –µ–≥–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б–љ—П—В—М —Б –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є. –Я–Њ—Б–ї–µ —П–≤–љ–Њ–≥–Њ –љ–∞–±—Г—Е–∞–љ–Є—П –≤–µ–љ—Л –њ–Њ–і —Г—Е–Њ –њ–Њ–і–≤–Њ–і—П—В II –њ–∞–ї–µ—Ж –ї–µ–≤–Њ–є —А—Г–Ї–Є. –Я—А–Њ–Ї–Њ–ї –≤–µ–љ—Л —Б–ї–µ–і—Г–µ—В –і–µ–ї–∞—В—М –±–ї–Є–ґ–µ –Ї –≤–µ—А—Е—Г—И–Ї–µ —Г—Е–∞, —В–∞–Ї –Ї–∞–Ї –њ—А–Є —З–∞—Б—В—Л—Е —Г–Ї–Њ–ї–∞—Е –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –Њ–±–ї–Є—В–µ—А–∞—Ж–Є—П —Б–Њ—Б—Г–і–∞ –≤ —Н—В–Њ–Љ –Љ–µ—Б—В–µ, –љ–Њ –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л–є —Г—З–∞—Б—В–Њ–Ї –≤–µ–љ—Л –Њ—Б—В–∞–µ—В—Б—П –љ–µ–њ–Њ–≤—А–µ–ґ–і–µ–љ–љ—Л–Љ. –І—В–Њ–±—Л —Г–і–Њ—Б—В–Њ–≤–µ—А–Є—В—М—Б—П, –њ—А–∞–≤–Є–ї—М–љ–Њ –ї–Є –≤–≤–µ–і–µ–љ–∞ –Є–≥–ї–∞, –≤–≤–Њ–і—П—В —Б–љ–∞—З–∞–ї–∞ –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞. –Я—А–Є –љ–∞—Е–Њ–ґ–і–µ–љ–Є–Є –Є–≥–ї—Л –≤ –њ–Њ–ї–Њ—Б—В–Є –≤–µ–љ—Л –Љ–∞—В–µ—А–Є–∞–ї –≤–≤–Њ–і–Є—В—Б—П —Б–≤–Њ–±–Њ–і–љ–Њ, –≤ –њ—А–Њ—В–Є–≤–љ–Њ–Љ –ґ–µ —Б–ї—Г—З–∞–µ –ґ–Є–і–Ї–Њ—Б—В—М –Є–Ј —И–њ—А–Є—Ж–∞ –≤—Л—В–µ–Ї–∞–µ—В —Б —В—А—Г–і–Њ–Љ, –∞ –љ–∞ —Г—Е–µ –≤ –Љ–µ—Б—В–µ –≤–≤–µ–і–µ–љ–Є—П –Њ–±—А–∞–Ј—Г–µ—В—Б—П –≤–Ј–і—Г—В–Є–µ. –Х—Б–ї–Є –Є–≥–ї–∞ –љ–µ –њ–Њ–њ–∞–ї–∞ –≤ –≤–µ–љ—Г, –µ–µ –≤—Л–љ–Є–Љ–∞—О—В –Є –≤–≤–Њ–і—П—В –њ–Њ–≤—В–Њ—А–љ–Њ –≤ –і—А—Г–≥–Њ–µ –Љ–µ—Б—В–Њ, –±–ї–Є–ґ–µ –Ї –Њ—Б–љ–Њ–≤–∞–љ–Є—О —Г—Е–∞. –Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –≤–≤–µ–і–µ–љ–Є—П –љ–Є–ґ–љ–Є–є —Г—З–∞—Б—В–Њ–Ї –≤–µ–љ—Л —Б–ї–µ–≥–Ї–∞ –њ—А–Є–і–∞–≤–ї–Є–≤–∞—О—В, –∞ –Ї –Љ–µ—Б—В—Г —Г–Ї–Њ–ї–∞ –њ—А–Є–Ї–ї–∞–і—Л–≤–∞—О—В –Ї—Г—Б–Њ—З–µ–Ї —Б—В–µ—А–Є–ї—М–љ–Њ–є –≤–∞—В—Л, —Б–Љ–Њ—З–µ–љ–љ–Њ–є —Б–њ–Є—А—В–Њ–Љ –Є–ї–Є —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –є–Њ–і–∞, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –Є–Ј –≤–µ–љ—Л –Є–Ј–≤–ї–µ–Ї–∞—О—В –Є–≥–ї—Г. –Т–љ—Г—В—А–Є–≤–µ–љ–љ–Њ –Ї—А–Њ–ї–Є–Ї–∞–Љ –Љ–Њ–ґ–љ–Њ –≤–≤–Њ–і–Є—В—М –і–Њ 20 –Љ–ї –ґ–Є–і–Ї–Њ—Б—В–Є.
–Т–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–µ –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Ї—А—Л—Б –Є –Љ—Л—И–µ–є
–Ъ—А—Л—Б –Є –Љ—Л—И–µ–є –Ј–∞—А–∞–ґ–∞—О—В –≤ –±–Њ–Ї–Њ–≤—Г—О –≤–µ–љ—Г —Е–≤–Њ—Б—В–∞. –Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –≤–≤–µ–і–µ–љ–Є–µ–Љ –Љ–∞—В–µ—А–Є–∞–ї–∞ —Е–≤–Њ—Б—В –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, —З—В–Њ–±—Л –≤—Л–Ј–≤–∞—В—М –≥–Є–њ–µ—А–µ–Љ–Є—О —Б–Њ—Б—Г–і–Њ–≤, –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ —Б–Њ—Б—Г–і —Б –≤–Њ–і–Њ–є, –њ–Њ–і–Њ–≥—А–µ—В–Њ–є –і–Њ 50¬∞–°, —Б–Љ–∞–Ј—Л–≤–∞—О—В –Ї—Б–Є–ї–Њ–ї–Њ–Љ –Є–ї–Є —В–Њ–ї—Г–Њ–ї–Њ–Љ. –Я–Њ—Б–ї–µ —В–Њ–≥–Њ –Ї–∞–Ї —Б–Њ—Б—Г–і—Л –Ј–∞–Љ–µ—В–љ–Њ –љ–∞–±—Г—Е–∞—О—В, –Ї–Њ—А–µ–љ—М —Е–≤–Њ—Б—В–∞ —Б–і–∞–≤–ї–Є–≤–∞—О—В –њ–∞–ї—М—Ж–∞–Љ–Є. –Ф–ї—П –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ –ї—Г—З—И–µ –≤—Б–µ–≥–Њ –њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П —В—Г–±–µ—А–Ї—Г–ї–Є–љ–Њ–≤—Л–Љ–Є –Є–≥–ї–∞–Љ–Є, –Њ—З–µ–љ—М —В–Њ–љ–Ї–Є–Љ–Є –Є –Ї–Њ—А–Њ—В–Ї–Є–Љ–Є, —Б –Ї–Њ—Б—Л–Љ —Б—А–µ–Ј–Њ–Љ. –Я—А–Є –≤–≤–µ–і–µ–љ–Є–Є –Є–≥–ї—Л –≤ –≤–µ–љ—Г —И–њ—А–Є—Ж –і–µ—А–ґ–∞—В –њ–Њ–і –Њ—Б—В—А—Л–Љ —Г–≥–ї–Њ–Љ, –њ–Њ—З—В–Є –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –Њ—Б–Є —Е–≤–Њ—Б—В–∞. –Ш–≥–ї—Г –њ–Њ–≤–µ—А—В—Л–≤–∞—О—В –Њ—В–≤–µ—А—Б—В–Є–µ–Љ –љ–∞—А—Г–ґ—Г. –Ъ–Њ—А–µ–љ—М —Е–≤–Њ—Б—В–∞ –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –Њ—В —Б–і–∞–≤–ї–Є–≤–∞–љ–Є—П. –Ъ–∞–Ї –Є –≤ –њ—А–µ–і—Л–і—Г—Й–µ–Љ —Б–ї—Г—З–∞–µ, –љ–∞—Е–Њ–ґ–і–µ–љ–Є–µ –Є–≥–ї—Л –≤ –≤–µ–љ–µ –Њ–њ—А–µ–і–µ–ї—П—О—В –њ–Њ –ї–µ–≥–Ї–Њ—Б—В–Є –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є –Њ—В—Б—Г—В—Б—В–≤–Є—О –Ј–∞–Љ–µ—В–љ–Њ–≥–Њ —Г–њ–ї–Њ—В–љ–µ–љ–Є—П –≤ –Љ–µ—Б—В–µ, –≥–і–µ –љ–∞—Е–Њ–і–Є—В—Б—П –Є–≥–ї–∞. –Т–Ј—А–Њ—Б–ї—Л–Љ –±–µ–ї—Л–Љ –Ї—А—Л—Б–∞–Љ –і–Њ–њ—Г—Б–Ї–∞–µ—В—Б—П –≤–≤–Њ–і–Є—В—М –і–Њ 6 –Љ–ї –ґ–Є–і–Ї–Њ—Б—В–Є, –Љ—Л¬≠—И–∞–ЉвАФ–і–Њ 0,5 –Љ–ї.
–Ч–∞—А–∞–ґ–µ–љ–Є–µ —З–µ—А–µ–Ј –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ—Л–є —В—А–∞–Ї—В
–Ч–∞—А–∞–Ј–Є—В—М –ґ–Є–≤–Њ—В–љ–Њ–µ —З–µ—А–µ–Ј —А–Њ—В –Љ–Њ–ґ–љ–Њ –і–≤—Г–Љ—П —Б–њ–Њ—Б–Њ–±–∞–Љ–Є. –Ь–∞—В–µ—А–Є–∞–ї, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–є –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П, –њ—А–Є–Љ–µ—И–Є–≤–∞—О—В –Ї –Ї–Њ—А–Љ—Г –Є–ї–Є –њ–Є—В—М—О –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Ґ–∞–Ї–Њ–є —Б–њ–Њ—Б–Њ–± —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –њ—А–Њ—Б—В—Л–Љ –Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ, –Њ–і–љ–∞–Ї–Њ, –≤ –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –µ–≥–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –њ–Њ–њ–∞–і–∞—О—Й–µ–µ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ –Ј–∞—А–∞–ґ–∞–µ–Љ–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, –љ–µ –њ–Њ–і–ї–µ–ґ–Є—В —В–Њ—З–љ–Њ–Љ—Г —Г—З–µ—В—Г. –Я–Њ—Н—В–Њ–Љ—Г –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –Љ–∞—В–µ—А–Є–∞–ї, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–є –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П, –≤–≤–Њ–і—П—В –ґ–Є–≤–Њ—В–љ–Њ–Љ—Г —И–њ—А–Є—Ж–µ–Љ, –Є–≥–ї–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є–Љ–µ–µ—В –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –Є–Ј–≥–Є–± –Є —Г—В–Њ–ї—Й–µ–љ–Є–µ –љ–∞ –Ї–Њ–љ—Ж–µ –≤ –≤–Є–і–µ –Њ–ї–Є–≤—Л. –Э–∞–ї–Є—З–Є–µ –Є–Ј–≥–Є–±–∞ –і–Њ–њ—Г—Б–Ї–∞–µ—В –≤–≤–µ–і–µ–љ–Є–µ –Є–≥–ї—Л –≤ –њ–Є—Й–µ–≤–Њ–і –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Ф–Є–∞–Љ–µ—В—А –Є–≥–ї—Л –і–ї—П –Љ—Л—И–µ–є –і–Њ–ї–ґ–µ–љ –±—Л—В—М –љ–µ –±–Њ–ї–µ–µ 1 –Љ–Љ, –і–ї—П –Ї—А—Л—Б-1,5 –Љ–Љ, –і–ї–Є–љ–∞, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, 35-45 –Є 70-75 –Љ–Љ.
–Ъ—А—Л—Б –Є –Љ—Л—И–µ–є —Д–Є–Ї—Б–Є—А—Г—О—В –њ–µ—А–µ–і –Ј–∞—А–∞–ґ–µ–љ–Є–µ–Љ –≤ –≤–µ—А—В–Є–Ї–∞–ї—М¬≠–љ–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є: –Њ–і–љ–Њ–є —А—Г–Ї–Њ–є –њ–Њ–Љ–Њ—Й–љ–Є–Ї –і–µ—А–ґ–Є—В –ґ–Є–≤–Њ—В–љ–Њ–µ –Ј–∞ —Б–Ї–ї–∞–і–Ї—Г –Ї–Њ–ґ–Є –љ–∞ –Ј–∞—В—Л–ї–Ї–µ, –Њ–Ї–Њ–ї–Њ —Г—И–µ–є, –і—А—Г–≥–Њ–є-–Ј–∞ –Ї–Њ—А–µ–љ—М —Е–≤–Њ—Б—В–∞. –Ц–Є–≤–Њ—В–љ—Л–Љ –Њ—В–Ї—А—Л–≤–∞—О—В —А–Њ—В –±—А–∞–љ—И–∞–Љ–Є –њ–Є–љ—Ж–µ—В–∞, –≤—Б—В–∞–≤¬≠–ї—П—П –Є—Е –Љ–µ–ґ–і—Г –љ–Є–ґ–љ–µ–є –Є –≤–µ—А—Е–љ–µ–є —З–µ–ї—О—Б—В—П–Љ–Є. –Ш–≥–ї—Г, –≤–≤–µ–і–µ–љ–љ—Г—О –≤ —А–Њ—В, –њ—А–Њ–і–≤–Є–≥–∞—О—В –њ–Њ –Ј–∞–і–љ–µ–є —Б—В–µ–љ–Ї–µ –≥–ї–Њ—В–Ї–Є –љ–∞ –≥–ї—Г–±–Є–љ—Г 1 —Б–Љ —Г –Љ—Л—И–µ–є –Є 2-2,5 —Б–Љ —Г –Ї—А—Л—Б.
–Э–∞ —Г–Ї–∞–Ј–∞–љ–љ–Њ–є –≥–ї—Г–±–Є–љ–µ –Є–≥–ї–µ –њ—А–Є–і–∞—О—В –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ. –Я—А–Њ—Ж–µ—Б—Б –≤–≤–µ–і–µ–љ–Є—П –Є–≥–ї—Л, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Ј–∞—В—А—Г–і–љ–µ–љ–Є–є –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В, –Ї–Њ–љ–µ—Ж –µ–µ –њ—А–Њ–љ–Є–Ї–∞–µ—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ –ґ–µ–ї—Г–і–Њ–Ї –Є–ї–Є –љ–Є–ґ–љ–Є–є –Њ—В–і–µ–ї –њ–Є—Й–µ–≤–Њ–і–∞. –Ъ–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –≤–≤–Њ–і–Є–Љ–Њ–≥–Њ –Ј–∞ –Њ–і–Є–љ —А–∞–Ј –≤ –ґ–µ–ї—Г–і–Њ–Ї –Љ—Л—И–µ–є, –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–µ –±–Њ–ї–µ–µ 1 –Љ–ї, –≤–Ј—А–Њ—Б–ї—Л–Љ –Ї—А—Л—Б–∞–Љ-–љ–µ –±–Њ–ї–µ–µ 3,5 –Љ–ї (—А–Є—Б. 12).
–Я—А–Є –њ–µ—А–Њ—А–∞–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –ґ–Є–і–Ї–Њ—Б—В–µ–є –Љ–µ–ї–Ї–Є–Љ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ —Г–і–Њ–±–љ–µ–µ –њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –њ–Њ–ї–Є—Е–ї–Њ—А–≤–Є–љ–Є–ї–Њ–≤–Њ–є —В—А—Г–±–Ї–Њ–є, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–µ–є —Б–Њ–±–Њ–є –љ–∞—А—Г–ґ–љ—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г –Њ–і–љ–Њ–≥–Њ –њ—А–Њ–≤–Њ–і–∞ –Љ–љ–Њ–≥–Њ–ґ–Є–ї—М–љ–Њ–≥–Њ —В–µ–ї–µ—Д–Њ–љ–љ–Њ–≥–Њ –Ї–∞–±–µ–ї—П, –Є–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ —Г–і–∞–ї–µ–љ –њ—А–Њ–≤–Њ–і–љ–Є–Ї.
–Ф–ї–Є–љ–∞ —В—А—Г–±–Ї–Є 15-17 —Б–Љ, –љ–∞—А—Г–ґ–љ—Л–є –і–Є–∞–Љ–µ—В—А 1-1,5 –Љ–Љ, —В–∞–Ї–Њ–є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–є –Ј–Њ–љ–і –њ—А–Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ —Г—Б–Є–ї–Є–Є –ї–µ–≥–Ї–Њ –њ—А–Њ–љ–Є–Ї–∞–µ—В –Є–Ј –њ–Њ–ї–Њ—Б—В–Є —А—В–∞ –≤ –њ–Є—Й–µ–≤–Њ–і –Є –ґ–µ–ї—Г–і–Њ–Ї –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, –љ–µ —В—А–µ–±—Г—П —Б—В—А–Њ–≥–Њ–≥–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –≥–ї—Г–±–Є–љ—Л –≤–≤–µ–і–µ–љ–Є—П, —В–∞–Ї –Ї–∞–Ї –і–∞–ґ–µ –њ—А–Є –Є–Ј–ї–Є—И–љ–µ –≥–ї—Г–±–Њ–Ї–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є —Б—В–µ–љ–Ї–Є –ґ–µ–ї—Г–і–Ї–∞ –љ–µ –њ–Њ–≤—А–µ–ґ–і–∞—О—В—Б—П.
–Т–≤–Њ–і–Є–Љ–∞—П –ґ–Є–і–Ї–Њ—Б—В—М –і–Њ–Ј–Є—А—Г–µ—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О —И–њ—А–Є—Ж–∞, –љ–∞ —Б–Њ¬≠—Б–Њ–Ї –Ї–Њ—В–Њ—А–Њ–≥–Њ –љ–∞–і–µ–≤–∞—О—В —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–є –Ј–Њ–љ–і, –≤–љ—Г—В—А–µ–љ–љ–Є–є –њ—А–Њ—Б–≤–µ—В –Ї–Њ—В–Њ—А–Њ–≥–Њ 0,5вАФ0,7 –Љ–Љ.
–Ь–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –Є –Ї—А–Њ–ї–Є–Ї–Њ–≤ –њ–µ—А–µ–і –Ј–∞—А–∞–ґ–µ–љ–Є–µ–Љ per os —Д–Є–Ї—Б–Є—А—Г—О—В –≤ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ –і–ї—П –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є. –£–і–Њ–±–љ–µ–µ –≤—Б–µ–≥–Њ –Ј–∞–≤–µ—А–љ—Г—В—М –Є—Е –≤ –њ–Њ–ї–Њ—В–µ–љ—Ж–µ –Є –њ–Њ—Б–∞–і–Є—В—М –Ї –њ–Њ–Љ–Њ—Й–љ–Є–Ї—Г –љ–∞ –Ї–Њ–ї–µ–љ–Є.
–Ч–∞—А–∞–Ј–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –≤–≤–Њ–і—П—В —З–µ—А–µ–Ј —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–є –Ј–Њ–љ–і. –Ф–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –Њ–±—Л—З–љ–Њ –≤—Л–±–Є—А–∞—О—В –Ї–∞—В–µ—В–µ—А –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Љ—П–≥–Ї–Њ–є –Є —Н–ї–∞—Б—В–Є—З–љ–Њ–є —А–µ–Ј–Є–љ—Л –і–ї–Є–љ–Њ–є 7,5вАФ8 —Б–Љ –Є —В–Њ–ї—Й–Є–љ–Њ–є –љ–µ –±–Њ–ї–µ–µ 0,3вАФ0,5 —Б–Љ.
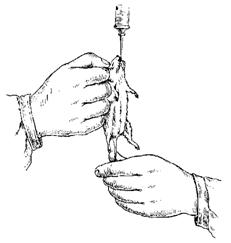
–†–Є—Б. 12. –Ч–∞—А–∞–ґ–µ–љ–Є–µ —З–µ—А–µ–Ј –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ—Л–є —В—А–∞–Ї—В
–Я–µ—А–µ–і –≤–≤–µ–і–µ–љ–Є–µ–Љ –Ј–Њ–љ–і–∞ –≤ —А–Њ—В –ґ–Є–≤–Њ—В–љ–Њ–Љ—Г –≤—Б—В–∞–≤–ї—П—О—В —А–Њ—В–Њ—А–∞—Б—И–Є—А–Є—В–µ–ї—М –Є–ї–Є, –Ї–∞–Ї –µ–≥–Њ –љ–∞–Ј—Л–≤–∞—О—В, ¬Ђ–Ј–µ–≤–љ–Є–Ї¬ї, –Ї–Њ—В–Њ—А—Л–є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –і–Њ—Й–µ—З–Ї—Г —Б –Ї—А—Г–≥–ї—Л–Љ –Њ—В–≤–µ—А—Б—В–Є–µ–Љ –≤ —Б–µ—А–µ–і–Є–љ–µ. –®–Є—А–Є–љ–∞ –і–Њ—Й–µ—З–Ї–Є –і–ї—П –Ї—А–Њ–ї–Є–Ї–∞ —А–∞–≤–љ–∞ 2 —Б–Љ, –і–ї—П –Љ–Њ—А¬≠—Б–Ї–Њ–є —Б–≤–Є–љ–Ї–Є -1 —Б–Љ. –І–µ—А–µ–Ј –Њ—В–≤–µ—А—Б—В–Є–µ –≤—Б—В–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –≤ —А–Њ—В ¬Ђ–Ј–µ–≤–љ–Є–Ї–∞¬ї –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –≤–≤–Њ–і—П—В –≤ –њ–Є—Й–µ–≤–Њ–і –Ј–Њ–љ–і, —Б–Љ–∞–Ј–∞–љ–љ—Л–є –≤–∞–Ј–µ–ї–Є–љ–Њ–Љ –Є–ї–Є –≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ. –Ф–ї—П —В–Њ–≥–Њ —З—В–Њ–±—Л –Њ–±–ї–µ–≥—З–Є—В—М –≤–≤–µ–і–µ–љ–Є–µ –Ј–Њ–љ–і–∞, –ґ–Є–≤–Њ—В–љ–Њ–Љ—Г –≤–ї–Є–≤–∞—О—В –њ–Є–њ–µ—В–Ї–Њ–є –≤ —А–Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–∞–њ–µ–ї—М –≤–Њ–і—Л, –≤—Л–Ј—Л–≤–∞—П –≥–ї–Њ—В–∞—В–µ–ї—М–љ—Л–µ –і–≤–Є–ґ–µ–љ–Є—П, –≤–Њ –≤—А–µ–Љ—П –Ї–Њ—В–Њ—А—Л—Е –Ј–Њ–љ–і –ї–µ–≥–Ї–Њ, –±–µ–Ј –≤–љ–µ—И–љ–µ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ—А–Њ–і–≤–Є–≥–∞–µ—В—Б—П –≤ –≥–ї—Г–±—М –њ–Є—Й–µ–≤–Њ–і–∞. –Э–∞—А—Г–ґ–љ—Л–є –Ї–Њ–љ–µ—Ж –≤–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Ј–Њ–љ–і–∞ –њ—А–Є—Б–Њ–µ–і–Є–љ—П—О—В –Ї —И–њ—А–Є—Ж—Г, –љ–∞–њ–Њ–ї–љ–µ–љ–љ–Њ–Љ—Г –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –≤–≤–Њ–і—П—В –≤ –ґ–µ¬≠–ї—Г–і–Њ–Ї –Љ–µ–і–ї–µ–љ–љ–Њ –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 2,5вАФ3,5 –Љ–ї –Љ–Њ—А—Б–Ї–Є–Љ —Б–≤–Є–љ–Ї–∞–Љ –Є 3,5вАФ5 –Љ–ї –Ї—А–Њ–ї–Є–Ї–∞–Љ.
–Ч–∞—А–∞–ґ–µ–љ–Є–µ —З–µ—А–µ–Ј –і—Л—Е–∞—В–µ–ї—М–љ—Л–µ –њ—Г—В–Є (–Є–љ—В—А–∞–љ–∞–Ј–∞–ї—М–љ–Њ–µ –Ј–∞—А–∞–ґ–µ–љ–Є–µ)
–Ц–Є–≤–Њ—В–љ–Њ–Љ—Г, —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –љ–∞ –і–Њ—Б–Ї–µ, –њ—А–Є–Ї–ї–∞–і—Л–≤–∞—О—В –Ї –љ–Њ—Б—Г –Ї—Г—Б–Њ—З–µ–Ї –≤–∞—В—Л, —Б–Љ–Њ—З–µ–љ–љ–Њ–є —Н—Д–Є—А–Њ–Љ –Є–ї–Є —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ. –Ъ –Ј–∞—А–∞–ґ–µ–љ–Є—О –њ—А–Є—Б—В—Г–њ–∞—О—В –њ–Њ—Б–ї–µ —В–Њ–≥–Њ, –Ї–∞–Ї —Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ–Њ—П–≤–Є—В—Б—П —Б–Њ—Б—В–Њ—П–љ–Є–µ –ї–µ–≥–Ї–Њ–≥–Њ –љ–∞—А–Ї–Њ–Ј–∞. –Ч–∞—А–∞–ґ–µ–љ–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї —Б –њ–Њ–Љ–Њ—Й—М—О —И–њ—А–Є—Ж–∞ –≤–≤–Њ–і—П—В –≤ –љ–Њ—Б –љ–µ–±–Њ–ї—М—И–Є–Љ–Є –Ї–∞–њ–ї—П–Љ–Є –љ–∞ –≥–ї—Г–±–Є–љ—Г 1вАФ1,5 –Љ–Љ –Љ—Л—И–∞–Љ, 2вАФ3 –Љ–Љ –Ї—А—Л—Б–∞–Љ, 4 –Љ–Љ –Ї—А–Њ–ї–Є–Ї–∞–Љ –Є –Љ–Њ—А—Б–Ї–Є–Љ —Б–≤–Є–љ–Ї–∞–Љ. –І—В–Њ–±—Л –љ–µ –њ–Њ—А–∞–љ–Є—В—М —Б–ї–Є–Ј–Є—Б—В—Л–µ –Њ–±–Њ–ї–Њ—З–Ї–Є, –і–ї—П –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ –±–µ—А—Г—В –∞–±—Б–Њ–ї—О—В–љ–Њ —В—Г–њ—Г—О –Є–≥–ї—Г.
–Ч–∞—А–∞–ґ–µ–љ–Є–µ –≤ –њ–µ—А–µ–і–љ—О—О –Ї–∞–Љ–µ—А—Г –≥–ї–∞–Ј–∞ (–Є–љ—В—А–∞–Њ–Ї—Г–ї—П—А–љ—Л–є –Љ–µ—В–Њ–і)
–Я—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –Њ–±—Л—З–љ–Њ —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤ –њ–Њ–і –Љ–µ—Б—В–љ–Њ–є –∞–љ–µ—Б—В–µ–Ј–Є–µ–є –≥–ї–∞–Ј–∞. –Ч–∞—В–µ–Љ —Д–Є–Ї—Б–Є—А—Г—О—В –≥–ї–∞–Ј–љ–Њ–µ —П–±–ї–Њ–Ї–Њ –њ—Г—В–µ–Љ –Ј–∞—Е–≤–∞—В—Л–≤–∞–љ–Є—П —Б–Ї–ї–∞–і–Ї–Є –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤—Л (–Ї–љ–∞—А—Г–ґ–Є –Њ—В –≤–µ—А—Е–љ–µ–≥–Њ –Ї—А–∞—П —А–Њ–≥–Њ–≤–Є—Ж—Л) –≥–ї–∞–Ј–љ—Л–Љ –њ–Є–љ—Ж–µ—В–Њ–Љ. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —В–Њ–љ–Ї–Њ–є –Є–≥–ї–Њ–є, —Б–Љ–Њ—З–µ–љ–љ–Њ–є –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –Љ–∞—В–µ—А–Є–∞–ї–Њ–Љ, –њ—А–Њ—В—Л–Ї–∞—О—В —А–Њ–≥–Њ–≤–Є—Ж—Г —Г –ї–Є–Љ–±–∞ –≤ –Њ—З–µ–љ—М –Ї–Њ—Б–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –Є –њ—А–Њ–љ–Є–Ї–∞—О—В –≤ –њ–µ—А–µ–і–љ—О—О –Ї–∞–Љ–µ—А—Г –≥–ї–∞–Ј–∞ –љ–∞ –≥–ї—Г–±–Є–љ—Г –љ–µ –Љ–µ–љ–µ–µ 1 –Љ–Љ. –Ш–≥–ї—Г —В–Њ—В—З–∞—Б –ґ–µ –≤—Л–љ–Є–Љ–∞—О—В, –∞ —А–∞–љ–Ї–∞ –Ј–∞–Ї—А—Л–≤–∞–µ—В—Б—П —Б–∞–Љ–∞ –њ–Њ —Б–µ–±–µ. –Я—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–Љ –≤–≤–µ–і–µ–љ–Є–Є –Є–≥–ї—Л –≤—Л—В–µ–Ї–∞–љ–Є—П –≤–ї–∞–≥–Є –Є–Ј –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л –±—Л—В—М –љ–µ –і–Њ–ї–ґ–љ–Њ. –Ь–Њ–ґ–љ–Њ —В–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ –њ—А–Њ–Ї–Њ–ї–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л –њ—А–Њ–і–≤–Є–љ—Г—В—М –Є–≥–ї—Г –≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –Є–Ј –њ—А–Њ—Б–≤–µ—В–∞ –Є–≥–ї—Л –љ–µ –њ–Њ–Ї–∞–ґ–µ—В—Б—П –ґ–Є–і–Ї–Њ—Б—В—М. –Т—Л–њ—Г—Б—В–Є–≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–∞–њ–µ–ї—М –≤–ї–∞–≥–Є –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А—Л –≥–ї–∞–Ј–∞, –Є–≥–ї—Г —Б–Њ–µ–і–Є–љ—П—О—В —Б–Њ —И–њ—А–Є—Ж–µ–Љ –Є –≤–≤–Њ–і—П—В –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї (–љ–µ –±–Њ–ї–µ–µ 0,05 –Љ–ї).
–Т–љ—Г—В—А–Є–Љ–Њ–Ј–≥–Њ–≤–Њ–є –Љ–µ—В–Њ–і (–Є–љ—В—А–∞—Ж–µ—А–µ–±—А–∞–ї—М–љ—Л–є)
–Я—А–Є–Љ–µ–љ—П–µ—В—Б—П —З–∞—Й–µ —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤, –Ї—А—Л—Б –Є –Љ—Л—И–µ–є. –Ґ–µ—Е–љ–Є–Ї–∞ –≤–≤–µ–і–µ–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ –Ї—А–Њ–ї–Є–Ї–∞–Љ —В–∞ –ґ–µ, —З—В–Њ –Є –њ—А–Є —В—А–∞–ї—М–љ–Њ–Љ –Љ–µ—В–Њ–і–µ, —В–Њ–ї—М–Ї–Њ –Є–љ—К–µ–Ї—Ж–Є—П –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—Б—П –њ—А—П–Љ–Њ–є –Є–≥–ї–Њ–є —З–µ—А–µ–Ј —В–≤–µ—А–і—Г—О –Љ–Њ–Ј–≥–Њ–≤—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤ —В–Њ–ї—Й—Г –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞.
–Ф–Њ–Ј–∞ –≤–≤–Њ–і–Є–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞-0,2-0,3 –Љ–ї. –Я—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–≤ –і–ї—П —В—А–µ–њ–∞–љ–∞—Ж–Є–Є –Љ–Њ–ґ–љ–Њ –њ—А–Њ–Є–Ј–≤–µ—Б—В–Є –Ј–∞—А–∞–ґ–µ–љ–Є–µ –≤ –Љ–Њ–Ј–≥ –њ—Г—В–µ–Љ –њ—А–Њ–Ї–Њ–ї–∞ —З–µ—А–µ–њ–∞ —З–µ—А–µ–Ј –Ї–Њ–ґ—Г, –Є–≥–ї–Њ–є —И–њ—А–Є—Ж–∞, –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б–±–Њ–Ї—Г –Њ—В —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ј–∞—В—Л–ї–Њ—З–љ–Њ–≥–Њ –±—Г–≥—А–∞. –Я—А–Є–Љ–µ–љ—П—О—В —В–∞–Ї–ґ–µ –њ–Њ—Б–ї–µ —А–∞–Ј—А–µ–Ј–∞ –Ї–Њ–ґ–Є –њ—А–Њ–Ї–Њ–ї —З–µ—А–µ–њ–∞ –Њ—Б—В—А–Њ–є –Ї–∞–љ—Ж–µ–ї—П—А—Б–Ї–Њ–є –Ї–љ–Њ–њ–Ї–Њ–є —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –≤ –Њ—В–≤–µ—А—Б—В–Є–µ –Є–≥–ї—Л —И–њ—А–Є—Ж–∞.
–Ъ—А–Њ–ї–Є–Ї–Њ–≤ –Љ–Њ–ґ–љ–Њ —В–∞–Ї–ґ–µ –Ј–∞—А–∞–ґ–∞—В—М –≤ –Љ–Њ–Ј–≥ —З–µ—А–µ–Ј sulcus supraorbitalis (–±–µ–Ј —В—А–µ–њ–∞–љ–∞—Ж–Є–Є).
–Ґ–µ—Е–љ–Є–Ї–∞ —Б–ї–µ–і—Г—О—Й–∞—П: –Њ–њ–µ—А–∞—В–Њ—А –њ—А–Є–≥–Є–±–∞–µ—В –Ї —Б—В–Њ–ї—Г –ї–µ–≤–Њ–є —А—Г–Ї–Њ–є –≥–Њ–ї–Њ–≤—Г —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–Љ–Њ—Й–љ–Є–Ї–Њ–Љ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, –∞ –њ—А–∞–≤–Њ–є –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В —Г–Ї–Њ–ї –Ї–Њ—А–Њ—В–Ї–Њ–є (4-5 –Љ–ї –і–ї–Є–љ—Л) –Є–≥–ї–Њ–є –≤ –Ј–∞—А–∞–љ–µ–µ –њ—А–Њ—Й—Г–њ–∞–љ–љ—Г—О –±–Њ—А–Њ–Ј–і—Г. –Э–∞–њ—А–∞–≤–ї–µ–љ–Є–µ –њ—А–Є –њ—А–Њ–Ї–Њ–ї–µ –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–∞–Ї–ї–Њ–љ–љ–Њ–µ –Ї —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є, –∞ –љ–µ¬≠–≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–µ (–Њ–њ–∞—Б–љ–Њ—Б—В—М –њ–Њ–њ–∞–і–∞–љ–Є—П –≤ –≥–ї–∞–Ј–љ–Є—Ж—Г). –Ь–µ—Б—В–Њ —Г–Ї–Њ–ї–∞ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –≤—Л—Б—В—А–Є–≥–∞—О—В –Є –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –є–Њ–і–љ–Њ–є –љ–∞—Б—В–Њ–є–Ї–Њ–є. –Я—А–Є –њ—А–Њ–Ї–Њ–ї–µ –Ї–Њ–ґ–∞ —Б–Љ–µ—Й–∞–µ—В—Б—П –Њ—В —Б–µ—А–µ–і–Є–љ—Л –Ї sulcus supraorbitalis; –њ–Њ—Б–ї–µ –њ—А–Њ–Ї–Њ–ї–∞ —З–µ—А–µ–њ–љ–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ –Ј–∞–Ї—А—Л–≤–∞—О—В –Ї–Њ–ґ–µ–є. –°–њ–Њ—Б–Њ–± –Њ—З–µ–љ—М —Г–і–Њ–±–љ—Л–є –Є –±—Л—Б—В—А—Л–є, –ґ–Є–≤–Њ—В–љ—Л–µ –њ–µ—А–µ–љ–Њ—Б—П—В –Њ–њ–µ—А–∞—Ж–Є—О –±–µ–Ј –љ–∞—А–Ї–Њ–Ј–∞.
–£ –±–µ–ї—Л—Е –Љ—Л—И–µ–є –Є –Ї—А—Л—Б —В–µ—Е–љ–Є–Ї–∞ –≤–љ—Г—В—А–Є–Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П —Б–ї–µ–і—Г—О—Й–Є–µ: –ґ–Є–≤–Њ—В–љ–Њ–µ —Д–Є–Ї—Б–Є—А—Г—О—В –≤ –ї–µ–≤–Њ–є —А—Г–Ї–µ, –Ї–Њ–ґ—Г –≥–Њ–ї–Њ–≤—Л –Њ—В—В—П–≥–Є–≤–∞—О—В –±–Њ–ї—М—И–Є–Љ –Є —Г–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л–Љ –њ–∞–ї—М—Ж–∞–Љ–Є –Ї –Ј–∞—В—Л–ї–Ї—Г, –∞ –Љ–Є–Ј–Є–љ—Ж–µ–Љ –Є –±–µ–Ј—Л–Љ—П–љ–љ—Л–Љ —Г–і–µ—А–ґ–Є–≤–∞—О—В —Е–≤–Њ—Б—В. –Я—А–Њ–Ї–Њ–ї –њ—А–Њ–Є–Ј–≤–Њ–і—П—В —З–µ—А–µ–Ј –Ї–Њ–ґ—Г –≤ –Њ–±–ї–∞—Б—В—М —В–µ–Љ–µ–љ–Є, –ї–∞—В–µ—А–∞–ї—М–љ–µ —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є; –Љ–µ—Б—В–Њ —Г–Ї–Њ–ї–∞ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –љ–∞—Б—В–Њ–є–Ї–Њ–є –є–Њ–і–∞. –Ь–∞—В–µ—А–Є–∞–ї –≤–≤–Њ–і—П—В –Љ–µ–і–ї–µ–љ–љ–Њ, –≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ —А–µ–Ј–Ї–Њ–≥–Њ –њ–Њ–≤—Л—И–µ–љ–Є—П –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П.
–Т–љ—Г—В—А–Є–њ–ї–µ–≤—А–∞–ї—М–љ—Л–є –Љ–µ—В–Њ–і
–£–Ї–Њ–ї –њ—А–Њ–Є–Ј–≤–Њ–і—П—В —Б –њ—А–∞–≤–Њ–є —Б—В–Њ—А–Њ–љ—Л –≤ –Љ–µ–ґ—А–µ–±–µ—А–љ–Њ–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–Њ –Ї–Њ—А–Њ—В–Ї–Њ–є, —В—Г–њ–Њ–є –Є–≥–ї–Њ–є.
–°–Њ–і–µ—А–ґ–∞–љ–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е –њ–Њ–і –Њ–њ—Л—В–Њ–Љ
–Я–Њ—Б–ї–µ –Ј–∞—А–∞–ґ–µ–љ–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ –љ–Њ—Б—П—В –љ–∞–Ј–≤–∞–љ–Є–µ ¬Ђ–њ–Њ–і–Њ–њ—Л—В–љ—Л—Е¬ї –ґ–Є–≤–Њ—В–љ—Л—Е. –Ш—Е —Б–Њ–і–µ—А–ґ–∞—В –≤ –Њ—Б–Њ–±–Њ–Љ, –Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Њ—В –њ–Є—В–Њ–Љ–љ–Є–Ї–∞ –њ–Њ–Љ–µ—Й–µ–љ–Є–Є –њ—А–Є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є. –Ґ–µ—Е–љ–Є—З–µ—Б–Ї–Є–є –њ–µ—А—Б–Њ–љ–∞–ї –≤–Є–≤–∞—А–Є—П –Њ–±—П–Ј–∞–љ –Њ–±–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–ї–Є –њ–∞–і–µ–ґ–∞ –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ —Б–Њ–Њ–±—Й–∞—В—М —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В—Г, –њ—А–Њ–≤–Њ–і–Є–≤—И–µ–Љ—Г –њ—А–Є–≤–Є–≤–Ї–Є –і–∞–љ–љ—Л–Љ –ґ–Є–≤–Њ—В–љ—Л–Љ. –Т—А–∞—З –Є –ї–∞–±–Њ—А–∞–љ—В –µ–ґ–µ–і–љ–µ–≤–љ–Њ –љ–∞–±–ї—О–і–∞—О—В –Ј–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –њ—А–Є–≤–Є—В—Л—Е –Є–Љ–Є –ґ–Є–≤–Њ—В–љ—Л—Е, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≤–Њ–і—П—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Т–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є —Г –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Є –µ–µ –Њ–±—А–∞–±–Њ—В–Ї–∞
–Э–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї—А–Њ–≤–Є –њ–Њ–ї—Г—З–∞—О—В —Г –Ї—А–Њ–ї–Є–Ї–Њ–≤ –Є –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –Є–Ј –≤–µ–љ —Г—Е–∞, —Г –Љ—Л—И–µ–є –Є –Ї—А—Л—БвАФ–Є–Ј –≤–µ–љ —Е–≤–Њ—Б—В–∞, –∞ –±–Њ–ї—М—И–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ вАФ –Є–Ј —Б–µ—А–і—Ж–∞. –Т –Њ—Б–Њ–±—Л—Е —Б–ї—Г—З–∞—П—Е –њ—А–Є–±–µ–≥–∞—О—В –Ї –њ–Њ–ї–љ–Њ–Љ—Г, –Є–ї–Є —В–Њ—В–∞–ї—М–љ–Њ–Љ—Г, –Њ–±–µ—Б–Ї—А–Њ–≤–ї–Є–≤–∞–љ–Є—О, –њ–Њ—Б–ї–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–µ –њ–Њ–≥–Є–±–∞–µ—В.
–Ф–ї—П –њ—Г–љ–Ї—Ж–Є–Є —Б–µ—А–і—Ж–∞ –ґ–Є–≤–Њ—В–љ—Л—Е —Д–Є–Ї—Б–Є—А—Г—О—В –Ї –і–Њ—Б–Ї–µ –±—А—О—И–Ї–Њ–Љ –Ї–≤–µ—А—Е—Г. –®–µ—А—Б—В—М –≤ –Њ–±–ї–∞—Б—В–Є –≥—А—Г–і–Є —В—Й–∞—В–µ–ї—М–љ–Њ –≤—Л—Б—В—А–Є–≥–∞—О—В, –Ї–Њ–ґ—Г –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –є–Њ–і–∞ –Є –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ—А–Є—Б—В—Г–њ–∞—О—В –Ї –њ—А–Њ–Ї–Њ–ї—Г, –Ї–Њ—В–Њ—А—Л–є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Є–і–∞ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –Є–Љ–µ–µ—В –љ–µ–Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј–ї–Є—З–Є—П.
–Я—Г–љ–Ї—Ж–Є—П —Б–µ—А–і—Ж–∞ –Ї—А–Њ–ї–Є–Ї–Њ–≤. –Ю–њ—А–µ–і–µ–ї—П—О—В II –њ–∞–ї—М—Ж–µ–Љ, –Њ–±—А–∞–±–Њ—В–∞–љ–љ—Л–Љ —Б–њ–Є—А—В–Њ–Љ –Є —Б–Љ–∞–Ј–∞–љ–љ—Л–Љ —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –є–Њ–і–∞, —Б–µ—А–і–µ—З–љ—Л–є —В–Њ–ї—З–Њ–Ї, —В. –µ. —В–Њ—З–Ї—Г –љ–∞–Є–±–Њ–ї–µ–µ —Б–Є–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ—Г–ї—М—Б–∞—Ж–Є–Є —Б–µ—А–і—Ж–∞. –Ю–±—Л—З–љ–Њ –Њ–љ–∞ –њ—А–Њ—Й—Г–њ—Л–≤–∞–µ—В—Б—П –≤ —В—А–µ—В—М–µ–Љ –Љ–µ–ґ—А–µ–±–µ—А—М–µ. –Я—А–Њ–Ї–Њ–ї –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є –і–µ–ї–∞—О—В –≤ –Њ–±–ї–∞—Б—В–Є —Б–µ—А¬≠–і–µ—З–љ–Њ–≥–Њ —В–Њ–ї—З–Ї–∞ –љ–∞ —А–∞—Б—Б—В–Њ—П–љ–Є–Є 2вАФ4 –Љ–Љ –Њ—В –ї–µ–≤–Њ–≥–Њ –Ї—А–∞—П –≥—А—Г–і–Є–љ—Л; –Є–≥–ї—Г –≤–µ–і—Г—В –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –Ї —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є –љ–∞ –≥–ї—Г–±–Є–љ—Г 2вАФ2,5 —Б–Љ. –Я—А–Є –њ–Њ–њ–∞–і–∞–љ–Є–Є –Є–≥–ї—Л –≤ –њ–Њ–ї–Њ—Б—В—М —Б–µ—А–і—Ж–∞ —А—Г–Ї–∞, –≤ –Ї–Њ—В–Њ—А–Њ–є –љ–∞—Е–Њ–і–Є—В—Б—П —И–њ—А–Є—Ж, –љ–∞—З–Є–љ–∞–µ—В –Њ—Й—Г—Й–∞—В—М —А–Є—В–Љ–Є—З–љ—Л–µ —В–Њ–ї—З–Ї–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –њ—Г–ї—М—Б–∞—Ж–Є–µ–є —Б–µ—А–і—Ж–∞ –Є –њ—А–Є–њ–Њ–і–љ–Є–Љ–∞—О—Й–Є–µ –Є–≥–ї—Г. –Я–Њ—А—И–µ–љ—М —И–њ—А–Є—Ж–∞ –ї–µ–≥–Ї–Њ –≤—Л–і–≤–Є–≥–∞–µ—В—Б—П –љ–∞—А—Г–ґ—Г –Є –≤ —Ж–Є–ї–Є–љ–і—А–µ –µ–≥–Њ —В–Њ—В—З–∞—Б –њ–Њ—П–≤–ї—П–µ—В—Б—П –Ї—А–Њ–≤—М. –Т–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є –і–Њ–ї–ґ–љ–Њ –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—М—Б—П –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –±—Л—Б—В—А–µ–µ –≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –µ–µ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П. –Я–Њ —Н—В–Њ–є –ґ–µ –њ—А–Є—З–Є–љ–µ —И–њ—А–Є—Ж –Є –Є–≥–ї—Г —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–Њ–Љ—Л–≤–∞—В—М –њ–µ—А–µ–і –Њ–њ—Л—В–Њ–Љ —Б—В–µ—А–Є–ї—М–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ —Ж–Є—В—А–∞—В–∞ –Є–ї–Є –Њ–Ї—Б–∞–ї–∞—В–∞ –љ–∞—В—А–Є—П. –Т–Ј—П–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї—А–Њ–≤–Є, –±—Л—Б—В—А—Л–Љ –і–≤–Є–ґ–µ–љ–Є–µ–Љ, –±–µ–Ј —А—Л–≤–Ї–∞, –≤—Л–љ–Є–Љ–∞—О—В –Є–≥–ї—Г –Є –љ–∞ –Љ–µ—Б—В–µ —Г–Ї–Њ–ї–∞ –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В –≤–∞—В–љ—Л–є —В–∞–Љ–њ–Њ–љ, –њ—А–Њ–њ–Є—В–∞–љ–љ—Л–є —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –є–Њ–і–∞. –Ц–Є–≤–Њ—В–љ–Њ–Љ—Г –њ–Њ–і–Ї–Њ–ґ–љ–Њ –≤–≤–Њ–і—П—В –њ–Њ–і–Њ–≥—А–µ—В—Л–є –і–Њ —В–µ–Љ¬≠–њ–µ—А–∞—В—Г—А—Л —В–µ–ї–∞ —Б—В–µ—А–Є–ї—М–љ—Л–є –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є–є —А–∞—Б—В–≤–Њ—А —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П –Є–ї–Є –≥–ї—О–Ї–Њ–Ј—Г –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ, —А–∞–≤–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ—Г –Њ–±—К–µ–Љ—Г –≤–Ј—П—В–Њ–є –Ї—А–Њ–≤–Є. –Я—Г–љ–Ї—Ж–Є–µ–є —Б–µ—А–і—Ж–∞ –Љ–Њ–ґ–љ–Њ –њ–Њ–ї—Г—З–Є—В—М —Г –Ї—А–Њ–ї–Є–Ї–∞ 25вАФ30 –Љ–ї –Ї—А–Њ–≤–Є.
–Я—Г–љ–Ї—Ж–Є—П —Б–µ—А–і—Ж–∞ —Г –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї. –Ъ–Њ–љ—З–Є–Ї–∞–Љ–Є IIIвАФIV –њ–∞–ї—М—Ж–µ–≤ –ї–µ–≤–Њ–є —А—Г–Ї–Є –љ–∞—Й—Г–њ—Л–≤–∞—О—В —Б–µ—А–і–µ—З–љ—Л–є —В–Њ–ї—З–Њ–Ї, –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ –љ–∞ –≥–ї—Г–±–Є–љ—Г 1,5вАФ2 —Б–Љ –≤–Ї–∞¬≠—В—Л–≤–∞—О—В –Є–≥–ї—Г, –Њ—В—Б—В—Г–њ—П –љ–∞ 1вАФ2 –Љ–Љ –Њ—В –ї–µ–≤–Њ–≥–Њ –Ї—А–∞—П –≥—А—Г–і–Є–љ—Л. –£ –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –Љ–Њ–ґ–љ–Њ –њ–Њ–ї—Г—З–Є—В—М —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ 10вАФ12 –Љ–ї –Ї—А–Њ–≤–Є.
–Я—Г–љ–Ї—Ж–Є—П —Б–µ—А–і—Ж–∞ —Г –Ї—А—Л—Б. –Ъ–∞–Ї –Є –≤ –њ—А–µ–і—Л–і—Г—Й–Є—Е —Б–ї—Г—З–∞—П—Е, –њ–∞–ї—М–њ–∞—В–Њ—А–љ–Њ –Њ–њ—А–µ–і–µ–ї—П—О—В –Љ–µ—Б—В–Њ —Б–µ—А–і–µ—З–љ–Њ–≥–Њ —В–Њ–ї—З–Ї–∞. –Э–∞ 1 —Б–Љ –≤—Л—И–µ –Њ—В —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є —В–Њ—З–Ї–Є –Є –љ–∞ 1вАФ2 –Љ–Љ –ї–µ–≤–µ–µ –Њ—В –Ї—А–∞—П –≥—А—Г¬≠–і–Є–љ—Л –і–µ–ї–∞—О—В –њ—А–Њ–Ї–Њ–ї –љ–∞ –≥–ї—Г–±–Є–љ—Г 1,5вАФ2 —Б–Љ, –і–µ—А–ґ–∞ –Є–≥–ї—Г –≤–µ—А¬≠—В–Є–Ї–∞–ї—М–љ–Њ. –Ю–і–љ–Њ–Љ–Њ–Љ–µ–љ—В–љ–Њ —Г –Ї—А—Л—Б –Љ–Њ–ґ–љ–Њ –њ–Њ–ї—Г—З–Є—В—М 6вАФ8 –Љ–ї –Ї—А–Њ–≤–Є.
–Ґ–Њ—В–∞–ї—М–љ–Њ–µ –Њ–±–µ—Б–Ї—А–Њ–≤–ї–Є–≤–∞–љ–Є–µ –Ї—А–Њ–ї–Є–Ї–∞. –Т—Б–Ї—А—Л–≤–∞—О—В –Њ–і–љ—Г –Є–Ј —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –њ–Њ –Њ–±–µ–Є–Љ —Б—В–Њ—А–Њ–љ–∞–Љ —В—А–∞—Е–µ–Є. –Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П —Б—В–µ—А–Є–ї—М–љ–Њ–є –Ї—А–Њ–≤–Є —А—Г–Ї–Є –Њ–њ–µ—А–Є—А—Г–µ–Љ–Њ–≥–Њ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —В—Й–∞—В–µ–ї—М–љ–Њ –≤—Л–Љ—Л—В—Л –Є –Њ–±—А–∞–±–Њ—В–∞–љ—Л —Б–њ–Є—А—В–Њ–Љ –Є–ї–Є —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –є–Њ–і–∞, –≤—Б–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ—Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞—В—М.
–Я–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –і–ї—П –Ї—А–Њ–≤–Њ–њ—Г—Б–Ї–∞–љ–Є—П –Ї—А–Њ–ї–Є–Ї–∞ –њ—А–Є–≤—П–Ј—Л–≤–∞—О—В —Б—В–∞–љ–Ї—Г –±—А—О—И–Ї–Њ–Љ –Ї–≤–µ—А—Е—Г, —Д–Є–Ї—Б–Є—А—Г—П –≥–Њ–ї–Њ–≤—Г –Ї–Њ–ї—М—Ж–Њ–Љ –Ї —И—В–∞—В–Є–≤—Г. –®–µ—А—Б—В—М –љ–∞ —И–µ–µ —В—Й–∞—В–µ–ї—М–љ–Њ –≤—Л—Б—В—А–Є–≥–∞—О—В, –Ї–Њ–ґ—Г –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—В. –Ъ –љ–Њ—Б—Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ—А–Є–Ї–ї–∞–і—Л–≤–∞—О—В –Ї—Г—Б–Њ—З–µ–Ї –≤–∞—В—Л, —Б–Љ–Њ¬≠—З–µ–љ–љ–Њ–є —Н—Д–Є—А–Њ–Љ. –Я–Њ—Б–ї–µ —В–Њ–≥–Њ –Ї–∞–Ї –љ–∞—Б—В—Г–њ–Є—В —Б–Њ—Б—В–Њ—П–љ–Є–µ –љ–∞—А–Ї–Њ–Ј–∞, —Б–Ї–∞–ї—М–њ–µ–ї–µ–Љ –і–µ–ї–∞—О—В —А–∞–Ј—А–µ–Ј –њ–Њ —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є —И–µ–Є –Є —А–∞–Ј–≤–Њ–і—П—В –Ї—А–∞—П —А–∞–љ—Л –њ–Є–љ—Ж–µ—В–Њ–Љ. –°–Њ–љ–љ—Л–µ –∞—А—В–µ—А–Є–Є –њ—А–Њ—Е–Њ–і—П—В –њ–Њ –±–Њ–Ї–∞–Љ —В—А–∞—Е–µ–Є –≤ —П—А–µ–Љ–љ–Њ–Љ –ґ–µ–ї–Њ–±–Ї–µ –Љ–µ–ґ–і—Г –≤–µ–љ–Њ–є –Є –љ–µ—А–≤–Њ–Љ. –°–≤–µ—А—Е—Г –∞—А—В–µ—А–Є—П –њ—А–Є–Ї—А—Л—В–∞ –≥—А—Г–і–Є–љ–Њ-–њ–Њ–і—К—П–Ј—Л—З–љ–Њ–є –Є –≥—А—Г–і–Є–љ–Њ-—Й–Є—В–Њ–≤–Є–і–љ–Њ–є –Љ—Л—И—Ж–∞–Љ–Є. –Я–Њ—Н—В–Њ–Љ—Г –і–ї—П –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П –љ–µ—А–≤–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –њ—Г—З–Ї–∞ —Н—В–Є –Љ—Л—И—Ж—Л —А–∞–Ј–і–µ–ї—П—О—В —В—Г–њ—Л–Љ –Ї–Њ–љ—Ж–Њ–Љ —Б–Ї–∞–ї—М–њ–µ–ї—П –Є–ї–Є –±—А–∞–љ—И–∞–Љ–Є –њ–Є–љ—Ж–µ—В–∞. –Р—А—В–µ—А–Є—О –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –Њ—В –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –Є –њ–Њ–і–≤–Њ–і—П—В –њ–Њ–і –љ–µ–µ –і–≤–µ –ї–Є–≥–∞—В—Г—А—Л. –С–ї–Є–ґ–∞–є¬≠—И—Г—О –Ї –≥–Њ–ї–Њ–≤–Ї–µ –ї–Є–≥–∞—В—Г—А—Г –Ј–∞–≤—П–Ј—Л–≤–∞—О—В –і–≤–Њ–є–љ—Л–Љ —Г–Ј–ї–Њ–Љ, –њ–Њ–Ј–∞–і–Є –≤—В–Њ—А–Њ–є –ї–Є–≥–∞—В—Г—А—Л –љ–∞ —А–∞—Б—Б—В–Њ—П–љ–Є–Є 0,3вАФ0,5 —Б–Љ –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В –њ–µ–∞–љ. –Ь–µ–ґ–і—Г –ї–Є–≥–∞—В—Г—А–Њ–є –Є –њ–µ–∞–љ–Њ–Љ –Љ–∞–ї–µ–љ—М–Ї–Є–Љ–Є –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л–Љ–Є –љ–Њ–ґ–љ–Є—Ж–∞–Љ–Є –і–µ–ї–∞—О—В –њ—А–Њ–і–Њ–ї—М–љ—Л–є —А–∞–Ј—А–µ–Ј —Б–Њ—Б—Г–і–∞ –і–ї–Є–љ–Њ–є –љ–µ –±–Њ¬≠–ї–µ–µ 1,5вАФ2 –Љ–Љ, –≤—Б—В–∞–≤–ї—П—П –≤ –љ–µ–≥–Њ –Ї–∞–љ—О–ї—О (—Б—В–µ–Ї–ї—П–љ–љ—Г—О —В—А—Г–±–Њ—З–Ї—Г —Б –Њ—В—В—П–љ—Г—В—Л–Љ –Ї–∞–њ–Є–ї–ї—П—А–Њ–Љ, –Ї–Њ–љ—З–Є–Ї –Ї–Њ—В–Њ—А–Њ–є —Б–Ї–Њ—И–µ–љ –Є —Е–Њ—А–Њ—И–Њ –Њ–њ–ї–∞–≤–ї–µ–љ). –Ъ–Њ–љ—З–Є–Ї –≤—Б—В–∞–≤–ї–µ–љ–љ–Њ–є –Ї–∞–љ—О–ї–Є —Г–Ї—А–µ–њ–ї—П—О—В –≤—В–Њ—А–Њ–є –ї–Є–≥–∞—В—Г—А–Њ–є. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ–Њ–і —А–µ–Ј–Є–љ–Њ–≤—Г—О —В—А—Г–±–Ї—Г, –љ–∞–і–µ—В—Г—О –љ–∞ —А–∞—Б—И–Є—А–µ–љ–љ—Г—О —З–∞—Б—В—М –Ї–∞–љ—О–ї–Є, –њ–Њ–і—Б—В–∞–≤–ї—П—О—В –њ—А–Њ–±–Є—А–Ї—Г –Є–ї–Є —Д–ї–∞¬≠–Ї–Њ–љ –Є —Б–љ–Є–Љ–∞—О—В –њ–µ–∞–љ —Б –∞—А—В–µ—А–Є–Є, —З—В–Њ–±—Л –Ї—А–Њ–≤—М –Љ–Њ–≥–ї–∞ –≤—Л—В–µ–Ї–∞—В—М —Б–≤–Њ–±–Њ–і–љ–Њ. –Ю–±–µ—Б–Ї—А–Њ–≤–ї–Є–≤–∞–љ–Є–µ –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –њ—А–Њ¬≠–Є–Ј–≤–Њ–і—П—В —В–∞–Ї –ґ–µ, –Ї–∞–Ї –Є –Ї—А–Њ–ї–Є–Ї–Њ–≤.
| –Т–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є –Є–Ј –≤–µ–љ—Л —Г—Е–∞ –Ї—А–Њ–ї–Є–Ї–∞.
–Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї—А–Њ–≤–Є –Є–Ј –Ї—А–∞–µ–≤–Њ–є –≤–µ–љ—Л –љ—Г–ґ–љ–Њ, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –≤—Л–Ј–≤–∞—В—М –≥–Є–њ–µ—А–µ–Љ–Є—О —Г—Е–∞, –њ–Њ—В–Є—А–∞—П –µ–≥–Њ –ї–∞–і–Њ–љ—П–Љ–Є —А—Г–Ї –Є —Б–ї–µ–≥–Ї–∞ —Г–і–∞—А—П—П –Ї–Њ–љ—З–Є–Ї–∞–Љ–Є –њ–∞–ї—М¬≠—Ж–µ–≤. –Ч–∞—В–µ–Љ –≤–і–Њ–ї—М –љ–∞—А—Г–ґ–љ–Њ–≥–Њ –Ї—А–∞—П —Г—Е–∞ —Г–і–∞–ї—П—О—В –њ—Г—И–Њ–Ї –Є –њ—А–Њ¬≠—В–Є—А–∞—О—В –≤–∞—В–Њ–є, —Г–≤–ї–∞–ґ–љ–µ–љ–љ–Њ–є 70% —Б–њ–Є—А—В–Њ–Љ. –Х—Б–ї–Є –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –≤—Б–µ—Е –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ—А–Њ—Ж–µ–і—Г—А —Б–Њ—Б—Г–і—Л –љ–µ –Є–љ—К–µ—Ж–Є—А—Г—О—В—Б—П, —Г—Е–Њ —Б–Љ–∞–Ј—Л–≤–∞—О—В –Ї—Б–Є–ї–Њ–ї–Њ–Љ –Є–ї–Є —В–Њ–ї—Г–Њ–ї–Њ–Љ. –Я–Њ—Б–ї–µ —В–Њ–≥–Њ –Ї–∞–Ї —Б–Њ—Б—Г–і—Л –љ–∞–±—Г—Е–љ—Г—В –Є —З–µ—В–Ї–Њ –Њ–±–Њ–Ј–љ–∞—З–∞—В—Б—П –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Г—И–љ–Њ–є —А–∞–Ї–Њ–≤–Є¬≠–љ—Л, –љ–∞—А—Г–ґ–љ—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –µ–µ –њ–Њ–Ї—А—Л–≤–∞—О—В —В–Њ–љ–Ї–Є–Љ —Б–ї–Њ–µ–Љ –ґ–Є–і¬≠–Ї–Њ–≥–Њ –њ–∞—А–∞—Д–Є–љ–∞ (–≤–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –±—Л—Б—В—А–Њ–≥–Њ —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є) –Є –і–µ–ї–∞—О—В –њ—А–Њ–Ї–Њ–ї –≤–µ–љ—Л.
–Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї—А–Њ–≤–Є (–Љ–µ–љ–µ–µ 1 –Љ–ї) –њ—А–Њ–Ї–∞–ї—Л–≤–∞—О—В –Њ–і–љ—Г –Є–Ј –љ–µ–±–Њ–ї—М—И–Є—Е –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –≤–µ—В–≤–µ–є, –∞ –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –±–Њ–ї—М—И–Є—Е –Њ–±—К–µ–Љ–Њ–≤ –Ї—А–Њ–≤–Є (5вАФ10 –Љ–ї) –≤—Б–Ї—А—Л–≤–∞—О—В –Ї—А–∞–µ–≤—Г—О –≤–µ–љ—Г —Г—Е–∞. –° —Н—В–Њ–є —Ж–µ–ї—М—О –Є–≥–ї—Г —И–њ—А–Є—Ж–∞ –≤–≤–Њ–і—П—В –≤ –≤–µ–љ—Г –њ–Њ—З—В–Є –њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Г—Е–∞, —З—В–Њ–±—Л –љ–µ –њ–Њ–≤—А–µ–і–Є—В—М –њ—А–Њ¬≠—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Г—О —Б—В–µ–љ–Ї—Г –≤–µ–љ—Л. –Я—А–Є –њ—А–Њ–Ї–Њ–ї–µ –≤–µ–љ—Л –Є–≥–ї–Њ–є —И–њ—А–Є—Ж–∞ –Ї—А–Њ–≤—М, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤—Л—Е–Њ–і–Є—В –Њ—В–і–µ–ї—М–љ—Л–Љ–Є –Ї–∞–њ–ї—П–Љ–Є —Б –±–Њ–ї—М¬≠—И–Є–Љ–Є –Є–љ—В–µ—А–≤–∞–ї–∞–Љ–Є, –Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П –±—Л—Б—В—А–Њ. –Ф–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л –≤—Л–Ј–≤–∞—В—М –Њ–±–Є–ї—М–љ–Њ–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ, –љ—Г–ґ–љ–Њ —Б–і–µ¬≠–ї–∞—В—М —А–∞–љ–Ї—Г —Б —А–≤–∞–љ—Л–Љ–Є –Ї—А–∞—П–Љ–Є. –° —Н—В–Њ–є —Ж–µ–ї—М—О –њ–Њ–ї—М–Ј—Г—О—В—Б—П –Њ–±¬≠–ї–Њ–Љ–Ї–Њ–Љ —В–Њ–љ–Ї–Њ–≥–Њ –Ї–∞–њ–Є–ї–ї—П—А–∞ –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї–Њ–є –њ–Є–њ–µ—В–Ї–Є. –Я—А–Є —В–∞–Ї–Њ–Љ —Б–њ–Њ—Б–Њ–±–µ –њ—А–Њ–Ї–Њ–ї–∞ –Є–Ј —Г—Е–∞ –Ї—А–Њ–ї–Є–Ї–∞ –њ–Њ–ї—Г—З–∞—О—В –і–Њ 30 –Љ–ї –Ї—А–Њ–≤–Є. –Я–Њ—Б–ї–µ –≤–Ј—П—В–Є—П –Ї—А–Њ–≤–Є –Ї –њ—А–Њ–Ї–Њ–ї—Г –≤–µ–љ—Л –њ—А–Є–Ї–ї–∞–і—Л–≤–∞—О—В –љ–∞ 2вАФ3 –Љ–Є–љ—Г—В—Л –Ї—Г—Б–Њ—З–µ–Ї —Б—Г—Е–Њ–є —Б—В–µ—А–Є–ї—М–љ–Њ–є –≤–∞—В—Л, –љ–µ –љ–∞–ґ–Є–Љ–∞—П —Б–Є–ї—М–љ–Њ –љ–∞ —Б—В–µ–љ–Ї—Г —Б–Њ—Б—Г–і–∞, —В–∞–Ї –Ї–∞–Ї –њ—А–Є —Н—В–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –Љ–Њ–ґ–µ—В —Г—Б–Є–ї–Є—В—М—Б—П. –Х—Б–ї–Є –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ –і–Њ–ї–≥–Њ –љ–µ –њ—А–µ–Ї—А–∞—Й–∞–µ—В—Б—П, —Е–Њ—А–Њ—И–Є–µ —А–µ¬≠–Ј—Г–ї—М—В–∞—В—Л –і–∞–µ—В –љ–∞–љ–µ—Б–µ–љ–Є–µ –љ–∞ —А–∞–љ–Ї—Г –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–∞–њ–µ–ї—М –њ–µ¬≠—А–µ–Ї–Є—Б–Є –≤–Њ–і–Њ—А–Њ–і–∞.
–Т–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є –Є–Ј –≤–µ–љ —Г –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї, –Ї—А—Л—Б –Є –Љ—Л—И–µ–є. –£ –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –Ї—А–Њ–≤—М –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 0,3вАФ0,5 –Љ–ї –њ–Њ–ї—Г—З–∞—О—В –њ–Њ—Б–ї–µ –љ–∞–љ–µ—Б–µ–љ–Є—П –љ–∞—Б–µ—З–µ–Ї –љ–∞ –Ї—А–∞–є —Г—Е–∞ –Є–ї–Є –њ—А–Њ–Ї–Њ–ї–∞ –Љ—П–≥–Ї–Є—Е –њ–Њ¬≠–і—Г—И–µ–Ї –ї–∞–њ—Л.
–£ –±–µ–ї—Л—Е –Ї—А—Л—Б –Є –Љ—Л—И–µ–є –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П 1вАФ3 –Ї–∞–њ–µ–ї—М –Ї—А–Њ¬≠–≤–Є –њ—А–Є—Е–Њ–і–Є—В—Б—П –њ—А–Є–±–µ–≥–∞—В—М –Ї –∞–Љ–њ—Г—В–∞—Ж–Є–Є –Ї–Њ–љ—З–Є–Ї–∞ —Е–≤–Њ—Б—В–∞ –њ–Њ—Б¬≠–ї–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–≥—А–µ–≤–∞–љ–Є—П –µ–≥–Њ –≤ –≤–Њ–і–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л 45вАФ50¬∞–° –Є–ї–Є –њ—А–Њ—В–Є—А–∞–љ–Є—П –Ї—Б–Є–ї–Њ–ї–Њ–Љ. –Т–Ј—П–≤ –Ї—А–Њ–≤—М, —А–∞–љ—Г –њ—А–Є–ґ–Є–≥–∞—О—В –њ–µ—А–µ–Ї–Є—Б—М—О –≤–Њ–і–Њ—А–Њ–і–∞.
–Х—Б—В—М —Б–њ–Њ—Б–Њ–±, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–є –њ–Њ–ї—Г—З–Є—В—М —Г –Ї—А—Л—Б 0,5вАФ1 –Љ–ї –Ї—А–Њ–≤–Є –Є–Ј –≤–µ–љ–Њ–Ј–љ–Њ–≥–Њ —Б–њ–ї–µ—В–µ–љ–Є—П, –ї–µ¬≠–ґ–∞—Й–µ–≥–Њ –≤ –Њ—А–±–Є—В–µ, –њ–Њ–Ј–∞–і–Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞. –Т–Ј—П—В–Є–µ –Ї—А–Њ–≤–Є –њ—А–Њ¬≠–Є–Ј–≤–Њ–і—П—В —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –њ–Є–њ–µ—В–Ї–Њ–є —Б –Њ—В—В—П–љ—Г—В—Л–Љ –Ї–∞–њ–Є–ї–ї—П—А–Њ–Љ (–љ–∞¬≠—А—Г–ґ–љ—Л–є –і–Є–∞–Љ–µ—В—А 0,6 –Љ–ї), –Њ—Б—В—А–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б—В–Њ—З–µ–љ–Њ –њ–Њ–і —Г–≥¬≠–ї–Њ–Љ 45¬∞.
–Ц–Є–≤–Њ—В–љ–Њ–µ –±–µ—А—Г—В I –Є II –њ–∞–ї—М—Ж–∞–Љ–Є –ї–µ–≤–Њ–є —А—Г–Ї–Є —Б–Њ —Б—В–Њ—А–Њ–љ—Л —Б–њ–Є–љ—Л –Ј–∞ —И–µ—О –Є —Б–ї–µ–≥–Ї–∞ —Б–і–∞–≤–ї–Є–≤–∞—О—В —Б –±–Њ–Ї–Њ–≤, –≤—Л–Ј—Л–≤–∞—П –ї–µ–≥–Ї–Њ–µ –≤—Л–њ—П—З–Є–≤–∞–љ–Є–µ –≥–ї–∞–Ј. –Т—А–∞—Й–∞—В–µ–ї—М–љ—Л–Љ –і–≤–Є–ґ–µ–љ–Є–µ–Љ –њ–Є–њ–µ—В–Ї–Є –і–µ–ї–∞¬≠—О—В –њ—А–Њ–Ї–Њ–ї –Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–∞–ї—М–љ–Њ–≥–Њ –Љ–µ—И–Ї–∞ –≤ –Љ–µ–і–Є–∞–ї—М–љ–Њ–Љ —Г–≥–ї—Г –≥–ї–∞¬≠–Ј–∞ –Љ–µ–ґ–і—Г –≥–ї–∞–Ј–љ—Л–Љ —П–±–ї–Њ–Ї–Њ–Љ –Є –Њ—А–±–Є—В–Њ–є. –Я–Њ—Б–ї–µ –њ—А–Њ–Ї–Њ–ї–∞ –њ–Є–њ–µ—В¬≠–Ї—Г –≤–µ–і—Г—В –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –≥–Њ—А—В–∞–љ–Є –љ–∞ –≥–ї—Г–±–Є–љ—Г 4вАФ5 –Љ–Љ. –Я–Њ–њ–∞¬≠–і–∞–љ–Є–µ –≤ –≤–µ–љ–Њ–Ј–љ–Њ–µ —Б–њ–ї–µ—В–µ–љ–Є–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ј–∞–њ–Њ–ї–љ–µ–љ–Є–µ–Љ –Ї–∞¬≠–њ–Є–ї–ї—П—А–∞ –њ–Є–њ–µ—В–Ї–Є –Ї—А–Њ–≤—М—О.
–Я–Њ–ї—Г—З–µ–љ–Є–µ –і–µ—Д–Є–±—А–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є –Ї—А–Њ–≤–Є. –Ъ—А–Њ–≤—М –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ —Б–ї–Є–≤–∞—О—В –≤ —Б—В–µ—А–Є–ї—М–љ—Г—О –Ї–Њ–ї–±—Г —Б–Њ —Б—В–µ–Ї–ї—П–љ–љ—Л–Љ–Є –±—Г¬≠—Б–∞–Љ–Є –Є –љ–µ–њ—А–µ—А—Л–≤–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 10вАФ15 –Љ–Є–љ –≤—Б—В—А—П—Е–Є–≤–∞—О—В. –Т —А–µ¬≠–Ј—Г–ї—М—В–∞—В–µ –≤—Б—В—А—П—Е–Є–≤–∞–љ–Є—П –љ–∞—Е–Њ–і—П—Й–Є–є—Б—П –≤ –Ї—А–Њ–≤–Є —Д–Є–±—А–Є–љ –≤—Л–њ–∞–і–∞¬≠–µ—В –≤ –Њ—Б–∞–і–Њ–Ї, –Њ–±–≤–Њ–ї–∞–Ї–Є–≤–∞—П –±—Г—Б—Л, –∞ –і–µ—Д–Є–±—А–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї—А–Њ–≤—М, —Б–ї–Є—В–∞—П –≤ –і—А—Г–≥—Г—О –Ї–Њ–ї–±—Г –Є–ї–Є –њ—А–Њ–±–Є—А–Ї—Г, —Г—В—А–∞—З–Є–≤–∞–µ—В —Б–њ–Њ—Б–Њ–±¬≠–љ–Њ—Б—В—М —Б–≤–µ—А—В—Л–≤–∞—В—М—Б—П.
–Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ –≤–Ј–≤–µ—Б–Є —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤. –Ф–ї—П –Њ—Б¬≠–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П –Њ—В –њ–ї–µ–љ–Њ–Ї —Д–Є–±—А–Є–љ–∞ –і–µ—Д–Є–±—А–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О –Ї—А–Њ–≤—М —Д–Є–ї—М—В—А—Г—О—В —З–µ—А–µ–Ј —В—А–µ—Е—Б–ї–Њ–є–љ—Л–є –Љ–∞—А–ї–µ–≤—Л–є —Д–Є–ї—М—В—А. –§–Є–ї—М—В—А–∞—В –љ–∞–ї–Є–≤–∞—О—В –≤ —Ж–µ–љ—В—А–Є—Д—Г–ґ–љ—Л–µ –њ—А–Њ–±–Є—А–Ї–Є –Є —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А—Г—О—В –њ—А–Є 2000вАФ3000 –Њ–±./–Љ–Є–љ. –≤ —В–µ—З–µ–љ–Є–µ 10вАФ15 –Љ–Є–љ—Г—В. –≠—А–Є—В—А–Њ—Ж–Є—В—Л –Њ—Б–µ–і–∞—О—В –љ–∞ –і–љ–Њ –њ—А–Њ–±–Є—А–Ї–Є, –∞ –њ—А–Њ–Ј—А–∞—З–љ–∞—П, —Б–ї–µ–≥–Ї–∞ –ґ–µ–ї—В–Њ–≤–∞—В–Њ–≥–Њ —Ж–≤–µ—В–∞ –њ–ї–∞–Ј–Љ–∞ –Њ–±—А–∞–Ј—Г–µ—В –љ–∞–і–Њ—Б–∞–і–Њ—З–љ—Л–є —Б–ї–Њ–є. –Я–Њ—Б–ї–µ —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞¬≠–љ–Є—П —Г—А–Њ–≤–µ–љ—М –ґ–Є–і–Ї–Њ—Б—В–Є –≤ –њ—А–Њ–±–Є—А–Ї–µ –Њ—В–Љ–µ—З–∞—О—В –Ї–∞—А–∞–љ–і–∞—И–Њ–Љ, –Њ—В¬≠—Б–∞—Б—Л–≤–∞—О—В –њ–ї–∞–Ј–Љ—Г –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї–Њ–є –њ–Є–њ–µ—В–Ї–Њ–є, —Н—А–Є—В—А–Њ—Ж–Є—В—Л –њ—А–Њ–Љ—Л¬≠–≤–∞—О—В, –і–Њ–ї–Є–≤–∞—П –і–Њ –Љ–µ—В–Ї–Є —Б—В–µ—А–Є–ї—М–љ—Л–є –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є–є —А–∞—Б—В–≤–Њ—А —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П, –Є –≤–љ–Њ–≤—М —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А—Г—О—В. –Я—А–Њ–Љ—Л–≤–∞–љ–Є–µ —Н—А–Є—В¬≠—А–Њ—Ж–Є—В–Њ–≤ —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ —Б–≤–µ–ґ–µ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –њ—А–Њ–Є–Ј–≤–Њ–і—П—В 2вАФ3 —А–∞–Јa, —З—В–Њ–±—Л –њ–Њ—Б–ї–µ–і–љ—П—П –њ–Њ—А—Ж–Є—П –њ—А–Њ–Љ—Л–≤–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –±—Л–ї–∞ –±–µ—Б¬≠—Ж–≤–µ—В–љ–∞.
–Ш–Ј –њ—А–Њ–Љ—Л—В—Л—Е —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –≥–Њ—В–Њ–≤—П—В 3% –Є–ї–Є 5% –≤–Ј–≤–µ—Б—М, –њ—А–Є–±–∞–≤–ї—П—П –Ї 3вАФ5 –Љ–ї —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ 97вАФ95 –Љ–ї –Є–Ј–Њ¬≠—В–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П (–і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Љ–µ–љ—М¬≠—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ –≤–Ј–≤–µ—Б–Є –Њ–±—К–µ–Љ—Л –Њ–±–Њ–Є—Е –Є–љ–≥—А–µ–і–Є–µ–љ—В–Њ–≤ —Г–Љ–µ–љ—М—И–∞¬≠—О—В –≤ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–µ —З–Є—Б–ї–Њ —А–∞–Ј).
–Т–Ј–≤–µ—Б—М —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М –≤ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї–µ –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 3вАФ4¬∞–° –≤ —В–µ—З–µ–љ–Є–µ 5вАФ6 –і–љ–µ–є.
–Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є. –Ъ—А–Њ–≤—М, —Б–Њ¬≠–±—А–∞–љ–љ—Г—О –≤ —Б—В–µ—А–Є–ї—М–љ—Г—О –њ—А–Њ–±–Є—А–Ї—Г, –Ј–∞–Ї—А—Л–≤–∞—О—В –≤–∞—В–љ–Њ-–Љ–∞—А–ї–µ–≤–Њ–є –њ—А–Њ–±–Ї–Њ–є, —Б—В–∞–≤—П—В –љ–∞ 20вАФ30 –Љ–Є–љ –≤ —В–µ—А–Љ–Њ—Б—В–∞—В –Є–ї–Є –≤–Њ–і—П–љ—Г—О –±–∞¬≠–љ—О, –Њ—В—А–µ–≥—Г–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –љ–∞ 37¬∞–°, —В–∞–Ї –Ї–∞–Ї –≤ —В–µ–њ–ї–µ –Ї—А–Њ–≤—М —Б–≤–µ—А¬≠—В—Л–≤–∞–µ—В—Б—П –±—Л—Б—В—А–µ–µ –Є –ї—Г—З—И–µ. –Т–Њ –≤—А–µ–Љ—П —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П —Б–≥—Г—Б—В–Њ–Ї –Ї—А–Њ–≤–Є –Њ–±—Л—З–љ–Њ –њ—А–Є–ї–Є–њ–∞–µ—В –Ї —Б—В–µ–љ–Ї–∞–Љ –њ—А–Њ–±–Є—А–Ї–Є. –Я–Њ—Н—В–Њ–Љ—Г –њ–Њ—Б–ї–µ –≤–Ј—П—В–Є—П –њ—А–Њ–±–Є—А–Њ–Ї –Є–Ј —В–µ—А–Љ–Њ—Б—В–∞—В–∞ —Б–≥—Г—Б—В–Њ–Ї –Њ—В–і–µ–ї—П—О—В –Њ—В —Б—В–µ–љ–Њ–Ї –њ—А–Њ–±–Є—А–Ї–Є –Ї—А—Г–≥–Њ–≤—Л–Љ –і–≤–Є–ґ–µ–љ–Є–µ–Љ –Ї–∞–њ–Є–ї–ї—П—А–∞ —Б—В–µ—А–Є–ї—М–љ–Њ–є –њ–∞—Б—В–µ¬≠—А–Њ–≤—Б–Ї–Њ–є –њ–Є–њ–µ—В–Ї–Є –Є–ї–Є —Б—В–µ–Ї–ї—П–љ–љ–Њ–є —Б—В–µ—А–Є–ї—М–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Њ–є.
–Я–Њ—Б–ї–µ –Њ—В–і–µ–ї–µ–љ–Є—П —Б–≥—Г—Б—В–Ї–∞ —Б—Л–≤–Њ—А–Њ—В–Ї—Г —Б—В–∞–≤—П—В –≤ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 3вАФ4¬∞–°. –Т —В–µ—З–µ–љ–Є–µ 3вАФ4 —З —Б—Л–≤–Њ—А–Њ—В–Ї–∞ –Њ–±—Л—З–љ–Њ –Њ—В–і–µ–ї—П–µ—В—Б—П –њ–Њ–ї–љ–Њ—Б—В—М—О, –Є –µ–µ –Љ–Њ–ґ–љ–Њ –Њ—В—Б–Њ—Б–∞—В—М —Б—В–µ—А–Є–ї—М–љ–Њ–є –њ–∞—Б—В–µ¬≠—А–Њ–≤—Б–Ї–Њ–є –њ–Є–њ–µ—В–Ї–Њ–є. –Ф–ї—П —В–Њ–≥–Њ —З—В–Њ–±—Л –≤–Њ –≤—А–µ–Љ—П –Њ—В—Б–∞—Б—Л–≤–∞–љ–Є—П —Б–Њ¬≠–і–µ—А–ґ–Є–Љ–Њ–µ –њ—А–Њ–±–Є—А–Ї–Є –±—Л–ї–Њ —Е–Њ—А–Њ—И–Њ –≤–Є–і–љ–Њ, –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї—Г—О –њ–Є¬≠–њ–µ—В–Ї—Г —Б–Њ–µ–і–Є–љ—П—О—В —Б–Њ —Б—В–µ–Ї–ї—П–љ–љ–Њ–є —В—А—Г–±–Ї–Њ–є вАФ ¬Ђ–Љ—Г–љ–і—И—В—Г–Ї–Њ–Љ¬ї (—А–µ¬≠–Ј–Є–љ–Њ–≤–∞—П —В—А—Г–±–Ї–∞ –і–ї–Є–љ–Њ–є 20вАФ25 —Б–Љ). –Я—А–Є –Њ—В—Б–∞—Б—Л–≤–∞–љ–Є–Є –Ї–Њ–љ—З–Є–Ї –њ–Є–њ–µ—В–Ї–Є –љ–µ –і–Њ–ї–ґ–µ–љ —Б–Њ–њ—А–Є–Ї–∞—Б–∞—В—М—Б—П —Б–Њ —Б–≥—Г—Б—В–Ї–Њ–Љ –Ї—А–Њ–≤–Є, —З—В–Њ–±—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї—Г –љ–µ –њ–Њ–њ–∞–ї–Є —Н—А–Є—В—А–Њ—Ж–Є—В—Л.
–Ю–Ї—А–∞—И–µ–љ–љ—Г—О –≤ —А–Њ–Ј–Њ–≤—Л–є —Ж–≤–µ—В —Б—Л–≤–Њ—А–Њ—В–Ї—Г —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А—Г—О—В –њ—А–Є 2000вАФ3000 –Њ–±./–Љ–Є–љ. –≤ —В–µ—З–µ–љ–Є–µ 10вАФ15 –Љ–Є–љ –і–ї—П –Њ—Б–∞–ґ–і–µ–љ–Є—П —Д–Њ—А–Љ–µ–љ–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –Ї—А–Њ–≤–Є.
–Я—А–Є –≤–Ј—П—В–Є–Є –Ї—А–Њ–≤–Є –≤—Б–Ї–Њ—А–µ –њ–Њ—Б–ї–µ –Ї–Њ—А–Љ–ї–µ–љ–Є—П –ґ–Є–≤–Њ—В–љ—Л—Е, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—А–Њ–≤–Њ–њ—Г—Б–Ї–∞–љ–Є—П—Е —Б –Ї–Њ—А–Њ—В–Ї–Є–Љ–Є –Є–љ—В–µ—А–≤–∞¬≠–ї–∞–Љ–Є –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –Є–љ–Њ–≥–і–∞ –ї–Є–њ–µ–Љ–Є—П, —В. –µ. –њ–Њ—П–≤–ї–µ–љ–Є–µ –Є–Ј–±—Л—В–Ї–∞ –ґ–Є¬≠—А–Њ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤ –≤ –Ї—А–Њ–≤–Є. –°—Л–≤–Њ—А–Њ—В–Ї–Є, –њ–Њ–ї—Г—З–∞–µ–Љ—Л–µ –≤–Њ –≤—А–µ–Љ—П –ї–Є–њ–µ–Љ–Є–Є, –±—Л–≤–∞—О—В –Љ—Г—В–љ—Л–µ (—Е–Є–ї–µ–Ј–љ—Л–µ), –Є–љ–Њ–≥–і–∞ –Њ–њ–∞–ї–µ—Б—Ж–Є—А—Г—О—Й–Є–µ, –Є —Н—В–Њ –Њ—З–µ–љ—М –Ј–∞—В—А—Г–і–љ—П–µ—В —З—В–µ–љ–Є–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є, –Њ—Б–Њ¬≠–±–µ–љ–љ–Њ —А–µ–∞–Ї—Ж–Є–Є –њ—А–µ—Ж–Є–њ–Є—В–∞—Ж–Є–Є. –Т–Њ –Є–Ј–±–µ–ґ–∞–љ–Є–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –Љ—Г—В¬≠–љ—Л—Е —Б—Л–≤–Њ—А–Њ—В–Њ–Ї –Ї—А–Њ–≤—М —Г –ґ–Є–≤–Њ—В–љ—Л—Е –±–µ—А—Г—В –љ–∞—В–Њ—Й–∞–Ї. –Я—А–Њ—Б–≤–µ—В–ї–µ¬≠–љ–Є–µ –ї–Є–њ–µ–Љ–Є—З–µ—Б–Ї–Њ–є –њ–ї–∞–Ј–Љ—Л –љ–∞—Б—В—Г–њ–∞–µ—В —В–∞–Ї–ґ–µ –њ—А–Є –≤–≤–µ–і–µ–љ–Є–Є –≤ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ–Њ–µ —А—Г—Б–ї–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –≥–µ–њ–∞—А–Є–љ–∞, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–µ–≥–Њ –њ–Њ¬≠–≤—Л—И–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –Ї—А–Њ–≤–Є —Д–µ—А–Љ–µ–љ—В–∞, –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ —Д–∞–Ї¬≠—В–Њ—А–Њ–Љ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П. –° —Н—В–Њ–є —Ж–µ–ї—М—О –Ї—А–Њ–ї–Є–Ї–∞–Љ –≤–µ—Б–Њ–Љ 2вАФ2,5 –Ї–≥ –≤ –Ї—А–∞–µ–≤—Г—О –≤–µ–љ—Г —Г—Е–∞ –≤–≤–Њ–і—П—В –Ј–∞ 1вАФ1,5 —З –і–Њ –Њ–±–µ—Б–Ї—А–Њ–≤–ї–Є–≤–∞–љ–Є—П 60 –Љ–≥ –≥–µ–њ–∞—А–Є–љ–∞.
–§–Њ—А–Љ–µ–љ–љ—Л–µ —Н–ї–µ–Љ–µ–љ—В—Л –Є–Ј –Ї—А–Њ–≤–Є —Г–і–∞–ї—П—О—В —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞¬≠–љ–Є–µ–Љ. –Т —Б–ї–Є—В–Њ–є —Б –Њ—Б–∞–і–Ї–∞ –њ–ї–∞–Ј–Љ–µ —З–µ—А–µ–Ј –Ї–Њ—А–Њ—В–Ї–Њ–µ –≤—А–µ–Љ—П –њ–Њ—Б–ї–µ —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А–Њ–≤–∞–љ–Є—П –Њ–±—А–∞–Ј—Г–µ—В—Б—П —Б–≥—Г—Б—В–Њ–Ї —Д–Є–±—А–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —Г–њ¬≠–ї–Њ—В–љ—П–µ—В—Б—П –њ—А–Є –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є–Є –Ї—А–Њ–≤–Є —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –њ–∞–ї–Њ—З–Ї–Њ–є. –Ч–∞—В–µ–Љ —Н—В–Њ—В —Б–≥—Г—Б—В–Њ–Ї —Г–і–∞–ї—П—О—В. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е —Д–Є–±—А–Є–љ –Є–Ј –њ–ї–∞–Ј–Љ—Л –≤—Л–њ–∞–і–∞–µ—В –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О. –Ф–ї—П —Г–і–∞–ї–µ–љ–Є—П –Њ—Б—В–∞—В–Ї–Њ–≤ —Д–Є–±¬≠—А–Є–љ–∞ –Є –≤—Л—П–≤–ї–µ–љ–Є—П –њ–Њ–ї–љ–Њ—В—Л –µ–≥–Њ —Г–і–∞–ї–µ–љ–Є—П –Ї —Б—Л–≤–Њ—А–Њ—В–Ї–µ –њ—А–Є¬≠–±–∞–≤–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–∞–њ–µ–ї—М —В—А–Њ–Љ–±–Є–љ–∞. –Ю—Б–≤–Њ–±–Њ–ґ–і–µ–љ–љ—Г—О –Њ—В —Д–Є–±¬≠—А–Є–љ–∞ —Б—Л–≤–Њ—А–Њ—В–Ї—Г —Д–Є–ї—М—В—А—Г—О—В —З–µ—А–µ–Ј –∞—Б–±–µ—Б—В–Њ–≤—Л–µ —Д–Є–ї—М—В—А—Л. –Я–Њ–ї—Г¬≠—З–µ–љ–љ–∞—П —В–∞–Ї–Є–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ —Б—Л–≤–Њ—А–Њ—В–Ї–∞ —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –њ—А–Њ–Ј—А–∞—З–љ–∞ –Є –љ–µ –Є–Љ–µ–µ—В –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Њ–њ–∞–ї–µ—Б—Ж–µ–љ—Ж–Є–Є.
–Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ —Ж–Є—В—А–∞—В–љ–Њ–є –Ї—А–Њ–≤–Є. –Я–Њ–ї—Г—З–µ–љ–љ—Г—О –Є–Ј —Б–µ—А–і—Ж–∞ –Є–ї–Є –≤–µ–љ—Л –Ї—А–Њ–≤—М —Б–ї–Є–≤–∞—О—В –≤ –њ—А–Њ–±–Є—А–Ї—Г —Б 5% —А–∞—Б—В–≤–Њ¬≠—А–Њ–Љ —Ж–Є—В—А–∞—В–∞ –љ–∞—В—А–Є—П (10 –Љ–ї –Ї—А–Њ–≤–Є, 1 –Љ–ї —Ж–Є—В—А–∞—В–∞ –љ–∞—В—А–Є—П). –¶–Є—В—А–∞—В–љ–∞—П –Ї—А–Њ–≤—М –љ–µ —Б–≤–µ—А—В—Л–≤–∞–µ—В—Б—П.
–Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є.
–¶–Є—В—А–∞—В–љ—Г—О –Ї—А–Њ–≤—М —Б—В–∞–≤—П—В –љ–∞ 18вАФ20 —З –≤ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї –Є–ї–Є –њ–Њ–і–≤–µ—А–≥–∞—О—В —Ж–µ–љ—В—А–Є—Д—Г¬≠–≥–Є—А–Њ–≤–∞–љ–Є—О. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –љ–∞–і –Њ—Б–∞–і–Ї–Њ–Љ —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ –Њ–±—А–∞–Ј—Г–µ—В—Б—П –њ—А–Њ–Ј—А–∞—З–љ—Л–є —Б–ї–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –ґ–µ–ї—В–Њ–≤–∞—В–Њ–≥–Њ —Ж–≤–µ—В–∞вАФ–њ–ї–∞–Ј–Љ—Л.
–£–Љ–µ—А—Й–≤–ї–µ–љ–Є–µ –Є –≤—Б–Ї—А—Л—В–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е
–Т –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–љ—П—В—Л —Б–њ–Њ—Б–Њ–±—Л —Г–Љ–µ—А—Й–≤–ї–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –њ—А–Њ—Б—В–Њ—В–Њ–є –њ—А–Є–µ–Љ–Њ–≤ –Є –≤—Л–Ј—Л–≤–∞—О—В –±—Л—Б—В—А—Г—О, –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ—Г—О —Б–Љ–µ—А—В—М –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ. –Ь—Л—И–µ–є, –Ї—А—Л—Б, –Љ–Њ—А—Б–Ї–Є—Е —Б–≤–Є–љ–Њ–Ї –њ–Њ¬≠–Љ–µ—Й–∞—О—В –≤ —Б—В–µ–Ї–ї—П–љ–љ—Г—О, –њ–ї–Њ—В–љ–Њ –Ј–∞–Ї—А—Л–≤–∞—О—Й—Г—О—Б—П –±–∞–љ–Ї—Г —Б –Ї—Г¬≠—Б–Њ—З–Ї–Њ–Љ –≤–∞—В—Л, –њ—А–Њ–њ–Є—В–∞–љ–љ—Л–Љ —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ –Є–ї–Є —Н—Д–Є—А–Њ–Љ. –Ц–Є¬≠–≤–Њ—В–љ—Л–µ –Ј–∞—Б—Л–њ–∞—О—В –Є –≥–Є–±–љ—Г—В –≤ —В–µ—З–µ–љ–Є–µ 3вАФ5 –Љ–Є–љ—Г—В. –Ъ—А–Њ–ї–Є–Ї–Њ–≤ —Г–Љ–µ—А—Й–≤–ї—П—О—В –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –≤–Њ–Ј–і—Г—И–љ–Њ–є —Н–Љ–±–Њ–ї–Є–Є. –Ф–ї—П —Н—В–Њ–≥–Њ –≤ –Ї—А–∞–µ–≤—Г—О –≤–µ–љ—Г —Г—Е–∞ –њ–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—О –Ї –µ–≥–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є—О –≤–≤–Њ–і—П—В –Є–≥–ї—Г —И–њ—А–Є—Ж–∞. –Я–Њ—П–≤–ї–µ–љ–Є–µ –Ї–∞–њ–µ–ї—М–Ї–Є –Ї—А–Њ–≤–Є —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –Є–≥–ї–∞ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –≤–µ–љ–µ. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Є–≥–ї—Г —Б–Њ–µ–і–Є–љ—П—О—В —Б –њ—Г¬≠—Б—В—Л–Љ 10-–≥—А–∞–Љ–Љ–Њ–≤—Л–Љ —И–њ—А–Є—Ж–µ–Љ, –њ–Њ—А—И–µ–љ—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤—Л—В—П–љ—Г—В –і–Њ –Ї–Њ–љ—Ж–∞. –Я—А–Є –љ–∞–і–∞–≤–ї–Є–≤–∞–љ–Є–Є –љ–∞ –њ–Њ—А—И–µ–љ—М –≤ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Г—О —Б–Є—Б—В–µ–Љ—Г –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –њ–Њ—Б—В—Г–њ–∞–µ—В –љ–∞—Е–Њ–і—П—Й–Є–є—Б—П –≤ —Ж–Є–ї–Є–љ–і—А–µ —И–њ—А–Є—Ж–∞ –і—Г—Е, –≤—Л–Ј—Л–≤–∞—П —Н–Љ–±–Њ–ї–Є—О –Є –±—Л—Б—В—А—Г—О —Б–Љ–µ—А—В—М.
–Т—Б–Ї—А—Л—В–Є–µ –ґ–Є–≤–Њ—В–љ—Л—Е
–Ґ—А—Г–њ—Л –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –≤—Б–Ї—А—Л–≤–∞—О—В —Б —Ж–µ–ї—М—О –≤—Л—П—Б–љ–µ–љ–Є—П –њ—А–Є—З–Є–љ –≥–Є–±–µ–ї–Є, –≤—Л–і–µ–ї–µ–љ–Є—П –≤–≤–µ¬≠–і–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є –Љ–µ—Б—В–∞ –Є—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, –Є–Ј—Г—З–µ–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Њ–∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –љ–∞—Б—В—Г–њ–∞—О—Й–Є—Е –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є. –Т—Б–Ї—А—Л—В–Є–µ —В—А—Г–њ–Њ–≤ –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–Є–Ј–≤–Њ¬≠–і—П—В —Б—В–µ—А–Є–ї—М–љ—Л–Љ–Є –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–Љ–Є, —Б–Њ–±–ї—О–і–∞—П –њ—А–∞–≤–Є–ї–∞ –∞—Б–µ–њ¬≠—В–Є–Ї–Є.
–Э–∞ —Б—В–Њ–ї–µ –і–Њ–ї–ґ–љ—Л –љ–∞—Е–Њ–і–Є—В—М—Б—П —Б—В–∞–Ї–∞–љ, –љ–∞–њ–Њ–ї–љ–µ–љ–љ—Л–є –і–Њ –њ–Њ¬≠–ї–Њ–≤–Є–љ—Л —Б–њ–Є—А—В–Њ–Љ, —Б—В–µ—А–Є–ї—М–љ—Л–µ –љ–Њ–ґ–љ–Є—Ж—Л, —Б–Ї–∞–ї—М–њ–µ–ї—М, –∞–љ–∞—В–Њ–Љ–Є—З–µ¬≠—Б–Ї–Є–µ –Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–µ –њ–Є–љ—Ж–µ—В—Л, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –њ–µ—В–ї—П, —Б—В–µ—А–Є–ї—М¬≠–љ—Л–µ —З–∞—И–Ї–Є –Я–µ—В—А–Є, –њ—А–Њ–±–Є—А–Ї–Є –Є —З–∞—И–Ї–Є —Б –њ–Є—В–∞—В–µ–ї—М–љ—Л–Љ–Є —Б—А–µ–і–∞¬≠–Љ–Є, —Б—В–µ—А–Є–ї—М–љ—Л–µ –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї–Є–µ –њ–Є–њ–µ—В–Ї–Є, –њ—А–µ–і–Љ–µ—В–љ—Л–µ —Б—В–µ–Ї–ї–∞, —Б—В–µ¬≠—А–Є–ї—М–љ—Л–є –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Є–є —А–∞—Б—В–≤–Њ—А —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П, –±–∞–љ–Ї–∞ —Б –і–µ–Ј¬≠–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ, –≤–∞—В–љ—Л–µ —В–∞–Љ–њ–Њ–љ—Л, —Б–њ–Є—З–Ї–Є –Є –≥–Њ—А–µ–ї–Ї–Є (—Б–њ–Є—А—В–Њ–≤–∞—П –Є –≥–∞–Ј–Њ–≤–∞—П). –Т—Б–Ї—А—Л—В–Є–µ —В—А—Г–њ–Њ–≤ —Б–ї–µ–і—Г–µ—В –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В—М —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —З—В–Њ–±—Л –њ—А–µ–і—Г–њ—А–µ–і–Є—В—М –≤–љ–µ—Б–µ–љ–Є–µ –Љ–Є–Ї—А–Њ¬≠–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ —Б –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –≤ –≥–ї—Г–±–Є–љ—Г —В–Ї–∞–љ–µ–є, –∞ —В–∞–Ї–ґ–µ –њ–µ—А–µ–љ–Њ—Б –Љ–Є–Ї—А–Њ–±–Њ–≤ –Є–Ј –Њ–і–љ–Њ–≥–Њ –Њ—А–≥–∞–љ–∞ –≤ –і—А—Г–≥–Њ–є. –° —Н—В–Њ–є —Ж–µ–ї—М—О —А–µ–Ї–Њ–Љ–µ–љ¬≠–і—Г–µ—В—Б—П –≤—Б–Ї—А—Л–≤–∞—В—М –ґ–Є–≤–Њ—В–љ—Л—Е –≤ –∞–≥–Њ–љ–∞–ї—М–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, —Г—Б—Л–њ–Є–≤ –Є—Е —Н—Д–Є—А–Њ–Љ, –Є–ї–Є —В–Њ—В—З–∞—Б –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П —Б–Љ–µ—А—В–Є, —В–∞–Ї –Ї–∞–Ї –≤ –±–ї–Є–ґ–∞–є—И–Є–µ —З–∞—Б—Л –њ–Њ—Б–ї–µ –љ–µ–µ –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В—М —В–Ї–∞–љ–µ–є –љ–∞—А—Г—И–∞–µ—В—Б—П, –Є –±–∞–Ї—В–µ—А–Є–Є –Є–Ј –Њ–і–љ–Њ–≥–Њ –Њ—А–≥–∞–љ–∞ –Љ–Њ–≥—Г—В –њ—А–Њ–љ–Є–Ї–љ—Г—В—М –≤ –і—А—Г–≥–Њ–є. –Ю—Б–Њ–±—Г—О –Њ–њ–∞—Б–љ–Њ—Б—В—М –≤ —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –Ї–Є—И–µ—З–љ–Є–Ї, —Б–Њ¬≠–і–µ—А–ґ–Є–Љ–Њ–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є–Ј–Њ–±–Є–ї—Г–µ—В –Љ–Є–Ї—А–Њ–±–∞–Љ–Є.
–Ґ—А—Г–њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –±—А—О—И–Ї–Њ–Љ –Ї–≤–µ—А—Е—Г –Ї–ї–∞–і—Г—В –љ–∞ –і–µ—А–µ–≤—П–љ–љ—Г—О –і–Њ—Б–Ї—Г –Є–ї–Є –ї–Њ—В–Њ–Ї —Б –њ–ї–∞—Б—В–Є–љ–Ї–Њ–є –Ј–∞—Б—В—Л–≤—И–µ–≥–Њ –њ–∞—А–∞—Д–Є–љ–∞, —А–∞—Б—В—П–≥–Є¬≠–≤–∞—О—В –њ–Є–љ—Ж–µ—В–Њ–Љ –≤—Б–µ 4 –ї–∞–њ—Л –Є –≤ —В–∞–Ї–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є —Д–Є–Ї—Б–Є—А—Г—О—В –Є—Е –±—Г–ї–∞–≤–Ї–∞–Љ–Є –Є–ї–Є –љ–µ–±–Њ–ї—М—И–Є–Љ–Є –Њ—Б—В—А—Л–Љ–Є –≥–≤–Њ–Ј–і–Є–Ї–∞–Љ–Є –Ї –њ–Њ¬≠–≤–µ—А—Е–љ–Њ—Б—В–Є –і–µ—А–µ–≤–∞ –Є–ї–Є –њ–∞—А–∞—Д–Є–љ–∞. –У—А—Г–і—М –Є –±—А—О—И–Ї–Њ –њ—А–Њ—В–Є—А–∞—О—В –≤–∞—В–Њ–є, —Б–Љ–Њ—З–µ–љ–љ–Њ–є 5% —А–∞—Б—В–≤–Њ—А–Њ–Љ –Ї–∞—А–±–Њ–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–ї–Є 5% —А–∞—Б—В–≤–Њ—А–Њ–Љ —Е–ї–Њ—А–∞–Љ–Є–љ–∞, –Є–ї–Є, –ї—Г—З—И–µ, —Б–Љ–∞—З–Є–≤–∞—О—В —Б–њ–Є—А—В–Њ–Љ –Є –њ–Њ–і–ґ–Є–≥–∞—О—В —И–µ—А—Б—В—М, —З—В–Њ–±—Л —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ—Б—П –љ–∞ –љ–µ–є –Љ–Є–Ї—А–Њ–±—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Б–њ–Њ—А–Њ–љ–Њ—Б–љ—Л–µ –њ–∞–ї–Њ—З–Ї–Є, –љ–µ —А–∞–Ј–ї–µ—В–∞–ї–Є—Б—М –Є –љ–µ –Ј–∞–≥—А—П–Ј–љ—П–ї–Є —Б—В–µ—А–Є–ї—М–љ—Л–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л –Є –Њ—А–≥–∞–љ—Л –≤—Б–Ї—А—Л—В–Є—П —В—А—Г–њ–∞. –Т –њ—А–Њ—Ж–µ—Б¬≠—Б–µ –≤—Б–Ї—А—Л—В–Є—П –њ—А–Є–і–µ—А–ґ–Є–≤–∞—О—В—Б—П –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–≥–Њ –њ–Њ—А—П–і–Ї–∞. –°–љ–∞¬≠—З–∞–ї–∞ –Є—Б—Б–ї–µ–і—Г—О—В –љ–∞—А—Г–ґ–љ—Л–µ –њ–Њ–Ї—А–Њ–≤—Л –Є –њ–Њ–і–Ї–Њ–ґ–љ—Г—О –Ї–ї–µ—В—З–∞—В–Ї—Г, –Ј–∞—В–µ–Љ –њ—А–Њ–≤–Њ–і—П—В –≤—Б–Ї—А—Л—В–Є–µ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –≤–Ј—П—В–Є–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –≥—А—Г–і–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –∞ –≤ –њ–Њ—Б–ї–µ–і–љ—О—О –Њ—З–µ—А–µ–і—М –≤—Б–Ї—А—Л—В–Є–µ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –≤–Ј—П—В–Є–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ¬≠–ї–Њ—Б—В–Є.
–Ю–±—А–∞–±–Њ—В–∞–љ–љ—Г—О –Ї–Њ–ґ—Г —А–∞–Ј—А–µ–Ј–∞—О—В –њ–Њ —Б—А–µ–і–љ–µ–є –ї–Є–љ–Є–Є –ґ–Є–≤–Њ¬≠—В–∞ –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М—О –Њ—В —Б–Є–Љ—Д–Є–Ј–∞ –і–Њ –≥—А—Г–і–Є–љ–Њ-–Ї–ї—О—З–Є—З–љ–Њ–≥–Њ —Б–Њ¬≠—З–ї–µ–љ–µ–љ–Є—П. –Э–∞ —Г—А–Њ–≤–љ–µ –њ–µ—А–µ–і–љ–Є—Е –Є –Ј–∞–і–љ–Є—Е –ї–∞–њ –і–µ–ї–∞—О—В –±–Њ–Ї–Њ–≤—Л–µ –љ–∞–і—А–µ–Ј—Л. –Ъ–Њ–ґ–љ—Л–µ –ї–Њ—Б–Ї—Г—В—Л –Њ—В–њ—А–µ–њ–∞—А–Њ–≤—Л–≤–∞—О—В –Њ—В –њ–Њ–і–Ї–Њ–ґ–љ–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є –Є –Њ—В–≤–Њ—А–∞—З–Є–≤–∞—О—В –≤ —Б—В–Њ—А–Њ–љ—Л, –њ—А–Є–Ї–∞–ї—Л–≤–∞—П –±—Г–ї–∞–≤–Ї–∞–Љ–Є –Ї –і–Њ—Б–Ї–µ.
–Т –њ—А–Њ—В–Њ–Ї–Њ–ї–µ –≤—Б–Ї—А—Л—В–Є—П –Њ—В–Љ–µ—З–∞—О—В —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ–і–Ї–Њ–ґ–љ–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є –Є –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –≤ –њ–∞—Е—Г –Є –њ–Њ–і–Љ—Л—И–µ—З–љ—Л—Е –≤–њ–∞–і–Є–љ–∞—Е. –Я–Њ–і–Ї–Њ–ґ–љ–∞—П –Ї–ї–µ—В—З–∞—В–Ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞–Ј–≤–Є—В–∞ —Б–Є–ї—М–љ–Њ, —Б–ї–∞–±–Њ –Є–ї–Є —Г–Љ–µ—А–µ–љ–љ–Њ. –Я–Њ–і–Љ—Л—И–µ—З–љ—Л–µ –Є –њ–∞—Е–Њ–≤—Л–µ —Г–Ј–ї—Л –Њ–±–љ–∞—А—Г¬≠–ґ–Є–≤–∞—О—В—Б—П –ї–µ–≥–Ї–Њ. –Я—А–Є –Њ—Б–Љ–Њ—В—А–µ —Г–Ј–ї–Њ–≤ –Њ–±—А–∞—Й–∞—О—В –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ –Є—Е –≤–µ–ї–Є—З–Є–љ—Г, —Д–Њ—А–Љ—Г –Є —Ж–≤–µ—В. –Ф–ї—П –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ¬≠–і–Њ–≤–∞–љ–Є—П –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є–µ —Г–Ј–ї—Л —А–∞–Ј–і–∞–≤–ї–Є–≤–∞—О—В —Б—В–µ—А–Є–ї—М–љ—Л–Љ –њ–Є–љ¬≠—Ж–µ—В–Њ–Љ –Є –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ –ґ–Є–і–Ї—Г—О –њ–Є—В–∞—В–µ–ї—М–љ—Г—О —Б—А–µ–і—Г –Є–ї–Є –≤—В–Є—А–∞¬≠—О—В –≤ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –њ–ї–Њ—В–љ–Њ–є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є —Б—А–µ–і—Л.
–°–Љ–µ–љ–Є–≤ –Є–ї–Є –њ—А–Њ—Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–µ –і–ї—П –≤—Б–Ї—А—Л¬≠—В–Є—П –Ї–Њ–ґ–љ—Л—Е –њ–Њ–Ї—А–Њ–≤–Њ–≤ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л, –њ—А–Є—Б—В—Г–њ–∞—О—В –Ї –≤—Б–Ї—А—Л—В–Є—О –≥—А—Г–і–љ–Њ–є –Ї–ї–µ—В–Ї–Є. –У—А—Г–і–Є–љ—Г, –Ј–∞—Е–≤–∞—З–µ–љ–љ—Г—О –њ–Є–љ—Ж–µ—В–Њ–Љ, —Б–ї–µ–≥–Ї–∞ –њ—А–Є¬≠–њ–Њ–і–љ–Є–Љ–∞—О—В, –і–µ–ї–∞—О—В –њ–Њ–і –љ–µ–є –љ–µ–±–Њ–ї—М—И–Њ–є –љ–∞–і—А–µ–Ј, –≤–≤–Њ–і—П—В –≤ –љ–µ–≥–Њ –±—А–∞–љ—И—Г –љ–Њ–ґ–љ–Є—Ж –Є –њ–µ—А–µ—А–µ–Ј–∞—О—В —А–µ–±—А–∞ –≤–љ–∞—З–∞–ї–µ —Б –Њ–і–љ–Њ–є, –∞ –Ј–∞¬≠—В–µ–Љ —Б –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л. –Х—Б–ї–Є –≤ –≥—А—Г–і–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –µ—Б—В—М —Н–Ї—Б—Б—Г–і–∞—В, –Є–Ј –љ–µ–≥–Њ –і–µ–ї–∞—О—В –Љ–∞–Ј–Ї–Є –Є –њ–Њ—Б–µ–≤. –Т–љ–Њ–≤—М —Б–Љ–µ–љ–Є–≤ –љ–Њ–ґ–љ–Є—Ж—Л –Є–ї–Є –њ—А–Њ—В–µ—А–µ–≤ –Є—Е –≤–∞—В–Њ–є, —Б–Љ–Њ—З–µ–љ–љ–Њ–є —Б–њ–Є—А—В–Њ–Љ, —А–∞–Ј—А–µ–Ј–∞—О—В –њ–µ—А–Є–Ї–∞—А–і, –Њ–±–љ–∞–ґ–∞—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —Б–µ—А–і—Ж–∞. –Э–∞–Ї–∞–ї–Є–≤–∞—О—В –љ–∞ –њ–ї–∞–Љ–µ–љ–Є –≥–Њ¬≠—А–µ–ї–Ї–Є –±—А–∞–љ—И–Є –њ–Є–љ—Ж–µ—В–∞ –Є–ї–Є —Б–Ї–∞–ї—М–њ–µ–ї—М, –њ—А–Є–ґ–Є–≥–∞—О—В –њ–Њ–≤–µ—А—Е¬≠–љ–Њ—Б—В—М —Б–µ—А–і—Ж–∞, –Ј–∞—В–µ–Љ —Б—В–µ—А–Є–ї—М–љ—Л–Љ –њ–Є–љ—Ж–µ—В–Њ–Љ –Њ—В—В—П–≥–Є–≤–∞—О—В –Ї–≤–µ—А—Е—Г —Г—И–Ї–Њ –њ—А–∞–≤–Њ–≥–Њ –њ—А–µ–і—Б–µ—А–і–Є—П –Є –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —З–µ—А–µ–Ј –њ—А–Є–ґ–ґ–µ–љ–љ–Њ–µ –Љ–µ—Б—В–Њ –≤–≤–Њ–і—П—В –≤ –њ–Њ–ї–Њ—Б—В—М –ґ–µ–ї—Г–і–Њ—З–Ї–∞ –Є–ї–Є –њ—А–µ–і—Б–µ—А–і–Є—П –Ї–∞–њ–Є–ї–ї—П—А –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї–Њ–є –њ–Є–њ–µ—В–Ї–Є. –Ъ—А–Њ–≤—М, –њ–Њ–і–љ—П–≤—И—Г—О—Б—П –њ–Њ –Ї–∞–њ–Є–ї–ї—П—А—Г –њ–Є¬≠–њ–µ—В–Ї–Є, –Ј–∞—Б–µ–≤–∞—О—В –≤ –њ–Є—В–∞—В–µ–ї—М–љ—Г—О —Б—А–µ–і—Г.
–Ф–∞–ї–µ–µ –њ—А–Є—Б—В—Г–њ–∞—О—В –Ї –Њ—Б–Љ–Њ—В—А—Г –Њ—А–≥–∞–љ–Њ–≤, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ –≥—А—Г–і–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, —А–µ–≥–Є—Б—В—А–Є—А—Г—П –≤ –њ—А–Њ—В–Њ–Ї–Њ–ї–µ –Є–Љ–µ—О—Й–Є–µ—Б—П –≤ –љ–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –љ–∞–њ—А–Є–Љ–µ—А –љ–∞–ї–Є—З–Є–µ —Н–Ї—Б—Б—Г–і–∞—В–∞ –≤ –њ–Њ–ї–Њ—Б—В–Є –њ–ї–µ–≤—А—Л, –∞–±—Б—Ж–µ—Б—Б—Л, –≥–Є–њ–µ—А–µ–Љ–Є—О (–±–∞–≥—А–Њ–≤–Њ-–Ї—А–∞—Б–љ–Њ–µ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ) –Є–ї–Є, –љ–∞¬≠–Њ–±–Њ—А–Њ—В, –Є—И–µ–Љ–Є—О (–Љ–∞–ї–Њ–Ї—А–Њ–≤–Є–µ) –≤ –ї–µ–≥–Ї–Є—Е. –Ъ—Г—Б–Њ—З–Ї–Є –ї–µ–≥–Ї–Њ–≥–Њ —Б –≤—Л—П–≤–ї–µ–љ–љ—Л–Љ–Є –≤ –љ–µ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤—Л—А–µ–Ј–∞—О—В –і–ї—П –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ¬≠–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ, —Б–Љ–µ–љ–Є–≤ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л, –њ–µ—А–µ—Е–Њ–і—П—В –Ї –Є—Б—Б–ї–µ–і–Њ–≤–∞¬≠–љ–Є—О –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є. –Я–µ—А–µ–і–љ–Є–є –ї–Є—Б—В–Њ–Ї –±—А—О—И–Є–љ—Л –≤—Б–Ї—А—Л–≤–∞—О—В –љ–Њ–ґ–љ–Є—Ж–∞–Љ–Є. –Я—А–Є –љ–∞–ї–Є—З–Є–Є —Н–Ї—Б—Б—Г–і–∞—В–∞ –≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є –і–µ–ї–∞—О—В –Є–Ј –љ–µ–≥–Њ –Љ–∞–Ј–Њ–Ї –Є –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –њ–Њ—Б–µ–≤ –≤ –њ–Є—В–∞¬≠—В–µ–ї—М–љ—Г—О —Б—А–µ–і—Г. –Ч–∞—В–µ–Љ –Њ—Б–Љ–∞—В—А–Є–≤–∞—О—В –њ–µ—З–µ–љ—М, —Б–µ–ї–µ–Ј–µ–љ–Ї—Г, –њ–Њ—З–Ї–Є, –Њ—В–Љ–µ—З–∞—П —Ж–≤–µ—В, –≤–µ–ї–Є—З–Є–љ—Г –Њ—А–≥–∞–љ–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—П –Є—Е –Ї–Њ–љ—Б–Є—Б—В–µ–љ¬≠—Ж–Є—О (–љ–Њ—А–Љ–∞–ї—М–љ–∞—П, –і—А—П–±–ї–∞—П, —Г–њ–ї–Њ—В–љ–µ–љ–љ–∞—П, —Е—А—Г–њ–Ї–∞—П) –Є –Є–Љ–µ—О¬≠—Й–Є–µ—Б—П –Њ—З–∞–≥–Є –њ–Њ—А–∞–ґ–µ–љ–Є—П, –љ–∞–њ—А–Є–Љ–µ—А –∞–±—Б—Ж–µ—Б—Б—Л.
–Я—А–Є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ –і–µ–ї–∞—О—В –њ–Њ—Б–µ–≤ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –ґ–µ–ї—Г–і–Ї–∞ –Є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –љ–∞–±–Є—А–∞—П –µ–≥–Њ –≤ –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї—Г—О –њ–Є–њ–µ—В–Ї—Г —З–µ—А–µ–Ј –њ—А–Є–ґ¬≠–ґ–µ–љ–љ—Г—О –ґ–µ–ї—Г–і–Њ—З–љ—Г—О –Є –Ї–Є—И–µ—З–љ—Г—О —Б—В–µ–љ–Ї–Є. –Ґ–∞–Ї–Є–Љ –ґ–µ –Њ–±—А–∞–Ј–Њ–Љ –і–ї—П –њ–Њ—Б–µ–≤–∞ –±–µ—А—Г—В —Н–Ї—Б—Б—Г–і–∞—В, —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–µ –∞–±—Б—Ж–µ—Б—Б–Њ–≤, –ґ–µ–ї—З–љ–Њ–≥–Њ –Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П.
–Ш–Ј –њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ (–њ–µ—З–µ–љ—М, –њ–Њ—З–Ї–Є, —Б–µ–ї–µ–Ј–µ–љ–Ї–∞) –≤–Ј—П—В–Є–µ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є –Ј–∞—Б–µ–≤ –µ–≥–Њ –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –Њ–і–љ–Є–Љ –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е —Б–њ–Њ—Б–Њ–±–Њ–≤.
¬Ј –£ —Б—В–µ—А–Є–ї—М–љ–Њ–є –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї–Њ–є –њ–Є–њ–µ—В–Ї–Є –Њ–±–ї–∞–Љ—Л–≤–∞—О—В –Ї–Њ–љ¬≠—З–Є–Ї –Є –њ—А–Њ–≤–Њ–і—П—В –µ–µ —З–µ—А–µ–Ј –њ–ї–∞–Љ—П –≥–Њ—А–µ–ї–Ї–Є. –Ч–∞—В–µ–Љ –Ї–∞–њ–Є–ї–ї—П—А–Њ–Љ –њ–Є–њ–µ—В–Ї–Є –њ—А–Њ–Ї–∞–ї—Л–≤–∞—О—В –њ—А–Є–ґ–ґ–µ–љ–љ—Л–є —Г—З–∞—Б—В–Њ–Ї –Є—Б—Б–ї–µ–і—Г–µ–Љ–Њ–≥–Њ –Њ—А¬≠–≥–∞–љ–∞ –Є –љ–∞—Б–∞—Б—Л–≤–∞—О—В –≤ –љ–µ–µ —В–Ї–∞–љ–µ–≤—Г—О –ґ–Є–і–Ї–Њ—Б—В—М, –Ї–Њ—В–Њ—А—Г—О –Ј–∞—Б–µ¬≠–≤–∞—О—В –≤ –њ–Є—В–∞—В–µ–ї—М–љ—Г—О —Б—А–µ–і—Г. –Я–Є–њ–µ—В–Ї–Є –њ–Њ—Б–ї–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Њ–њ—Г¬≠—Б–Ї–∞—О—В –≤ –±–∞–љ–Ї—Г —Б –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г—О—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ.
¬Ј –Я—А–Є–ґ–ґ–µ–љ–љ—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Њ—А–≥–∞–љ–∞ –љ–∞–і—А–µ–Ј–∞—О—В —Б—В–µ—А–Є–ї—М¬≠–љ—Л–Љ —Б–Ї–∞–ї—М–њ–µ–ї–µ–Љ –Є –Є–Ј –≥–ї—Г–±–Є–љ—Л –љ–∞–і—А–µ–Ј–∞ —Б–Њ—Б–Ї–∞–±–ї–Є–≤–∞—О—В –±–∞–Ї—В–µ¬≠—А–Є–∞–ї—М–љ–Њ–є –њ–µ—В–ї–µ–є –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –Ї–Њ—В–Њ—А–Њ–µ –Ј–∞—В–µ–Љ –≤–љ–Њ—Б—П—В –≤ –њ–Є—В–∞—В–µ–ї—М–љ—Г—О —Б—А–µ–і—Г.
¬Ј –Э–∞ –њ—А–Є–ґ–ґ–µ–љ–љ–Њ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–∞ –і–µ–ї–∞—О—В –љ–∞–і—А–µ–Ј, –Њ—Б—В—А–Њ–Ї–Њ–љ–µ—З–љ—Л–Љ–Є –љ–Њ–ґ–љ–Є—Ж–∞–Љ–Є –Є–Ј –≥–ї—Г–±–Є–љ—Л –µ–≥–Њ –≤—Л—А–µ–Ј–∞—О—В –Љ–∞¬≠–ї–µ–љ—М–Ї–Є–є –Ї—Г—Б–Њ—З–µ–Ї, —А–∞–Ј–і–∞–≤–ї–Є–≤–∞—О—В –Љ–µ–ґ–і—Г –±—А–∞–љ—И–∞–Љ–Є –њ–Є–љ—Ж–µ—В–∞ –Є –Њ–њ—Г—Б–Ї–∞—О—В –≤ –ґ–Є–і–Ї—Г—О –њ–Є—В–∞—В–µ–ї—М–љ—Г—О —Б—А–µ–і—Г –Є–ї–Є —Б—А–µ–Ј–Њ–Љ –Ї—Г¬≠—Б–Њ—З–Ї–∞ –і–µ–ї–∞—О—В –Њ—В–њ–µ—З–∞—В–Ї–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –њ–ї–Њ—В–љ–Њ–є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є —Б—А–µ–і—Л.
–Ш–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–µ –њ—А–Є –≤—Б–Ї—А—Л—В–Є–Є —В—А—Г–њ–∞, –∞ —В–∞–Ї–ґ–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–љ–Њ—Б—П—В –≤ –њ—А–Њ¬≠—В–Њ–Ї–Њ–ї –≤—Б–Ї—А—Л—В–Є—П –Є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —В—А—Г–њ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, —Б–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л–є –њ—А–Є–Љ–µ—А–љ–Њ –њ–Њ —В–∞–Ї–Њ–Љ—Г –Њ–±—А–∞–Ј—Ж—Г:
1. –Т–Є–і –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, –≤–Ј—П—В–Њ–≥–Њ –≤ –Њ–њ—Л—В.
2. –Т—А–µ–Љ—П –Ј–∞—А–∞–ґ–µ–љ–Є—П (–Љ–µ—Б—П—Ж, —З–Є—Б–ї–Њ, —З–∞—Б).
3. –Ь–∞—В–µ—А–Є–∞–ї, –њ—А–Є–Љ–µ–љ–µ–љ–љ—Л–є –і–ї—П –Ј–∞—А–∞–ґ–µ–љ–Є—П (–≤–Ј–≤–µ—Б—М –Љ–Є–Ї—А–Њ¬≠–±–Њ–≤ —Б –њ–ї–Њ—В–љ–Њ–є –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є —Б—А–µ–і—Л, –±—Г–ї—М–Њ–љ–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞, –≤–Ј–≤–µ—Б—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є —В. –і.).
4. –Т—А–µ–Љ—П –≥–Є–±–µ–ї–Є –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ (–Љ–µ—Б—П—Ж, —З–Є—Б–ї–Њ, —З–∞—Б).
5. –Ш–Ј–Љ–µ–љ–µ–љ–Є—П, –Њ–±–љ–∞—А—Г–ґ–µ–љ–љ—Л–µ –њ—А–Є –≤—Б–Ї—А—Л—В–Є–Є –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –≤ –Љ–µ—Б—В–µ –≤–≤–µ–і–µ–љ–Є—П –Ј–∞—А–∞–Ј–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ–і–Ї–Њ–ґ–љ–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є, –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤; –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –љ–∞–є–і–µ–љ–љ—Л–µ –≤–Њ –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–∞—Е.
6. –Т–Є–і –Љ–Є–Ї—А–Њ–±–∞, –≤—Л–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Є–Ј —В—А—Г–њ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –µ–≥–Њ –Њ—Б–љ–Њ–≤–љ—Л–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ, –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–µ, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Є —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞.
–Я–Њ—Б–ї–µ –≤—Б–Ї—А—Л—В–Є—П —В—А—Г–њ—Л –ґ–Є–≤–Њ—В–љ—Л—Е —Б–Ї–ї–∞–і—Л–≤–∞—О—В –≤ –Љ–µ—В–∞–ї–ї–Є—З–µ¬≠—Б–Ї–Є–µ –±–∞—З–Ї–Є —Б –њ–ї–Њ—В–љ–Њ –Ј–∞–Ї—А—Л–≤–∞—О—Й–Є–Љ–Є—Б—П –Ї—А—Л—И–Ї–∞–Љ–Є –Є –Ј–∞—Б—Л–њ–∞¬≠—О—В —Б—Г—Е–Њ–є —Е–ї–Њ—А–љ–Њ–є –Є–Ј–≤–µ—Б—В—М—О. –Ґ—А—Г–њ—Л –Љ–µ–ї–Ї–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Љ–Њ–ґ–љ–Њ –Ј–∞–ї–Є–≤–∞—В—М —А–∞—Б—В–≤–Њ—А–Њ–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –і–µ–Ј–Є–љ—Д–Є—Ж–Є—А—Г¬≠—О—Й–Є—Е –≤–µ—Й–µ—Б—В–≤: 5% —А–∞—Б—В–≤–Њ—А–Њ–Љ –Ї–∞—А–±–Њ–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, 3вАФ5% –Љ—Л–ї—М–љ–Њ-–Ї–∞—А–±–Њ–ї–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ, 3вАФ5% —А–∞—Б—В–≤–Њ—А–Њ–Љ —Е–ї–Њ—А–∞–Љ–Є–љ–∞. –Ґ—А—Г–њ—Л –ґ–Є–≤–Њ—В–љ—Л—Е, –њ–Њ–≥–Є–±—И–Є—Е –Њ—В –Ј–∞—А–∞–ґ–µ–љ–Є—П —Б–њ–Њ—А–Њ–≤—Л–Љ–Є —Д–Њ—А–Љ–∞¬≠–Љ–Є –Љ–Є–Ї—А–Њ–±–Њ–≤, –Ј–∞–ї–Є–≤–∞—О—В —Е–ї–Њ—А–љ–Њ-–Є–Ј–≤–µ—Б—В–Ї–Њ–≤—Л–Љ –Љ–Њ–ї–Њ–Ї–Њ–Љ –Є–ї–Є 5вАФ10% –Њ—Б–≤–µ—В–ї–µ–љ–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ —Е–ї–Њ—А–љ–Њ–є –Є–Ј–≤–µ—Б—В–Є. –Т –і–µ–Ј–Є–љ—Д–Є—Ж–Є¬≠—А—Г—О—Й–µ–Љ –≤–µ—Й–µ—Б—В–≤–µ —В—А—Г–њ—Л –ґ–Є–≤–Њ—В–љ—Л—Е —Е—А–∞–љ—П—В –і–Њ –Љ–Њ–Љ–µ–љ—В–∞ –Є—Е —Б–ґ–Є–≥–∞–љ–Є—П.
|
|
| |
 |


















