–¦–ê–ë–û–†–ê–Δ–û–†–ù–û–ï –½–ê–ù–·–Δ–‰–ï ⳕ 8
–Γ–Δ–ï–†–ï–û–Δ–ê–ö–Γ–‰–ß–ï–Γ–ö–‰–ô –€–ï–Δ–û–î –‰–Γ–Γ–¦–ï–î–û–£–ê–ù–‰–· –™–û–¦–û–£–ù–û–™–û –€–û–½–™–ê
–†–ê–ë–û–Δ–ê 1. –£–Ε–Η–≤–Μ–Β–Ϋ–Η–Β ―ç–Μ–Β–Κ―²―Ä–Ψ–¥–Ψ–≤ –Η –Κ–Α–Ϋ―é–Μ―¨ –≤ ―¹―²―Ä―É–Κ―²―É―Ä―΄ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–û―¹–≤–Ψ–Η―²―¨ –Φ–Β―²–Ψ–¥–Η–Κ―É –≤–Ε–Η–≤–Μ–Β–Ϋ–Η–Β ―ç–Μ–Β–Κ―²―Ä–Ψ–¥–Ψ–≤ –Η –Κ–Α–Ϋ―é–Μ―¨ –≤ –≥–Μ―É–±–Ψ–Κ–Η–Β ―¹―²―Ä―É–Κ―²―É―Ä―΄ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–½–Α―³–Η–Κ―¹–Η―Ä―É–Ι―²–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –≤ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―¹–Β –Κ–Α–Κ –Ψ–Ω–Η―¹–Α–Ϋ–Ψ –≤ ―Ä–Α–±–Ψ―²– ⳕ 3 –Ζ–Α–Ϋ―è―²–Η―è ⳕ7.
–Θ –Ζ–Α―³–Η–Κ―¹–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –≤ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―¹–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, –≤ –Ψ–±–Μ–Α―¹―²–Η –Ω―Ä–Β–¥–Ω–Ψ–Μ–Α–≥–Α–Β–Φ–Ψ–≥–Ψ ―Ä–Α–Ζ―Ä–Β–Ζ–Α –Κ–Ψ–Ε–Η –Ϋ–Α –≥–Ψ–Μ–Ψ–≤–Β, ―É–¥–Α–Μ–Η―²―¨ ―à–Β―Ä―¹―²―¨ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ϋ–Ψ–Ε–Ϋ–Η―Ü –Η ―¹–Κ–Α–Μ―¨–Ω–Β–Μ–Β–Φ ―¹–¥–Β–Μ–Α―²―¨ –Ω―Ä–Ψ–¥–Ψ–Μ―¨–Ϋ―΄–Ι ―Ä–Α–Ζ―Ä–Β–Ζ –Κ–Ψ–Ε–Η –¥–Μ–Η–Ϋ–Ψ–Ι
2-2,5 ―¹–Φ –Ω–Ψ ―¹―Ä–Β–¥–Ϋ–Β–Ι –Μ–Η–Ϋ–Η–Η –≥–Ψ–Μ–Ψ–≤―΄ –≤ ―Ä–Ψ―¹―²―Ä–Ψ-–Κ–Α―É–¥–Α–Μ―΄―é–Φ –Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Η–Η.
–Γ –Ω–Ψ–Φ–Ψ―â―¨―é ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η―Ö –Ω–Η–Ϋ―Ü–Β―²–Ψ–≤ –Η–Μ–Η –Ζ–Α–Ε–Η–Φ–Ψ–≤ ―Ä–Α–Ζ–¥–≤–Η–Ϋ―É―²―¨ –Κ–Ψ–Ε–Ϋ―΄–Β –Μ–Ψ―¹–Κ―É―²―΄ –Η –Ψ―¹–≤–Ψ–±–Ψ–¥–Η―²―¨ ―¹–Κ–Α–Μ―¨–Ω–Β–Μ–Β–Φ –Κ–Ψ―¹―²―¨ –Ψ―² –Ϋ–Α–¥–Κ–Ψ―¹―²–Ϋ–Η―Ü―΄ –Η –Ω―Ä–Ψ―²–Β―Ä–Β―²―¨ –Β―ë ―²–Α–Φ–Ω–Ψ–Ϋ–Ψ–Φ, ―¹–Φ–Ψ―΅–Β–Ϋ–Ϋ―΄–Φ –Ω–Β―Ä–Β–Κ–Η―¹―¨―é –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α –¥–Μ―è –Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Η –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ–≥–Ψ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è.
–ö–Ψ―¹―²–Η ―΅–Β―Ä–Β–Ω–Α –Ω―Ä–Ψ―²–Β―Ä–Β―²―¨ ―¹–Ω–Η―Ä―²–Ψ–Φ –Η–Μ–Η ―ç―³–Η―Ä–Ψ–Φ –¥–Μ―è –Ω–Ψ–¥―¹―É―à–Η–≤–Α–Ϋ–Η―è. –ü―Ä–Η ―ç―²–Ψ–Φ ―΅–Β―²–Κ–Ψ –Ω―Ä–Ψ―¹―²―É–Ω–Α―é―² ―à–≤―΄, –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ―΄–Β –¥–Μ―è –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η―è –Κ–Ψ–Ψ―Ä–¥–Η–Ϋ–Α―², –Ω–Ψ –Κ–Ψ―²–Ψ―Ä―΄–Φ –±―É–¥–Β―² –≤–≤–Β–¥–Β–Ϋ ―ç–Μ–Β–Κ―²―Ä–Ψ–¥ –Η–Μ–Η –Κ–Α–Ϋ―é–Μ―è.
–ù–Α–Ι–¥–Η―²–Β –Ψ―Ä–Η–Β–Ϋ―²–Η―Ä–Ψ–≤–Ψ―΅–Ϋ―΄–Β ―²–Ψ―΅–Κ–Η: –±―Ä–Β–≥–Φ―É (–Ω–Β―Ä–Β―¹–Β―΅–Β–Ϋ–Η–Β ―¹–Α–≥–Η―²―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ–Ψ–≥–Ψ ―à–≤–Ψ–≤) –Η –Μ–Α–Φ–±–¥―É (–Ω–Β―Ä–Β―¹–Β―΅–Β–Ϋ–Η–Β ―¹–Α–≥–Η―²―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η –Ζ–Α―²―΄–Μ–Ψ―΅–Ϋ–Ψ–≥–Ψ ―à–≤–Ψ–≤) ( ―¹–Φ. ―Ä–Η―¹. 15)
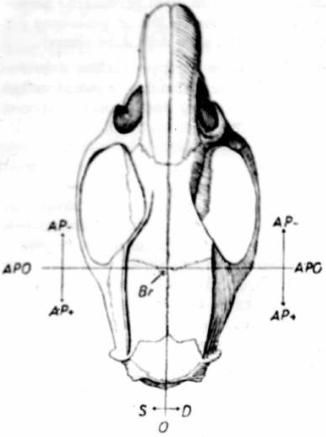
| –†–Η―¹. 15. –£–Η–¥ –Κ–Ψ―¹―²–Β–Ι ―΅–Β―Ä–Β–Ω–Α –Κ―Ä―΄―¹―΄. –î–Ψ―Ä―¹–Α–Μ―¨–Ϋ–Α―è –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²―¨.
–£–≥ - –±―Ä–Β–≥–Φ–Α: –ê–†–û - –Ϋ―É–Μ–Β–≤–Α―è –Ψ―²–Φ–Β―²–Κ–Α ―³―Ä–Ψ–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–Ι –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Η
|
–£―¹―²–Α–≤―¨―²–Β –≤ –¥–Β―Ä–Ε–Α―²–Β–Μ―¨ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―¹–Α –Η–≥–Μ―É ―¹ –Ζ–Α―²―É–Ω–Μ–Β–Ϋ–Ϋ―΄–Φ –Κ–Ψ–Ϋ―Ü–Ψ–Φ –Η –Ω–Β―Ä–Β–Φ–Β―â–Α―è –Β―ë, ―É―¹―²–Α–Ϋ–Ψ–≤–Η―²–Β ―²–Α–Κ, ―΅―²–Ψ–±―΄ –Β―ë –Κ–Ψ–Ϋ–Β―Ü –Κ–Α―¹–Α–Μ―¹―è –Μ–Α–Φ–±–¥―΄. –û–Ω―Ä–Β–¥–Β–Μ–Η―²–Β –Ω–Ψ ―à–Κ–Α–Μ–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤–Ψ–¥–Η―²–Β–Μ―è –Κ–Ψ–Ψ―Ä–¥–Η–Ϋ–Α―²―΄ –Μ―è–Φ–±–¥―΄. –û―²–≤–Β–¥–Η―²–Β –Κ–Ψ–Ϋ–Β―Ü –Η–≥–Μ―΄ –≤ ―²–Ψ―΅–Κ―É –±―Ä–Β–≥–Φ–Α –Η –Ϋ–Α–Κ–Μ–Ψ–Ϋ–Η―²–Β –≥–Ψ–Μ–Ψ–≤―É –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ ―²–Α–Κ, ―΅―²–Ψ–±―΄ –Ψ–Ϋ–Α –Ψ–Κ–Α–Ζ–Α–Μ–Α―¹―¨ –Ϋ–Α 1 –Φ–Φ –≤―΄―à–Β –Μ–Α–Φ–±–¥―΄. –ü–Ψ ―à–Κ–Α–Μ–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤–Ψ–¥–Η―²–Β–Μ―è –Ψ–Ω―Ä–Β–¥–Β–Μ–Η―²–Β –Ϋ―É–Μ–Β–≤―΄–Β –Κ–Ψ–Ψ―Ä–¥–Η–Ϋ–Α―²―΄ –±―Ä–Β–≥–Φ―΄ (―Ä–Η―¹. 16).
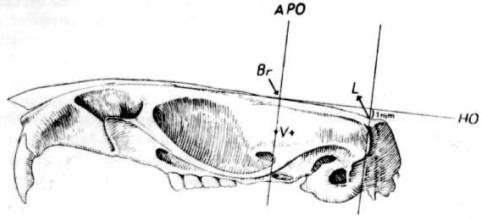
| –†–Η―¹.16. –ö–Ψ―¹―²–Η ―΅–Β―Ä–Β–Ω–Α –Κ―Ä―΄―¹―΄. –¦–Α―²–Β―Ä–Α–Μ―¨–Ϋ–Α―è –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²―¨.
–£–≥ βÄî –±―Ä–Β–≥–Φ–Α;
L βÄî –Μ–Α–Φ–±–¥–Α;
–ù–û - –Ϋ―É–Μ–Β–≤–Ψ–Ι –≥–Ψ―Ä–Η–Ζ–Ψ–Ϋ―²–Α–Μ―¨–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨;
–ê–†–û - –Ϋ―É–Μ–Β–≤–Ψ–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ ―³―Ä–Ψ–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–Ι –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Η –Φ–Ψ–Ζ–≥–Α.
|
–ö –Ϋ―É–Μ–Β–≤―΄–Φ –Ψ―²―¹―΅–Β―²–Α–Φ (―¹–Φ. –Ω.5), –Ω―Ä–Η–±–Α–≤―¨―²–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Κ–Ψ–Ψ―Ä–¥–Η–Ϋ–Α―², –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄―Ö –Ω–Ψ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―΅–Β―¹–Κ–Ψ–Φ―É –Α―²–Μ–Α―¹―É –¥–Μ―è –Η―¹―¹–Μ–Β–¥―É–Β–Φ–Ψ–Ι ―¹―²―Ä―É–Κ―²―É―Ä―΄ –Φ–Ψ–Ζ–≥–Α (–Ζ–Α–Ϋ―è―²–ǖ ⳕ7, ―Ä–Α–±–Ψ―²–Α 1).
–ù–Α–Ι–¥–Β–Ϋ–Ϋ―É―é ―²–Ψ―΅–Κ―É –Ϋ–Α ―΅–Β―Ä–Β–Ω–Β, –Ω―Ä–Ψ–Φ–Α―Ä–Κ–Η―Ä―É–Ι―²–Β –Η ―¹–¥–Β–Μ–Α–Ι―²–Β –±–Ψ―Ä–Φ–Α―à–Η–Ϋ–Ψ–Ι ―²―Ä–Β–Ω–Α–Ϋ–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Β –Ψ―²–≤–Β―Ä―¹―²–Η–Β. –Γ–≤–Β―Ä–Μ–Η―²–Β –Ψ―²–≤–Β―Ä―¹―²–Η–Β –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ, ―΅―²–Ψ–±―΄ –Ϋ–Β "–Ω―Ä–Ψ–≤–Α–Μ–Η―²―¨―¹―è" –Η –Ϋ–Β –Ω–Ψ–≤―Ä–Β–¥–Η―²―¨ ―²–Κ–Α–Ϋ―¨ –Φ–Ψ–Ζ–≥–Α. –ü–Ψ–Φ–Ϋ–Η―²–Β, ―΅―²–Ψ –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―¹–≤–Β―Ä–Μ–Β–Ϋ–Η–Β ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α–Β―²―¹―è –Ϋ–Α–≥―Ä–Β–≤–Α–Ϋ–Η–Β –Κ–Ψ―¹―²–Η, ―΅―²–Ψ –Ϋ–Β–Ε–Β–Μ–Α―²–Β–Μ―¨–Ϋ–Ψ. –ü–Β―Ä–Β–¥ –≤–≤–Β–¥–Β–Ϋ–Η–Β–Φ ―ç–Μ–Β–Κ―²―Ä–Ψ–¥–Α –Κ–Ψ―¹―²―¨ –Β―â―ë ―Ä–Α–Ζ –Ω–Ψ–¥―¹―É―à–Η―²–Β ―ç―³–Η―Ä–Ψ–Φ –Η–Μ–Η –Ω–Β―Ä–Β–Κ–Η―¹―¨―é –≤–Ψ–¥–Ψ―Ä–Ψ–¥–Α.
–≠–Μ–Β–Κ―²―Ä–Ψ–¥ (–Κ–Α–Ϋ―é–Μ―é) –Ζ–Α–Κ―Ä–Β–Ω–Η―²–Β –≤ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤–Ψ–¥–Η―²–Β–Μ–Β ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―¹–Α, –Ω–Ψ–¥–≤–Β–¥–Η―²–Β –Β–≥–Ψ –Κ ―²―Ä–Β–Ω–Α–Ϋ–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Φ―É –Ψ―²–≤–Β―Ä―¹―²–Η―é –Η –≤–≤–Β–¥–Η―²–Β –Ϋ–Α ―²―Ä–Β–±―É–Β–Φ―É―é –≥–Μ―É–±–Η–Ϋ―É (–Κ–Ψ–Ψ―Ä–¥–Η–Ϋ–Α―²–Α –ù).
–£–Ζ―è―²―¨ –Η–Ϋ–≥―Ä–Α–¥–Η–Β–Ϋ―²―΄ ―³–Ψ―¹―³–Α―²―Ü–Β–Φ–Β–Ϋ―²–Α (–Ω–Ψ―Ä–Ψ―à–Ψ–Κ –Η –Ε–Η–¥–Κ–Ψ―¹―²―¨) –Η ―¹–Φ–Β―à–Α―²―¨ –Η―Ö –≤ –Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Η 7:1 –¥–Ψ –Ω–Ψ–Μ―É―΅–Β–Ϋ–Η―è –Κ–Ψ–Ϋ―¹–Η―¹―²–Β–Ϋ―Ü–Η–Η –≥―É―¹―²–Ψ–Ι ―¹–Φ–Β―²–Α–Ϋ―΄.
–Γ –Ω–Ψ–Φ–Ψ―â―¨―é ―à–Ω–Α―²–Β–Μ―è –Ϋ–Α–Ϋ–Β―¹―²–Η –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―É―é ―¹–Φ–Β―¹―¨ –Ϋ–Α –≤―΄―¹―É―à–Β–Ϋ–Ϋ―΄–Β –Κ–Ψ―¹―²–Η ―΅–Β―Ä–Β–Ω–Α ¬Ϊ–Ζ–Α–Μ–Η–≤–Α―è¬Μ –≤–Ε–Η–≤–Μ–Β–Ϋ–Ϋ―΄–Ι ―ç–Μ–Β–Κ―²―Ä–Ψ–¥ (–Κ–Α–Ϋ―é–Μ―é).
–ß–Β―Ä–Β–Ζ 5-10 –Φ–Η–Ϋ―É―², –Ω–Ψ―¹–Μ–Β ―²–Ψ–≥–Ψ, –Κ–Α–Κ –Ω–Μ–Ψ–Φ–±–Α –Ζ–Α―¹―²―΄–Ϋ–Β―², –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤–Ψ–¥–Η―²–Β–Μ―¨ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―¹–Α –Ψ―²–≤–Β―¹―²–Η –≤ ―¹―²–Ψ―Ä–Ψ–Ϋ―É, –Ζ–Α–Κ―Ä―΄―²―¨ –Ψ―²–≤–Β―Ä―¹―²–Η–Β –Κ–Α–Ϋ―é–Μ–Η (–Β―¹–Μ–Η –Ψ–Ϋ–Α –Ω–Μ–Α―¹―²–Η–Κ–Ψ–≤–Α―è - –Ζ–Α–Ω–Α–Η–≤–Α―é―² –Β―ë –Ω–Α―è–Μ―¨–Ϋ–Η–Κ–Ψ–Φ, –Η–Μ–Η –Ζ–Α–Κ―Ä―΄–≤–Α―é―² –Ω–Α―Ä–Α―³–Η–Ϋ–Ψ–Φ, –Η–Μ–Η –Κ–Μ–Β–Ι–Κ–Ψ–Ι –Μ–Β–Ϋ―²–Ψ–Ι) –Η –Η–Ζ–≤–Μ–Β―΅―¨ –Κ―Ä―΄―¹―É –Η–Ζ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―¹–Α.
–†–ê–ë–û–Δ–ê 2. –€–Η–Κ―Ä–Ψ–Η–Ϋ―ä–Β–Κ―Ü–Η–Η –≤ ―¹―²―Ä―É–Κ―²―É―Ä―΄ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–û―¹–≤–Ψ–Η―²―¨ –Φ–Β―²–Ψ–¥–Η–Κ―É –Φ–Η–Κ―Ä–Ψ–Η–Ϋ―ä–Β–Κ―Ü–Η–Ι –≤ –±–Ψ–Κ–Ψ–≤―΄–Β –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Η –Φ–Ψ–Ζ–≥–Α.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–£–Ζ―è―²―¨ –Κ―Ä―΄―¹―É –Η –Ζ–Α―³–Η–Κ―¹–Η―Ä–Ψ–≤–Α―²―¨ –Β―ë –≤ –Η–Φ–Φ–Ψ–±–Η–Μ–Η–Ζ–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄–Ι ―¹―²–Α–Ϋ–Ψ–Κ, –Κ–Α–Κ ―É–Κ–Α–Ζ–Α–Ϋ–Ψ –≤ ―Ä–Α–±–Ψ―²– ⳕ –Ζ–Α–Ϋ―è―²–Η―è ⳕ
–û―²–Κ―Ä―΄―²―¨ –Ψ―²–≤–Β―Ä―¹―²–Η–Β –Κ–Α–Ϋ―é–Μ–Η –¥–Μ―è –Η–Ϋ―ä–Β–Κ―Ü–Η–Η (―É–¥–Α–Μ–Η–≤ –Κ–Μ–Β–Ι–Κ―É―é –Μ–Β–Ϋ―²―É –Η–Μ–Η –Ω–Α―Ä–Α―³–Η–Ϋ ―¹ –Ψ―²–≤–Β―Ä―¹―²–Η―è, –Η–Μ–Η –Ψ–±―Ä–Β–Ζ–Α―²―¨ –≤–Β―Ä―Ö–Ϋ―é―é ―΅–Α―¹―²―¨ –Κ–Α–Ϋ―é–Μ–Η).
–‰–≥–Μ―É –Ω–Β―Ä–Β―Ö–Ψ–¥–Ϋ–Η–Κ–Α –Φ–Η–Κ―Ä–Ψ–¥–Ψ–Ζ–Α―²–Ψ―Ä–Α –≤–≤–Β―¹―²–Η –≤ –Ψ―²–≤–Β―Ä―¹―²–Η–Β –Κ–Α–Ϋ―é–Μ–Η –Η –Ψ―¹―É―â–Β―¹―²–≤–Η―²–Β –≤–≤–Β–¥–Β–Ϋ–Η–Β ―Ä–Α―¹―²–≤–Ψ―Ä–Α: –Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 1 –Φ–Η–Ϋ―É―²―΄ –Ϋ–Β –±–Ψ–Μ–Β–Β 10 –Φ–Κ–Μ.
–‰–Ζ–≤–Μ–Β–Κ–Η―²–Β –Η–≥–Μ―É –Η–Ζ –Κ–Α–Ϋ―é–Μ–Η –Η –Ζ–Α–Κ―Ä–Ψ–Ι―²–Β –Β―ë –Ψ―²–≤–Β―Ä―¹―²–Η–Β.
–†–ê–ë–û–Δ–ê 3. –ö–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ ―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –≤–Ε–Η–≤–Μ–Β–Ϋ–Η―è –Κ–Α–Ϋ―é–Μ―¨ –≤ ―¹―²―Ä―É–Κ―²―É―Ä―΄ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Φ–Α―Ä–Κ–Η―Ä–Ψ–≤–Ψ―΅–Ϋ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–€–Ψ―Ä―³–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Ι –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ ―²–Ψ―΅–Ϋ–Ψ―¹―²–Η –≤–Ε–Η–≤–Μ–Β–Ϋ–Η―è –Κ–Α–Ϋ―é–Μ―¨ –≤ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Η –Φ–Ψ–Ζ–≥–Α ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Φ–Α―Ä–Κ–Η―Ä–Ψ–≤–Ψ―΅–Ϋ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–£–≤–Β–¥–Η―²–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É ―΅–Β―Ä–Β–Ζ –Η–Φ–Β―é―â–Η–Β―¹―è –Κ–Α–Ϋ―é–Μ–Η –Ϋ–Β–±–Ψ–Μ―¨―à–Ψ–Β –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ ―΅–Β―Ä–Ϋ–Ψ–Ι ―²―É―à–Η, –Κ–Α–Κ ―É–Κ–Α–Ζ–Α–Ϋ–Ψ –≤ –Ω―Ä–Β–¥―΄–¥―É―â–Β–Ι ―Ä–Α–±–Ψ―²–Β.
–ü―Ä–Ψ–Η–Ζ–≤–Β–¥–Η―²–Β ―ç–≤―²–Α–Ϋ–Α–Ζ–Η―é ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Ω―É―²–Β–Φ –¥–Β–Κ–Α–Ω–Η―²–Α―Ü–Η–Η.
–£ –Ζ–Α―²―΄–Μ–Ψ―΅–Ϋ–Ψ–Ι –Ψ–±–Μ–Α―¹―²–Η ―΅–Β―Ä–Β–Ω–Α, –Ψ―¹–≤–Ψ–±–Ψ–¥–Η–≤ –Ω―Ä–Β–¥–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ –Κ–Ψ―¹―²–Η –Ψ―² –Ω–Ψ–Κ―Ä–Ψ–≤–Ϋ―΄―Ö –Η –Φ―΄―à–Β―΅–Ϋ―΄―Ö ―²–Κ–Α–Ϋ–Β–Ι, –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ ―Ä–Α–Ζ–Μ–Ψ–Φ–Η―²–Β ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ω–Η–Ϋ―Ü–Β―²–Α –Η–Μ–Η –Ζ–Α–Ε–Η–Φ–Ψ–≤ ―΅–Β―Ä–Β–Ω–Ϋ―΄–Β –Κ–Ψ―¹―²–Η.
–û―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ –Η–Ζ–≤–Μ–Β–Κ–Η―²–Β –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–Ι –Φ–Ψ–Ζ–≥ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, –Ψ―²―¹–Β–Κ–Α―è –Ψ―² –Β–≥–Ψ –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Η―è ―¹–Ψ―¹―É–¥―΄, –Ϋ–Β―Ä–≤―΄ –Η –Ψ–±–Ψ–Μ–Ψ―΅–Κ–Η.
–ü–Ψ–Φ–Β―¹―²–Η―²–Β –Φ–Ψ–Ζ–≥ –≤ ―΅–Α―à–Κ―É –ü–Β―²―Ä–Η ―¹ –≤–Ψ–¥–Ψ–Ι.
–Γ –Ω–Ψ–Φ–Ψ―â―¨―é –±―Ä–Η―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Μ–Β–Ζ–≤–Η―è –Ω―Ä–Ψ–Η–Ζ–≤–Β–¥–Η―²–Β ―Ä–Α–Ζ―Ä–Β–Ζ –Φ–Ψ–Ζ–≥–Ψ–≤–Ψ–Ι ―²–Κ–Α–Ϋ–Η –≤ –Ψ–±–Μ–Α―¹―²–Η –≤–Ε–Η–≤–Μ–Β–Ϋ–Ϋ–Ψ–Ι –Κ–Α–Ϋ―é–Μ–Η. –£ ―¹–Μ―É―΅–Α–Β –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Η―è –Κ–Α–Ϋ―é–Μ–Η –£―΄ ―É–≤–Η–¥–Η―²–Β –Η–Ϋ–¥–Η–Κ–Α―²–Ψ―Ä–Ϋ–Ψ–Β –≤–Β―â–Β―¹―²–≤–Ψ –≤ –Ψ–±–Ψ–Η―Ö –±–Ψ–Κ–Ψ–≤―΄―Ö –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α―Ö –Φ–Ψ–Ζ–≥–Α.
–¦–ê–ë–û–†–ê–Δ–û–†–ù–û–ï –½–ê–ù–·–Δ–‰–ï ⳕ9
–€–ï–Δ–û–î–Ϊ –ù–ï–£–†–û–¦–û–™–‰–ß–ï–Γ–ö–û–™–û –‰–Γ–Γ–¦–ï–î–û–£–ê–ù–‰–·
–†–ê–½–¦–‰–ß–ù–Ϊ–Ξ –û–Δ–î–ï–¦–û–£ –Π–ù–Γ
–†–ê–ë–û–Δ–ê 1. –û―Ü–Β–Ϋ–Κ–Α ―³―É–Ϋ–Κ―Ü–Η–Η ―¹–Ω–Η–Ϋ–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–û―¹–≤–Ψ–Η―²―¨ –Ϋ–Β–≤―Ä–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β ―²–Β―¹―²―΄, ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É―é―â–Η–Β ―Ä–Β―³–Μ–Β–Κ―²–Ψ―Ä–Ϋ―É―é –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨ ―¹–Ω–Η–Ϋ–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–†–Β―³–Μ–Β–Κ―¹ ―¹–≥–Η–±–Α–Ϋ–Η―è –Μ–Α–Ω―΄.
–ë–Β―Ä–Β–Ε–Ϋ–Ψ –Ω–Ψ–¥–Ϋ–Η–Φ–Η―²–Β –Κ―Ä―΄―¹―É –Ζ–Α –Κ–Ψ–Ε―É ―¹–Ω–Η–Ϋ―΄.
–£–Ψ–Ζ―¨–Φ–Η―²–Β –Ω–Η–Ϋ―Ü–Β―² –Η ―É―â–Β–Φ–Η―²–Β –Ω–Α–Μ―¨―Ü―΄ –Ζ–Α–¥–Ϋ–Β–Ι –Μ–Α–Ω―΄.
–û―²–Φ–Β―²―¨―²–Β ―Ä–Β–Α–Κ―Ü–Η―é –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ.
–Θ–Κ–Ψ–Μ–Η―²–Β ―¹―²―É–Ω–Ϋ―é –Η–≥–Μ–Ψ–Ι –Η –Ψ―²–Φ–Β―²―¨―²–Β ―Ä–Β–Α–Κ―Ü–Η―é.
–ù–Α–≥―Ä–Β–Ι―²–Β –Φ–Β―²–Α–Μ–Μ–Η―΅–Β―¹–Κ–Η–Ι –Ω―Ä―É―² –≤ –≤–Ψ–¥―è–Ϋ–Ψ–Ι –±–Α–Ϋ–Β –Ω―Ä–Η ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Β +60 ¬Α–Γ.
–ü―Ä–Η–Κ–Ψ―¹–Ϋ–Η―²–Β―¹―¨ –Η–Φ –Κ –Ω–Ψ–¥―É―à–Β―΅–Κ–Α–Φ –Ω–Α–Μ―¨―Ü–Β–≤ –Ζ–Α–¥–Ϋ–Β–Ι –Μ–Α–Ω―΄ –Κ―Ä―΄―¹―΄.
–û―²–Φ–Β―²―¨―²–Β ―Ä–Β–Α–Κ―Ü–Η―é.
–½–Α–Ω–Η―à–Η―²–Β –¥–Α–Ϋ–Ϋ―΄–Β –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ –Ψ–Ω―΄―²–Ψ–≤ –Η ―¹–¥–Β–Μ–Α–Ι―²–Β –≤―΄–≤–Ψ–¥.
–ü―Ä–Η–Φ–Β―΅–Α–Ϋ–Η–Β. –Θ –Ζ–¥–Ψ―Ä–Ψ–≤–Ψ–≥–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Ω―Ä–Η –¥–Β–Ι―¹―²–≤–Η–Η ―ç―²–Η―Ö ―Ä–Α–Ζ–¥―Ä–Α–Ε–Η―²–Β–Μ–Β–Ι –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è ―¹–≥–Η–±–Α–Ϋ–Η–Β –Μ–Α–Ω―΄ –Η, –Ϋ–Β–Κ–Ψ―²–Ψ―Ä–Ψ–Β –≤―Ä–Β–Φ―è, ―¹–Ψ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η–Β ―¹–≥–Η–±–Α–Ϋ–Η―è –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Η. –û–±―Ä–Α―²–Η―²–Β –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β –Ϋ–Α –Ω―Ä–Ψ–Ω–Ψ―Ä―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ―¹―²―¨ –Φ–Β–Ε–¥―É –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ―¹―²―¨―é ―¹―²–Η–Φ―É–Μ–Α –Η –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ―¹―²―¨―é –Ψ―²–≤–Β―²–Ϋ–Ψ–Ι ―Ä–Β–Α–Κ―Ü–Η–Η.
–†–Β―³–Μ–Β–Κ―¹ –Ψ―²–¥–Β―Ä–≥–Η–≤–Α–Ϋ–Η―è ―Ö–≤–Ψ―¹―²–Α.
–ü–Ψ–Φ–Β―¹―²–Η―²–Β –Κ―Ä―΄―¹―É –≤ –Η–Ϋ–¥–Η–≤–Η–¥―É–Α–Μ―¨–Ϋ―É―é –Κ–Μ–Β―²–Κ―É ―²–Α–Κ, ―΅―²–Ψ–±―΄ ―Ö–≤–Ψ―¹―² ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ –Μ–Β–Ε–Α–Μ –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Η ―¹―²–Ψ–Μ–Α.
–Γ –Ω–Ψ–Φ–Ψ―â―¨―é –Μ―É–Ω―΄ ―¹―³–Ψ–Κ―É―¹–Η―Ä―É–Ι―²–Β ―¹–Ψ–Μ–Ϋ–Β―΅–Ϋ―΄–Β –Μ―É―΅–Η –Ϋ–Α –Κ–Ψ–Ε–Β ―¹―Ä–Β–¥–Ϋ–Β–Ι ―²―Ä–Β―²–Η ―Ö–≤–Ψ―¹―²–Α.
–û―²–Φ–Β―²―¨―²–Β –≤―Ä–Β–Φ―è –Ϋ–Α―΅–Α–Μ–Α –¥–Β–Ι―¹―²–≤–Η―è –¥–Ψ –Ψ―²–≤–Β―²–Ϋ–Ψ–Ι ―Ä–Β–Α–Κ―Ü–Η–Η –≤ –≤–Η–¥–Β ―¹–≥–Η–±–Α–Ϋ–Η―è ―Ö–≤–Ψ―¹―²–Α.
–½–Α–Ω–Η―à–Η―²–Β –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Η ―¹–¥–Β–Μ–Α–Ι―²–Β –≤―΄–≤–Ψ–¥.
–ü―Ä–Η–Φ–Β―΅–Α–Ϋ–Η–Β. –ü―Ä–Η –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ―΄―Ö –Ω–Α―Ä–Α–Φ–Β―²―Ä–Α―Ö ―¹―²–Η–Φ―É–Μ–Α –Μ–Α―²–Β–Ϋ―²–Ϋ―΄–Ι –Ω–Β―Ä–Η–Ψ–¥ ―Ä–Β–Α–Κ―Ü–Η–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β―²―¹―è –¥–Μ―è –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η―è –±–Ψ–Μ–Β–≤–Ψ–≥–Ψ –Ω–Ψ―Ä–Ψ–≥–Α.
–†–ê–ë–û–Δ–ê 2. –û―Ü–Β–Ϋ–Κ–Α –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Ω―Ä–Ψ–¥–Ψ–Μ–≥–Ψ–≤–Α―²–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–û–≤–Μ–Α–¥–Β―²―¨ –Φ–Β―²–Ψ–¥–Α–Φ–Η –Ψ―Ü–Β–Ϋ–Κ–Η ―Ä–Β―³–Μ–Β–Κ―²–Ψ―Ä–Ϋ–Ψ–Ι –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η
–Ω―Ä–Ψ–¥–Ψ–Μ–≥–Ψ–≤–Α―²–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–†–Β–Α–Κ―Ü–Η―è –≤–Ζ–¥―Ä–Α–≥–Η–≤–Α–Ϋ–Η―è.
–ü–Ψ–Φ–Β―¹―²–Η―²–Β –Κ―Ä―΄―¹―É –Ϋ–Α –Ω–Μ–Ψ―â–Α–¥–Κ―É –¥–Μ―è –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –Η –Ω–Ψ–¥–Ψ–Ε–¥–Η―²–Β, –Ω–Ψ–Κ–Α –Ψ–Ϋ–Α –Ϋ–Β –Ω–Β―Ä–Β―¹―²–Α–Ϋ–Β―² –¥–≤–Η–≥–Α―²―¨―¹―è.
–ü–Ψ–¥–Α–Ι―²–Β ―¹–Η–Μ―¨–Ϋ―΄–Ι –Ζ–≤―É–Κ–Ψ–≤–Ψ–Ι ―Ä–Α–Ζ–¥―Ä–Α–Ε–Η―²–Β–Μ―¨ –≥―Ä–Ψ–Φ–Κ–Ψ, ―Ö–Μ–Ψ–Ω–Ϋ―É–≤ –Μ–Α–¥–Ψ–Ϋ―è–Φ–Η.
–û–Ω–Η―à–Η―²–Β –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ–Β ―Ä–Β–Α–Κ―Ü–Η―é –Κ―Ä―΄―¹―΄ –Η ―¹–¥–Β–Μ–Α–Ι―²–Β –≤―΄–≤–Ψ–¥.
–ü―Ä–Η–Φ–Β―΅–Α–Ϋ–Η–Β. –ü―Ä–Η –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤–Β ―²–Β―¹―²–Α –Ψ–±―Ä–Α―²–Η―²–Β –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β –Ϋ–Α ―Ä–Α–Ζ–≥–Η–±–Α–Ϋ–Η–Β –Ζ–Α–¥–Ϋ–Η―Ö –Η –Ω–Β―Ä–Β–¥–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι, –≤―΄–≥–Η–±–Α–Ϋ–Η–Β ―¹–Ω–Η–Ϋ―΄, –Ω―Ä–Η–Ε–Α―²–Η–Β ―É―à–Β–Ι –Η –Ζ–Α–Κ―Ä―΄―²–Η–Β –≥–Μ–Α–Ζ.
–†–Ψ–≥–Ψ–≤–Η―΅–Ϋ―΄–Ω ―Ä–Β―³–Μ–Β–Κ―¹.
–Λ–Η–Κ―¹–Η―Ä―É–Ι―²–Β –Κ―Ä―΄―¹―É –Ψ–¥–Ϋ–Ψ–Ι ―Ä―É–Κ–Ψ–Ι –Ϋ–Α ―¹―²–Ψ–Μ–Β.
–Γ–≤–Β―Ä–Ϋ–Η―²–Β –≤ –Ε–≥―É―² –Κ―É―¹–Ψ―΅–Β–Κ –≤–Α―²―΄ –Η –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ –Ω―Ä–Η–Κ–Ψ―¹–Ϋ–Η―²–Β―¹―¨ –Κ ―Ä–Ψ–≥–Ψ–≤–Η―Ü–Β –≥–Μ–Α–Ζ–Α.
–û–Ω–Η―à–Η―²–Β –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ–Β –Ψ―²–≤–Β―²–Ϋ―É―é ―Ä–Β–Α–Κ―Ü–Η―é –≤–Β–Κ –Η –Β–Β –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨. –Γ–¥–Β–Μ–Α–Ι―²–Β –≤―΄–≤–Ψ–¥.
–ö–Α―΅–Α–Ϋ–Η–Β –≥–Ψ–Μ–Ψ–≤–Ψ–Ι.
–£–Ψ–Ζ―¨–Φ–Η―²–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –Ζ–Α –Κ–Ψ–Ε―É –Ω–Ψ―è―¹–Ϋ–Η―΅–Ϋ–Ψ-–Κ―Ä–Β―¹―²―Ü–Ψ–≤–Ψ–Ι –Ψ–±–Μ–Α―¹―²–Η.
–ü–Ψ–≤–Β―Ä–Ϋ–Η―²–Β ―²–Β–Μ–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ ―¹–Ϋ–Α―΅–Α–Μ–Α –≤–Μ–Β–≤–Ψ, –Α –Ζ–Α―²–Β–Φ –≤–Ω―Ä–Α–≤–Ψ.
–ù–Α–Κ–Μ–Ψ–Ϋ–Η―²–Β –≤–Ϋ–Η–Ζ, –Α –Ζ–Α―²–Β–Φ –≤–≤–Β―Ä―Ö,
–Γ–¥–Β–Μ–Α–Ι―²–Β –≤―΄–≤–Ψ–¥.
–†–ê–ë–û–Δ–ê 3. –û―Ü–Β–Ϋ–Κ–Α –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Φ–Ψ―¹―²–Α (–≤–Α―Ä–Ψ–Μ–Η–Β–≤–Α –Φ–Ψ―¹―²–Α) –Η ―¹―Ä–Β–¥–Ϋ–Β–≥–Ψ –Φ–Ψ–Ζ–≥–Α
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–û―¹–≤–Ψ–Η―²―¨ –Φ–Β―²–Ψ–¥–Η–Κ―É –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è ―³―É–Ϋ–Κ―Ü–Η–Η –Φ–Ψ―¹―²–Α –Η ―¹―Ä–Β–¥–Ϋ–Β–≥–Ψ –Φ–Ψ–Ζ–≥–Α.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–†–Β―³–Μ–Β–Κ―¹ –Ω–Β―Ä–Β–≤–Ψ―Ä–Α―΅–Η–≤–Α–Ϋ–Η―è.
–ü–Ψ–Μ–Ψ–Ε–Η―²–Β –Κ―Ä―΄―¹―É –Ϋ–Α ―¹–Ω–Η–Ϋ―É –Ϋ–Α ―¹―²–Ψ–Μ –Η –Ψ―²–Φ–Β―²―¨―²–Β –Ψ―²–≤–Β―²–Ϋ―É―é ―Ä–Β–Α–Κ―Ü–Η―é.
–ü–Ψ–Μ–Ψ–Ε–Η―²–Β –Κ―Ä―΄―¹―É –Ϋ–Α ―¹–Ω–Η–Ϋ―É, –Α –≥–Ψ–Μ–Ψ–≤―É ―³–Η–Κ―¹–Η―Ä―É–Ι―²–Β ―Ä―É–Κ–Ψ–Ι. –û–Ω–Η―à–Η―²–Β –Ψ―²–≤–Β―²–Ϋ―É―é ―Ä–Β–Α–Κ―Ü–Η―é.
–£–Ψ–Ζ―¨–Φ–Η―²–Β –Κ―Ä―΄―¹―É, –Ω–Ψ–¥–Ϋ–Η–Φ–Η―²–Β –Ϋ–Α –≤―΄―¹–Ψ―²―É –Ψ–Κ–Ψ–Μ–Ψ 40 ―¹–Φ –Η –±―Ä–Ψ―¹―¨―²–Β –≤–≤–Β―Ä―Ö –Μ–Α–Ω–Α–Φ–Η –Ϋ–Α –Φ―è–≥–Κ―É―é –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²―¨. –½–Α–Ϋ–Β―¹–Η―²–Β –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ ―Ö–Α―Ä–Α–Κ―²–Β―Ä –Ω―Ä–Η–Ζ–Β–Φ–Μ–Β–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ.
–Γ–¥–Β–Μ–Α–Ι―²–Β –Ψ–±―â–Η–Ι –≤―΄–≤–Ψ–¥ –Ω–Ψ –≤―¹–Β–Φ ―²―Ä–Β–Φ ―²–Β―¹―²–Α–Φ.
–½―Ä–Α―΅–Κ–Ψ–≤―΄–Ι ―Ä–Β―³–Μ–Β–Κ―¹.
–£–Ψ–Ζ―¨–Φ–Η―²–Β –Κ―Ä―΄―¹―É –Η –Ζ–Α―³–Η–Κ―¹–Η―Ä―É–Ι―²–Β –Β–Β –≤ ―Ä―É–Κ–Β.
–Γ –Ω–Ψ–Φ–Ψ―â―¨―é –Μ―É–Ω―΄ –Ψ―²–Φ–Β―²―¨―²–Β –¥–Η–Α–Φ–Β―²―Ä –Ζ―Ä–Α―΅–Κ–Α.
–ù–Α–Ω―Ä–Α–≤―¨―²–Β ―¹–≤–Β―² –Ψ―² ―Ä―É―΅–Ϋ–Ψ–≥–Ψ ―³–Ψ–Ϋ–Α―Ä―è –Ϋ–Α –¥―Ä―É–≥–Ψ–Ι –≥–Μ–Α–Ζ.
–û―²–Φ–Β―²―¨―²–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Β –¥–Η–Α–Φ–Β―²―Ä–Α –Ζ―Ä–Α―΅–Κ–Α –Η―¹―¹–Μ–Β–¥―É–Β–Φ–Ψ–≥–Ψ –≥–Μ–Α–Ζ–Α.
–½–Α–Ω–Η―à–Η―²–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ. –Γ–¥–Β–Μ–Α–Ι―²–Β –≤―΄–≤–Ψ–¥.
–†–ê–ë–û–Δ–ê 4. –û―Ü–Β–Ϋ–Κ–Α ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Κ–Ψ―Ä―΄ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α
–Π–Β–Μ―¨ ―Ä–Α–±–Ψ―²―΄
–û―¹–≤–Ψ–Η―²―¨ –Ϋ–Β–≤―Ä–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β ―²–Β―¹―²―΄ ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Κ–Ψ―Ä―΄ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α.
–€–Β―²–Ψ–¥–Η–Κ–Α ―Ä–Α–±–Ψ―²―΄
–†–Β–Α–Κ―Ü–Η―è –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Η –Μ–Α–Ω–Κ–Η –Ϋ–Α –Ψ–Ω–Ψ―Ä―É.
–ü–Ψ–¥–Ϋ–Η–Φ–Η―²–Β –Κ―Ä―΄―¹―É –Η –Ω–Β―Ä–Β–¥–≤–Η–≥–Α–Ι―²–Β –≥–Ψ―Ä–Η–Ζ–Ψ–Ϋ―²–Α–Μ―¨–Ϋ–Ψ ―²–Α–Κ, ―΅―²–Ψ–±―΄ ―²―΄–Μ―¨–Ϋ–Α―è ―¹―²–Ψ―Ä–Ψ–Ϋ–Α –Ω–Β―Ä–Β–¥–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι –Κ–Ψ―¹–Ϋ―É–Μ–Α―¹―¨ –Κ―Ä–Α―è ―¹―²–Ψ–Μ–Α. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –Ψ―²–≤–Β―²–Η―² –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Ψ–Ι –Ω–Β―Ä–Β–¥–Ϋ–Β–Ι –Μ–Α–Ω―΄ –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²―¨ ―¹―²–Ψ–Μ–Α.
–ü–Ψ–¥–Ϋ–Η–Φ–Η―²–Β –Κ―Ä―΄―¹―É ―²–Α–Κ, ―΅―²–Ψ–±―΄ –Ω―Ä–Η –Ψ–Ω―É―¹–Κ–Α–Ϋ–Η–Η –Ψ–Ϋ–Α –Κ–Ψ―¹–Ϋ―É–Μ–Α―¹―¨ –Ω–Ψ–¥–±–Ψ―Ä–Ψ–¥–Κ–Ψ–Φ –Κ―Ä–Α―è ―¹―²–Ψ–Μ–Α. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –Ψ―²–≤–Β―²–Η―² –Ω–Ψ―¹―²–Α–Ϋ–Ψ–≤–Κ–Ψ–Ι –Ψ–±–Β–Η―Ö –Ω–Β―Ä–Β–¥–Ϋ–Η―Ö –Μ–Α–Ω –Ϋ–Α ―¹―²–Ψ–Μ ―Ä―è–¥–Ψ–Φ ―¹ –Ω–Ψ–¥–±–Ψ―Ä–Ψ–¥–Κ–Ψ–Φ.
–î–Β―Ä–Ε–Η―²–Β –Κ―Ä―΄―¹―É –Ϋ–Α –Κ―Ä–Α―é ―¹―²–Ψ–Μ–Α –Η ―¹–¥–≤–Η–Ϋ―¨―²–Β –Ψ–¥–Ϋ―É –Ω–Β―Ä–Β–¥–Ϋ―é―é –Η–Μ–Η –Ζ–Α–¥–Ϋ―é―é –Μ–Α–Ω―É ―²–Α–Κ, ―΅―²–Ψ–±―΄ –Ψ–Ϋ–Α ―¹–≤–Β―à–Η–≤–Α–Μ–Α―¹―¨ ―¹ –Κ―Ä–Α―è ―¹―²–Ψ–Μ–Α. –¦–Α–Ω–Α –Ϋ–Β–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ –¥–Ψ–Μ–Ε–Ϋ–Α –Ω–Ψ–¥―²―è–Ϋ―É―²―¨―¹―è –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²―¨ ―¹―²–Ψ–Μ–Α.
–î–Β―Ä–Ε–Η―²–Β –Κ―Ä―΄―¹―É –Ζ–Α ―Ö–≤–Ψ―¹―² –Η –Ψ–Ω―É―¹―²–Η―²–Β –≤–Ϋ–Η–Ζ, –Ω–Ψ–Κ–Α –≤–Η–±―Ä–Η―¹―¹―΄ –Ϋ–Β –Κ–Ψ―¹–Ϋ―É―²―¨―¹―è –Κ―Ä–Α―è ―¹―²–Ψ–Μ–Α. –ö―Ä―΄―¹–Α –Ω–Ψ–¥–Ϋ–Η–Φ–Α–Β―² –≥–Ψ–Μ–Ψ–≤―É –Η –Ω–Ψ–¥–≤–Η–≥–Α–Β―² –Μ–Α–Ω―΄ –Κ ―¹―²–Ψ–Μ―É.
–î–Β―Ä–Ε–Η―²–Β –Κ―Ä―΄―¹―É –Ζ–Α ―Ö–≤–Ψ―¹―² –Η –Ψ–Ω―É―¹–Κ–Α–Ι―²–Β –≤–Ϋ–Η–Ζ, –Ϋ–Ψ ―²–Α–Κ, ―΅―²–Ψ–±―΄ –≤–Η–±―Ä–Η―¹―¹―΄ –Ϋ–Β –Κ–Α―¹–Α–Μ–Η―¹―¨ –Κ―Ä–Α―è ―¹―²–Ψ–Μ–Α –Η –Φ–Ψ–≥–Μ–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨―¹―è ―²–Ψ–Μ―¨–Κ–Ψ –Ζ―Ä–Η―²–Β–Μ―¨–Ϋ―΄–Β ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä―΄. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –Ω–Ψ–Ω―΄―²–Α–Β―²―¹―è ―¹―Ö–≤–Α―²–Η―²―¨―¹―è –Ζ–Α –Κ―Ä–Α–Ι ―¹―²–Ψ–Μ–Α, –Κ–Α–Κ ―²–Ψ–Μ―¨–Κ–Ψ –Ψ–Κ–Α–Ε–Β―²―¹―è –≤ –Ω―Ä–Β–¥–Β–Μ–Α―Ö –¥–Ψ―¹―è–≥–Α–Β–Φ–Ψ―¹―²–Η.
–Δ–Β―¹―² –¥–Μ―è –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η ―Ä–Α–≤–Ϋ–Ψ–≤–Β―¹–Η―è.
–ü–Ψ–Φ–Β―¹―²–Η―²–Β –Κ―Ä―΄―¹―É –Ϋ–Α –¥–Β―Ä–Β–≤―è–Ϋ–Ϋ―΄–Ι –±―Ä―É―¹–Ψ–Κ –¥–Η–Α–Φ–Β―²―Ä–Ψ–Φ 2 ―¹–Φ –Η –¥–Μ–Η–Ϋ–Ψ–Ι 30 ―¹–Φ, –Ζ–Α–Κ―Ä–Β–Ω–Μ–Β–Ϋ–Ϋ―΄–Ι –Ϋ–Α –≤―΄―¹–Ψ―²–Β 50 ―¹–Φ –Ϋ–Α–¥ –Ω–Ψ–Μ–Ψ–Φ. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ω―Ä–Ψ―¹–Η–¥–Β―²―¨ –Ϋ–Α –±―Ä―É―¹–Κ–Β –±–Ψ–Μ–Β–Β 3 –Φ–Η–Ϋ―É―².
–½–Α–Ω–Η―à–Η―²–Β –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Η ―¹–¥–Β–Μ–Α–Ι―²–Β ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É―é―â–Η–Β –≤―΄–≤–Ψ–¥―΄. –ü―Ä–Η–Φ–Β―΅–Α–Ϋ–Η–Β. –î–Μ―è –±–Ψ–Μ–Β–Β –≥–Μ―É–±–Ψ–Κ–Ψ–≥–Ψ –Ζ–Α–Κ―Ä–Β–Ω–Μ–Β–Ϋ–Η―è –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Φ–Α―²–Β―Ä–Η–Α–Μ–Α, –Η―¹–Ω–Ψ–Μ―¨–Ζ―É―è ―É―΅–Β–±–Ϋ–Η–Κ–Η –Ω–Ψ –Α–Ϋ–Α―²–Ψ–Φ–Η–Η –Η ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η ―΅–Β–Μ–Ψ–≤–Β–Κ–Α, –Ψ–Ω–Η―à–Η―²–Β –Η –Ζ–Α―Ä–Η―¹―É–Ι―²–Β ―Ä–Β―³–Μ–Β–Κ―²–Ψ―Ä–Ϋ―΄–Β –¥―É–≥–Η –¥–Μ―è –Κ–Α–Ε–¥–Ψ–≥–Ψ –Η–Ζ ―Ä–Β―³–Μ–Β–Κ―¹–Ψ–≤.
–Γ–ü–‰–Γ–û–ö –†–ï–ö–û–€–ï–ù–î–Θ–ï–€–û–ô –¦–‰–Δ–ï–†–ê–Δ–Θ–†–Ϊ
–ë–Α―²―É–Β–≤ –ê.–Γ, –ù–Η–Κ–Η―²–Η–Ϋ–Α –‰.–ü., –•―É―Ä–Α–≤–Μ–Β–≤ –£.–¦., –Γ–Ψ–Κ–Ψ–Μ–Ψ–≤–Α –ù.–ù. –€–Α–Μ―΄–Ι –Ω―Ä–Α–Κ―²–Η–Κ―É–Φ –Ω–Ψ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Η –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö. –Γ–ü–±: –‰–Ζ–¥-–≤–Ψ –Γ.-–ü–Β―²–Β―Ä–±―É―Ä–≥―¹–Κ–Ψ–≥–Ψ ―É–Ϋ-―²–Α, 2001. 348 ―¹.
–ë–Ψ–Μ―¨―à–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ―É–Φ –Ω–Ψ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Η –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö: –Θ―΅–Β–±. –Ω–Ψ―¹–Ψ–±–Η–Β –¥–Μ―è –≤―É–Ζ–Ψ–≤ /–‰.–ü.–ë–Α―¹–Κ–Ψ–≤–Α, –™.–Γ.–‰–Ω–Ω–Ψ–Μ–Η―²–Ψ–≤–Α, –ü.–ê.–ö–Β–Μ–Α―Ä–Β–≤–Α –Η –¥―Ä.; –Ω–Ψ–¥ ―Ä–Β–¥. –ë.–ê.–ö―É–¥―è―à–Ψ–≤–Α. –€: –£―΄―¹―à. ―à–Κ., 1984. 407 ―¹.
–ë―É―Ä–Β―à –·., –ë―É―Ä–Β―à–Ψ–≤–Α –û., –Ξ―¨―é―¹―²–Ψ–Ϋ –î. –€–Β―²–Ψ–¥–Η–Κ–Η –Η –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄–Β ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²―΄ –Ω–Ψ –Η–Ζ―É―΅–Β–Ϋ–Η―é –Φ–Ψ–Ζ–≥–Α –Η –Ω–Ψ–≤–Β–¥–Β–Ϋ–Η―è. –€.: –£―΄―¹―à. ―à–Κ., 1991. 399 ―¹.
–½–Α–Ω–Α–¥–Ϋ―é–Κ –‰.–ü., –½–Α–Ω–Α–¥–Ϋ―é–Κ –£.–‰., –½–Α―Ö–Α―Ä–Η―è –ï.–ê., –½–Α–Ω–Α–¥–Ϋ―é–Κ –ë.–£. –¦–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β –Ε–Η–≤–Ψ―²–Ϋ―΄–Β. –†–Α–Ζ–≤–Β–¥–Β–Ϋ–Η–Β, ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β, –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –≤ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Β. –ö–Η–Β–≤, 1983.
–ù–Ψ–Ζ–¥―Ä–Α―΅–Β–≤ –ê.–î., –ë–Α–Ε–Β–Ϋ–Ψ–≤ –°.–‰. –Η –¥―Ä. –ù–Α―΅–Α–Μ–Α ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η: –Θ―΅–Β–±–Ϋ–Η–Κ –¥–Μ―è –≤―É–Ζ–Ψ–≤/ –ü–Ψ–¥ ―Ä–Β–¥. –Α–Κ–Α–¥. –ê.–î. –ù–Ψ–Ζ–¥―Ä–Α―΅–Β–≤–Α, –Γ–ü–±., 2001. 385 ―¹.
–ù–Ψ–Ζ–¥―Ä–Α―΅–Β–≤ –ê.–î., –ü–Ψ–Μ―è–Κ–Ψ–≤ –ï.–¦. –ê–Ϋ–Α―²–Ψ–Φ–Η―è –Κ―Ä―΄―¹―΄: –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β –Ε–Η–≤–Ψ―²–Ϋ―΄–Β/ –ü–Ψ–¥ ―Ä–Β–¥. –Α–Κ–Α–¥. –ê.–î. –ù–Ψ–Ζ–¥―Ä–Α―΅–Β–≤–Α. –Γ–ü–±.: –‰–Ζ–¥-–≤–Ψ ¬Ϊ–¦–Α–Ϋ―¨¬Μ, 2001. 464 ―¹.
–ù–Ψ–Ζ–¥―Ä–Α―΅–Β–≤ –ê.–î., –ü–Ψ–Μ―è–Κ–Ψ–≤ –ï.–¦., –™–Ϋ–Β―²–Ψ–≤ –ê.–£. –‰―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β ―³―É–Ϋ–Κ―Ü–Η–Ι –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α: –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄–Β ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Β –Φ–Β―²–Ψ–¥―΄. –Θ―΅–Β–±–Ϋ. –ü–Ψ―¹–Ψ–±–Η–Β. –¦.:–‰–Ζ–¥-–≤–Ψ–¦–™–Θ, 1987. 160 ―¹.
–†―É–Κ–Ψ–≤–Ψ–¥―¹―²–≤–Ψ –Κ –Ω―Ä–Α–Κ―²–Η―΅–Β―¹–Κ–Η–Φ –Ζ–Α–Ϋ―è―²–Η―è–Φ –Ω–Ψ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η ―΅–Β–Μ–Ψ–≤–Β–Κ–Α –Η –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö: –Θ―΅–Β–±. –Ω–Ψ―¹–Ψ–±–Η–Β / –ü–Ψ–¥. –†–Β–¥. –‰.–ü. –ê―à–Φ–Α―Ä–Η–Ϋ–Α, –ê.–ê.–ö–Α–Φ–Β–Ϋ―¹–Κ–Ψ–≥–Ψ, –™.–Γ.–Γ―É―Ö–Ψ–≤–Ψ–Ι. - 2-–Β –Η–Ζ–¥., –Ω–Β―Ä–Β―Ä–Α–± –Η –¥–Ψ–Ω.-–€.: –‰–Ζ–¥-–≤–Ψ –€–™–Θ, 2004. - 256 ―¹.
–Δ―Ä–Α―Ö―²–Β–Ϋ–±–Β―Ä–≥ –‰.–€., –Γ–Ψ–≤–Α –†.–ï., –®–Β―³―²–Β–Μ―¨ –£.–û., –û–Ϋ–Η–Κ–Η–Β–Ϋ–Κ–Ψ –Λ.–ê. –ü–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η –Ϋ–Ψ―Ä–Φ―΄ ―É –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –≤ ―²–Ψ–Κ―¹–Η–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Φ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Β. –€.: ¬Ϊ–€–Β–¥–Η―Ü–Η–Ϋ–Α¬Μ, 1978. 176 ―¹.
–Λ–Η―³–Κ–Ψ–≤–Α –ï., –€–Α―Ä―à–Α–Μ–Α –î–Ε. –Γ―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―΅–Β―¹–Κ–Η–Β –Α―²–Μ–Α―¹―΄ –Κ–Ψ―à–Κ–Η, –Κ―Ä–Ψ–Μ–Η–Κ–Α –Η –Κ―Ä―΄―¹―΄./–£ –Κ–Ϋ.: –ë―É―Ä–Β―à –·., –ü–Β―²―Ä–Α–Ϋ―¨ –€., –½–Α―Ö–Α―Ä –‰. –≠–Μ–Β–Κ―²―Ä–Ψ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Φ–Β―²–Ψ–¥―΄ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è. –€., 1962,
―¹. 384-426.
–≠–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Α―è ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―è: –ü―Ä–Α–Κ―²–Η–Κ―É–Φ –Ω–Ψ ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η / –ü–Β―Ä. ―¹ –Α–Ϋ–≥–Μ. –ö–Α–Φ–Β–Ϋ―¹–Κ–Ψ–Ι –€.–ê.. –€.: –€–Η―Ä, 1974. 350 ―¹.
–ü–†–ê–£–‰–¦–ê –ü–†–û–£–ï–î–ï–ù–‰–· –†–ê–ë–û–Δ –Γ –‰–Γ–ü–û–¦–§–½–û–£–ê–ù–‰–ï–€ –≠–ö–Γ–ü–ï–†–‰–€–ï–ù–Δ–ê–¦–§–ù–Ϊ–Ξ –•–‰–£–û–Δ–ù–Ϊ–Ξ
(–ü―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β –Κ –Ω―Ä–Η–Κ–Α–Ζ―É –€–Η–Ϋ–Η―¹―²–Β―Ä―¹―²–≤–Α –Ζ–¥―Ä–Α–≤–Ψ–Ψ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η―è –Γ–Γ–Γ–† –Ψ―² 12.08.1977 –≥. N 755)
1. –ù–Α―¹―²–Ψ―è―â–Η–Β –ü―Ä–Α–≤–Η–Μ–Α ―Ä–Β–≥–Μ–Α–Φ–Β–Ϋ―²–Η―Ä―É―é―² –≤―¹–Β –≤–Η–¥―΄ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –≤ –Φ–Β–¥–Η–Κ–Ψ-–±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Β: –¥–Μ―è –Ϋ–Α―É―΅–Ϋ–Ψ–≥–Ψ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α, –≤ ―Ü–Β–Μ―è―Ö –Ψ–±–Β―¹–Ω–Β―΅–Β–Ϋ–Η―è ―É―΅–Β–±–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―Ü–Β―¹―¹–Α, –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―²–Β―¹―²–Η―Ä–Ψ–≤–Α–Ϋ–Η―è, –≤ ―Ö–Ψ–¥–Β –Η–Ζ–≥–Ψ―²–Ψ–≤–Μ–Β–Ϋ–Η―è –≤–Η―Ä―É―¹–Ϋ―΄―Ö, –±–Α–Κ―²–Β―Ä–Η–Ι–Ϋ―΄―Ö –Η –¥―Ä―É–≥–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤.
2. –ü―Ä–Α–≤–Η–Μ–Α –Η–Φ–Β―é―² ―Ü–Β–Μ―¨―é:
- –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –Κ–Α―΅–Β―¹―²–≤–Α –Ϋ–Α―É―΅–Ϋ―΄―Ö –Η –¥―Ä―É–≥–Η―Ö –≤–Η–¥–Ψ–≤ ―Ä–Α–±–Ψ―² ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η;
- –Ψ–±–Β―¹–Ω–Β―΅–Β–Ϋ–Η–Β –Ω―Ä–Η–Ϋ―Ü–Η–Ω–Ψ–≤ –≥―É–Φ–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ψ–±―Ä–Α―â–Β–Ϋ–Η―è ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η;
- ―É–Ω–Ψ―Ä―è–¥–Ψ―΅–Β–Ϋ–Η–Β ―¹–Η―¹―²–Β–Φ―΄ –Ω–Μ–Α–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Η –Ψ―²―΅–Β―²–Ϋ–Ψ―¹―²–Η –≤ –Ψ–±–Μ–Α―¹―²–Η –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Α―Ü–Η–Η ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–Ι ―Ä–Α–±–Ψ―²―΄ –Η ―¹–Ψ–≤–Β―Ä―à–Β–Ϋ―¹―²–≤–Ψ–≤–Α–Ϋ–Η–Η –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≤–Ψ–¥―¹―²–≤–Α.
3. –ü―Ä–Α–≤–Ψ –Ϋ–Α –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Η–Φ–Β―é―² –Ϋ–Α―É―΅–Ϋ–Ψ-–Η―¹―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨―¹–Κ–Η–Β, –Μ–Β―΅–Β–±–Ϋ―΄–Β –Η ―É―΅–Β–±–Ϋ―΄–Β ―É―΅―Ä–Β–Ε–¥–Β–Ϋ–Η―è, ―¹–Α–Ϋ―ç–Ω–Η–¥―¹―²–Α–Ϋ―Ü–Η–Η –Η ―É―΅―Ä–Β–Ε–¥–Β–Ϋ–Η―è –Ω–Ψ –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤―É –±–Α–Κ―²–Β―Ä–Η–Ι–Ϋ―΄―Ö, –≤–Η―Ä―É―¹–Ϋ―΄―Ö –Η –¥―Ä―É–≥–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤.
4. –Θ―΅―Ä–Β–Ε–¥–Β–Ϋ–Η―è –Φ–Ψ–≥―É―² –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨ ―Ä–Α–±–Ψ―²―É ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η –≤ ―²–Ψ–Φ ―¹–Μ―É―΅–Α–Β, –Β―¹–Μ–Η –Ψ–Ϋ–Η –Η–Φ–Β―é―²:
–≤–Η–≤–Α―Ä–Η–Ι (―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ-–±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ―É―é –Κ–Μ–Η–Ϋ–Η–Κ―É), –Ψ–±–Ψ―Ä―É–¥–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ –Γ–Α–Ϋ–Η―²–Α―Ä–Ϋ―΄–Φ –Ω―Ä–Α–≤–Η–Μ–Α–Φ –Ψ―² 06.04.73 ⳕ 1045-73;
―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―É―é –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η―é, –Ψ–±–Ψ―Ä―É–¥–Ψ–≤–Α–Ϋ–Ϋ―É―é ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η―è–Φ (–Ω―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 1);
―à―²–Α―² ―¹–Ψ―²―Ä―É–¥–Ϋ–Η–Κ–Ψ–≤, –Ψ–±–Β―¹–Ω–Β―΅–Η–≤–Α―é―â–Η–Ι ―É―Ö–Ψ–¥ –Ζ–Α –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η –Η –≤―΄–Ω–Ψ–Μ–Ϋ―è―é―â–Η–Ι ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η―è –≥―É–Φ–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ψ–±―Ä–Α―â–Β–Ϋ–Η―è ―¹ –Ϋ–Η–Φ–Η (–Ω―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η―è ⳕⳕ 2, 3, 4).
5. –ö ―Ä–Α–±–Ψ―²–Β ―¹ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄–Φ–Η –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η –¥–Ψ–Ω―É―¹–Κ–Α―é―²―¹―è –Μ–Η―Ü–Α, –Η–Φ–Β―é―â–Η–Β –≤―΄―¹―à–Β–Β –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Β, –≤–Β―²–Β―Ä–Η–Ϋ–Α―Ä–Ϋ–Ψ–Β, –Ζ–Ψ–Ψ―²–Β―Ö–Ϋ–Η―΅–Β―¹–Κ–Ψ–Β, ―³–Α―Ä–Φ–Α―Ü–Β–≤―²–Η―΅–Β―¹–Κ–Ψ–Β –Η–Μ–Η –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Β –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η–Β, ―Ä–Α–Ζ―Ä–Β―à–Β–Ϋ–Η–Β –Ϋ–Α –Ω―Ä–Α–≤–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Η –Ϋ–Β―¹―É―â–Η–Β –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Ζ–Α ―¹–Ψ–±–Μ―é–¥–Β–Ϋ–Η–Β –ü―Ä–Α–≤–Η–Μ.
6. –¦–Η―Ü–Α, –Η–Φ–Β―é―â–Η–Β ―¹―Ä–Β–¥–Ϋ–Β–Β –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Β, –≤–Β―²–Β―Ä–Η–Ϋ–Α―Ä–Ϋ–Ψ–Β, –Η–Μ–Η –Ζ–Ψ–Ψ―²–Β―Ö–Ϋ–Η―΅–Β―¹–Κ–Ψ–Β –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η–Β (–Α –≤ ―É―΅–Β–±–Ϋ―΄―Ö ―É―΅―Ä–Β–Ε–¥–Β–Ϋ–Η―è―Ö –Η ―¹―²―É–¥–Β–Ϋ―²―΄) –Η –Ζ–Ϋ–Α–Κ–Ψ–Φ―΄–Β ―¹ –Ϋ–Α―¹―²–Ψ―è―â–Η–Φ–Η –ü―Ä–Α–≤–Η–Μ–Α–Φ–Η, –¥–Ψ–Ω―É―¹–Κ–Α―é―²―¹―è –Κ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―é –Ϋ–Β―¹–Μ–Ψ–Ε–Ϋ―΄―Ö –Η –Ϋ–Β–±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄―Ö –Ω―Ä–Ψ―Ü–Β–¥―É―Ä –Ϋ–Α –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö, –±–Β–Ζ –Ω–Ψ–Μ―É―΅–Β–Ϋ–Η―è –Ω–Β―Ä―¹–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―Ä–Α–Ζ―Ä–Β―à–Β–Ϋ–Η―è, –Ϋ–Ψ –Ω–Ψ–¥ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Β–Φ –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Μ–Η―Ü–Α –Η –Ω–Ψ–¥ –Β–≥–Ψ –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ―¹―²―¨, –Ζ–Α –Η―¹–Κ–Μ―é―΅–Β–Ϋ–Η–Β–Φ –Ω–Β―Ä―¹–Ψ–Ϋ–Α–Μ–Α –Ω―Ä–Β–¥–Ω―Ä–Η―è―²–Η–Ι –Ω–Ψ –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤―É –±–Α–Κ―²–Β―Ä–Η–Ι–Ϋ―΄―Ö –Η –≤–Η―Ä―É―¹–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤.
7. –½–Α –Ω–Ψ–¥–≥–Ψ―²–Ψ–≤–Κ―É ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α―²–Ψ―Ä–Α –Κ ―Ä–Α–±–Ψ―²–Β ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η –Η –Ζ–Α ―¹–Ψ–±–Μ―é–¥–Β–Ϋ–Η–Β –ü―Ä–Α–≤–Η–Μ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –≤ ―Ü–Β–Μ–Ψ–Φ –Ϋ–Β―¹–Β―² –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ―¹―²―¨ ―Ä―É–Κ–Ψ–≤–Ψ–¥–Η―²–Β–Μ―¨ –Κ–Α―³–Β–¥―Ä―΄ (–Ψ―²–¥–Β–Μ–Α, –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η–Η, –Κ–Α–±–Η–Ϋ–Β―²–Α), –≤ –Κ–Ψ―²–Ψ―Ä―΄―Ö ―Ä–Α–±–Ψ―²–Α–Β―² –Μ–Η―Ü–Ψ, –¥–Ψ–Ω―É―â–Β–Ϋ–Ϋ–Ψ–Β –Κ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²―É –Ϋ–Α –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö.
8. –ü―Ä–Η –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Η–Η –≤ –Ω–Β―΅–Α―²―¨ –¥–Α–Ϋ–Ϋ―΄―Ö –Ψ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Ϋ―΄―Ö ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö, ―É―΅―Ä–Β–Ε–¥–Β–Ϋ–Η―è –Η –Ψ―²–¥–Β–Μ―¨–Ϋ―΄–Β –Μ–Η―Ü–Α –Ψ–±―è–Ζ–Α–Ϋ―΄ ―É–Κ–Α–Ζ―΄–≤–Α―²―¨ ―¹–≤–Β–¥–Β–Ϋ–Η―è –Ψ–± –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Η –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö (–≤–Η–¥, –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ, ―²–Η–Ω –Ω―Ä–Η–Φ–Β–Ϋ―è–≤―à–Β–≥–Ψ―¹―è –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è –Η ―². –¥.).
9. –£―¹–Β –Ω―Ä–Ψ―Ü–Β–¥―É―Ä―΄ –Ϋ–Α –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ, –Κ–Ψ―²–Ψ―Ä―΄–Β –Φ–Ψ–≥―É―² –≤―΄–Ζ–≤–Α―²―¨ ―É –Ϋ–Β–≥–Ψ –±–Ψ–Μ―¨ –Η–Μ–Η –Η–Ϋ–Ψ–≥–Ψ ―Ä–Ψ–¥–Α –Φ―É―΅–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β, –Ω―Ä–Ψ–≤–Ψ–¥―è―²―¹―è –Ω―Ä–Η –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ–Φ –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η–Η (–Ω–Ψ–¥ –Φ–Β―¹―²–Ϋ–Ψ–Ι –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Β–Ι –Η–Μ–Η –Ϋ–Α―Ä–Κ–Ψ–Ζ–Ψ–Φ), –Κ―Ä–Ψ–Φ–Β ―¹–Μ―É―΅–Α–Β–≤ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –¥–Μ―è –Ω–Ψ–Μ―É―΅–Β–Ϋ–Η―è –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, –Η―Ö –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―è –≤ –Η–Φ–Φ―É–Ϋ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è―Ö (–ü―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 3). –û–Ω―΄―²―΄ ―¹ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ –Φ–Η–Ψ―Ä–Β–Μ–Α–Κ―¹–Α–Ϋ―²–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ϋ–Β ―è–≤–Μ―è―é―²―¹―è –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α―é―â–Η–Φ–Η ―¹―Ä–Β–¥―¹―²–≤–Α–Φ–Η, –≤–Ψ –≤―¹–Β―Ö ―¹–Μ―É―΅–Α―è―Ö –Ω―Ä–Ψ–≤–Ψ–¥―è―²―¹―è –Ω―Ä–Η –Ω–Ψ–Μ–Ϋ–Ψ–Φ –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η–Η.
10. –½–Α–Ω―Ä–Β―â–Α–Β―²―¹―è –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –¥–Μ―è –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄―Ö –Ω―Ä–Ψ―Ü–Β–¥―É―Ä –±–Ψ–Μ–Β–Β ―΅–Β–Φ –Ψ–¥–Η–Ϋ ―Ä–Α–Ζ, –Κ―Ä–Ψ–Φ–Β –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö, –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β–Φ―΄―Ö –¥–Μ―è –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―è –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, –≤ –Η―Ö –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤–Β, –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö-–¥–Ψ–Ϋ–Ψ―Ä–Ψ–≤ –Η –Ω―Ä–Η –Η–Ζ―É―΅–Β–Ϋ–Η–Η ―¹―Ö–Β–Φ –Η–Φ–Φ―É–Ϋ–Η–Ζ–Α―Ü–Η–Η.
–ü―Ä–Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η –Ω–Ψ–≤―²–Ψ―Ä–Ϋ―΄―Ö –Ψ–Ω―΄―²–Ψ–≤ ―²–Α–Κ–Ψ–≥–Ψ ―Ä–Ψ–¥–Α –≤–Ψ–Ω―Ä–Ψ―¹ –¥–Ψ–Μ–Ε–Β–Ϋ –Ψ–±―¹―É–Ε–¥–Α―²―¨―¹―è –Ϋ–Α ―É―΅–Β–Ϋ–Ψ–Φ ―¹–Ψ–≤–Β―²–Β –Η–Ϋ―¹―²–Η―²―É―²–Α –Η –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Β ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α βÄ™ ―¹–Α–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Ψ ―Ä–Β―à–Β–Ϋ–Η–Β–Φ –ö–Ψ–Φ–Η―¹―¹–Η–Η –Ω–Ψ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–Ι ―Ä–Α–±–Ψ―²–Β (―¹–Ψ―é–Ζ–Ϋ–Ψ–Ι –Η–Μ–Η ―Ä–Β―¹–Ω―É–±–Μ–Η–Κ–Α–Ϋ―¹–Κ–Ψ–Ι).
11. –ü―Ä–Η –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Η ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Ψ–≤ –Η –¥―Ä―É–≥–Η―Ö –Ω―Ä–Ψ―Ü–Β–¥―É―Ä –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–≥–Ψ ―Ä–Η―¹–Κ–Α –Ϋ–Α–Ϋ–Β―¹–Β–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄―Ö ―Ä–Α–Ζ–¥―Ä–Α–Ε–Β–Ϋ–Η–Ι (―²―Ä–Α–≤–Φ–Α –≤ –Ζ–Α―²―Ä―É–¥–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄―Ö ―É―¹–Μ–Ψ–≤–Η―è―Ö –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –Ζ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Κ–Α―Ä―²–Η–Ϋ–Ψ–Ι ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, –Ψ–±–Β–Ζ–¥–≤–Η–Ε–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Ψ―Ü–Β–¥―É―Ä –Ϋ–Α –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Φ–Α–Μ–Ψ–Ψ–Ω―΄―²–Ϋ―΄–Φ–Η –Μ–Η―Ü–Α–Φ–Η, (–Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, ―¹―²―É–¥–Β–Ϋ―²–Α–Φ–Η) ―¹―²―Ä–Ψ–≥–Ψ –Ψ–±―è–Ζ–Α―²–Β–Μ―¨–Ϋ–Ψ –Ω―Ä–Η―¹―É―²―¹―²–≤–Η–Β –Μ–Η―Ü–Α, –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ζ–Α –Η―¹–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Η –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ ―¹ –Β–≥–Ψ ―¹―²–Ψ―Ä–Ψ–Ϋ―΄ –Ζ–Α ―¹–Ψ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η–Β–Φ –Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–≥–Ψ –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è.
12. –£ –Ω–Ψ―¹–Μ–Β–Ψ–Ω–Β―Ä–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ω–Ψ–Μ―É―΅–Α―²―¨ –Κ–≤–Α–Μ–Η―³–Η―Ü–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι ―É―Ö–Ψ–¥ –Η –Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–Β –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η–Β.
13. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β, –Κ–Ψ―²–Ψ―Ä–Ψ–Β –Ψ―¹―²–Α–Μ–Ψ―¹―¨ –Ω–Ψ―¹–Μ–Β ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α –Η–Μ–Η –¥―Ä―É–≥–Ψ–Ι –Ω―Ä–Ψ―Ü–Β–¥―É―Ä―΄ –Η―¹–Κ–Α–Μ–Β―΅–Β–Ϋ–Ϋ―΄–Φ –Η–Μ–Η –Ϋ–Β–Ε–Η–Ζ–Ϋ–Β―¹–Ω–Ψ―¹–Ψ–±–Ϋ―΄–Φ –¥–Ψ–Μ–Ε–Ϋ–Ψ –±―΄―²―¨ ―¹–≤–Ψ–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Ψ ―¹ ―¹–Ψ–±–Μ―é–¥–Β–Ϋ–Η–Β–Φ –≤―¹–Β―Ö ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η–Ι –≥―É–Φ–Α–Ϋ–Ϋ–Ψ―¹―²–Η.
14. –≠–≤―²–Α–Ϋ–Α–Ζ–Η―è, ―².–Β. –≥―É–Φ–Α–Ϋ–Ϋ–Ψ–Β ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¹―è –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ –Μ–Η―Ü–Ψ–Φ –Η–Μ–Η –Ω–Ψ–¥ –Β–≥–Ψ –Ϋ–Β–Ω–Ψ―¹―Ä–Β–¥―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η–Β–Φ –Ω―Ä–Η ―¹–Ψ–±–Μ―é–¥–Β–Ϋ–Η–Η –≤―¹–Β―Ö ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η–Ι –≥―É–Φ–Α–Ϋ–Ϋ–Ψ―¹―²–Η, –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η―è–Φ–Η (–Ω―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 4).
15. –Θ–±–Ψ―Ä–Κ–Α ―²―Ä―É–Ω–Α –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ε–Β―² –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¨―¹―è ―²–Ψ–Μ―¨–Κ–Ψ –Ω–Ψ―¹–Μ–Β ―²–Ψ–≥–Ψ, –Κ–Α–Κ ―¹–Φ–Β―Ä―²―¨ –±―É–¥–Β―² –Κ–Ψ–Ϋ―¹―²–Α―²–Η―Ä–Ψ–≤–Α–Ϋ–Α –Μ–Η―Ü–Ψ–Φ, –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ –Ζ–Α ―Ä–Α–±–Ψ―²―É ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ.
16. –û―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Ζ–Α –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β –ü―Ä–Α–≤–Η–Μ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è ―Ä–Α–±–Ψ―² ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Ϋ–Β―¹―É―² ―Ä―É–Κ–Ψ–≤–Ψ–¥–Η―²–Β–Μ–Η ―É―΅―Ä–Β–Ε–¥–Β–Ϋ–Η–Ι, –≥–¥–Β –Ω―Ä–Ψ–≤–Ψ–¥―è―²―¹―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²―΄, –Η –Μ–Η―Ü–Α, ―¹–Ω–Β―Ü–Η–Α–Μ―¨–Ϋ–Ψ –≤―΄–¥–Β–Μ–Β–Ϋ–Ϋ―΄–Β –¥–Μ―è –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è ―ç―²–Ψ–Ι ―Ä–Α–±–Ψ―²―΄.
17. –ù–Α―Ä―É―à–Β–Ϋ–Η–Β –ü―Ä–Α–≤–Η–Μ –≥―É–Φ–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ψ–±―Ä–Α―â–Β–Ϋ–Η―è ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η –Η –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Β ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Ψ–≤ –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö, ―¹―²–Α–≤―è―â–Η―Ö –Ω–Ψ–¥ ―¹–Ψ–Φ–Ϋ–Β–Ϋ–Η–Β –Ϋ–Α―É―΅–Ϋ―É―é –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ―¹―²―¨ –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö, –Φ–Ψ–Ε–Β―² –Ω–Ψ–≤–Μ–Β―΅―¨ –Ζ–Α ―¹–Ψ–±–Ψ–Ι –≤ ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ϋ–Ψ–Φ –Ω–Ψ―Ä―è–¥–Κ–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –Κ –≤–Η–Ϋ–Ψ–≤–Ϋ―΄–Φ –Μ–Η―Ü–Α–Φ –Φ–Β―Ä –¥–Η―¹―Ü–Η–Ω–Μ–Η–Ϋ–Α―Ä–Ϋ–Ψ–≥–Ψ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è, –Α ―²–Α–Κ–Ε–Β –Ζ–Α–Ω―Ä–Β―â–Β–Ϋ–Η―è –Ϋ–Α―É―΅–Ϋ―΄―Ö –Ω―É–±–Μ–Η–Κ–Α―Ü–Η–Ι, –Ζ–Α―â–Η―²―΄ –¥–Η―¹―¹–Β―Ä―²–Α―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö ―Ä–Α–±–Ψ―² –Η –Ζ–Α–Ω―Ä–Β―â–Β–Ϋ–Η―è –¥–Α–Μ―¨–Ϋ–Β–Ι―à–Β–≥–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –≤ –Ϋ–Α―É―΅–Ϋ―΄―Ö –Η ―É―΅–Β–±–Ϋ―΄―Ö ―Ü–Β–Μ―è―Ö.
–ü―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 1
–û–ë–û–†–Θ–î–û–£–ê–ù–‰–ï –≠–ö–Γ–ü–ï–†–‰–€–ï–ù–Δ–ê–¦–§–ù–û–ô –¦–ê–ë–û–†–ê–Δ–û–†–‰–‰
–û–±―è–Ζ–Α―²–Β–Μ―¨–Ϋ―΄–Φ–Η ―É―¹–Μ–Ψ–≤–Η―è–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Α―Ü–Η–Η ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ–Ι –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η–Η ―è–≤–Μ―è―é―²―¹―è ―¹–Μ–Β–¥―É―é―â–Η–Β:
1. –ù–Α–Μ–Η―΅–Η–Β ―¹–Ω–Β―Ü–Η–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η―è –¥–Μ―è –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Ψ–≤, –≥–¥–Β –Ω–Ψ–¥–¥–Β―Ä–Ε–Η–≤–Α–Β―²―¹―è –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Α―è ―²–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Α, –Η–Φ–Β–Β―²―¹―è –Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–Β –Ψ―¹–≤–Β―â–Β–Ϋ–Η–Β –Η –≤–Β–Ϋ―²–Η–Μ―è―Ü–Η―è. –ü–Ψ–Φ–Β―â–Β–Ϋ–Η–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –±―΄―²―¨ –Η–Ζ–Ψ–Μ–Η―Ä–Ψ–≤–Α–Ϋ–Ψ –Ψ―² ―¹–Η–Μ―¨–Ϋ―΄―Ö ―à―É–Φ–Ψ–≤.
2. –£ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η–Η –¥–Μ―è –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Ψ–≤ (–Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η–Η) –¥–Ψ–Μ–Ε–Β–Ϋ –Ϋ–Α―Ö–Ψ–¥–Η―²―¨―¹―è –Ζ–Α–Ω–Η―Ä–Α―é―â–Η–Ι―¹―è ―à–Κ–Α―³ –¥–Μ―è ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η―è –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Ψ–≤, –Η–Ϋ―¹―²―Ä―É–Φ–Β–Ϋ―²–Α―Ä–Η―è –Η –¥–Ψ–Κ―É–Φ–Β–Ϋ―²–Α―Ü–Η–Η.
–¦–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η―è –¥–Ψ–Μ–Ε–Ϋ–Α –Η–Φ–Β―²―¨:
–Η–Ϋ―¹―²―Ä―É–Φ–Β–Ϋ―²―΄: –Η–≥–Μ―΄, ―à–Ω―Ä–Η―Ü―΄ –¥–Μ―è –Η–Ϋ―ä–Β–Κ―Ü–Η–Ι βÄ™ –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ ―Ä–Α–Ζ–Φ–Β―Ä–Α–Φ–Η –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö, ―²–Β―Ä–Φ–Ψ–Φ–Β―²―Ä –Η ―².–¥.;
–Ϋ–Α–±–Ψ―Ä –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Ψ–≤ βÄ™ –¥–Μ―è –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è –Η ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η―è –≤ –Ψ–±―è–Ζ–Α―²–Β–Μ―¨–Ϋ–Ψ–Φ –Ω–Ψ―Ä―è–¥–Κ–Β, βÄ™ –Η –Ω―Ä–Ψ―΅–Η–Β –≤–Η–¥―΄ –Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²–Ψ–≤, –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Α –Ω―Ä–Ψ–≤–Ψ–¥–Η–Φ―΄―Ö ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Ψ–≤;
–≤―¹–Ω–Ψ–Φ–Ψ–≥–Α―²–Β–Μ―¨–Ϋ―΄–Β –Ω―Ä–Η–Ϋ–Α–¥–Μ–Β–Ε–Ϋ–Ψ―¹―²–Η –¥–Μ―è –¥–Ψ―¹―²–Α–≤–Κ–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ (–Ω–Ψ–≤–Ψ–¥–Κ–Η, –Ϋ–Ψ―¹–Η–Μ–Κ–Η, ―è―â–Η–Κ–Η –Η –Ω―Ä.), –¥–Μ―è ―³–Η–Κ―¹–Α―Ü–Η–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ (–Φ―è–≥–Κ–Η–Β –Ω–Ψ–≤―è–Ζ–Κ–Η, –Ϋ–Α–Φ–Ψ―Ä–¥–Ϋ–Η–Κ–Η (―¹–Ϋ–Η–Φ–Α―é―²―¹―è –Ω–Ψ―¹–Μ–Β –¥–Α―΅–Η –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α) –Η –Ω―Ä.
3. –£ ―¹–Μ―É―΅–Α―è―Ö, –Κ–Ψ–≥–¥–Α ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―² ―²―Ä–Β–±―É–Β―² –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Α―è –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η―è –¥–Ψ–Μ–Ε–Ϋ–Α –Η–Φ–Β―²―¨ –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄–Ι –Φ–Η–Ϋ–Η–Φ―É–Φ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ–≥–Ψ –Ψ–±–Ψ―Ä―É–¥–Ψ–≤–Α–Ϋ–Η―è:
―¹―²–Ψ–Μ –¥–Μ―è ―³–Η–Κ―¹–Α―Ü–Η–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ,
–Ψ―¹–≤–Β―²–Η―²–Β–Μ―¨–Ϋ–Ψ–Β ―É―¹―²―Ä–Ψ–Ι―¹―²–≤–Ψ,
–Ϋ–Α―Ä–Κ–Ψ–Ζ–Ϋ–Ψ-–¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Α―è –Α–Ω–Ω–Α―Ä–Α―²―É―Ä–Α,
―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η–Ι –Η–Ϋ―¹―²―Ä―É–Φ–Β–Ϋ―² (―¹–Κ–Α–Μ―¨–Ω–Β–Μ–Η, –Η–≥–Μ―΄ βÄ™ –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η
―¹ ―Ä–Α–Ζ–Φ–Β―Ä–Α–Φ–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ) –Η –Ω―Ä.,
–Φ–Β–¥–Η–Κ–Α–Φ–Β–Ϋ―²―΄ –¥–Μ―è –Ω―Ä–Β–Φ–Β–¥–Η–Κ–Α―Ü–Η–Ι, –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ ―Ö–Ψ–¥–Β –Ψ–Ω–Β―Ä–Α―Ü–Η–Η, –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ –Ω–Ψ―¹–Μ–Β–Ψ–Ω–Β―Ä–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β.
–ü―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 2
–Θ–Ξ–û–î –½–ê –•–‰–£–û–Δ–ù–Ϊ–€–‰ –£ –£–‰–£–ê–†–‰–‰
(―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ–Ψ-–±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Κ–Μ–Η–Ϋ–Η–Κ–Β)
1. –Θ―¹–Μ–Ψ–≤–Η―è ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ –≤–Η–≤–Α―Ä–Η–Η –¥–Ψ–Μ–Ε–Ϋ―΄ –Ψ–±–Β―¹–Ω–Β―΅–Η–≤–Α―²―¨ –¥–Μ―è –Ϋ–Β–≥–Ψ –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄–Ι –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Ι ―³–Ψ–Ϋ.
2. –£–Α–Ε–Ϋ–Β–Ι―à–Η–Φ ―É―¹–Μ–Ψ–≤–Η–Β–Φ ―ç―²–Ψ–≥–Ψ ―è–≤–Μ―è–Β―²―¹―è:
―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ –≤–Β–Ϋ―²–Η–Μ–Η―Ä―É–Β–Φ–Ψ–Φ, –Ψ―¹–≤–Β―â–Β–Ϋ–Ϋ–Ψ–Φ, –Ψ―²–Α–Ω–Μ–Η–≤–Α–Β–Φ–Ψ–Φ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η–Η;
–Ψ–±–Β―¹–Ω–Β―΅–Β–Ϋ–Η–Β –Β–≥–Ψ –≤–Ψ–¥–Ψ–Ι –¥–Μ―è –Ω–Η―²―¨―è –Η –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄–Φ –Ω–Η―²–Α–Ϋ–Η–Β–Φ;
―¹–≤–Ψ–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Α―è ―É–±–Ψ―Ä–Κ–Α –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η―è.
–£ –≤–Η–≤–Α―Ä–Η–Η –Ϋ–Β–¥–Ψ–Ω―É―¹―²–Η–Φ―΄ –≥―Ä–Ψ–Φ–Κ–Η–Β ―Ä–Α–Ζ–≥–Ψ–≤–Ψ―Ä―΄, ―à―É–Φ.
3. –Γ–Α–Ϋ–Η―²–Α―Ä–Ϋ–Ψ-–≥–Η–≥–Η–Β–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―²―Ä–Β–±–Ψ–≤–Α–Ϋ–Η―è –Κ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η―é –≤–Η–≤–Α―Ä–Η―è –Η–Ζ–Μ–Ψ–Ε–Β–Ϋ―΄ –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É―é―â–Η―Ö ―Ä–Α–Ζ–¥–Β–Μ–Α―Ö –Γ–Α–Ϋ–Η―²–Α―Ä–Ϋ―΄―Ö –Ω―Ä–Α–≤–Η–Μ.
4. –ö–Ψ―Ä–Φ–Μ–Β–Ϋ–Η–Β –Η –≤–Ψ–¥–Ψ–Ω–Ψ–Ι –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –¥–Ψ–Μ–Ε–Ϋ―΄ –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¨―¹―è –≤ ―¹―²―Ä–Ψ–≥–Ψ–Φ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ –¥–Β–Ι―¹―²–≤―É―é―â–Η–Φ –Ω―Ä–Η–Κ–Α–Ζ–Ψ–Φ. (–ü―Ä–Η–Κ–Α–Ζ β³• 163 –Ψ―² 10 –Φ–Α―Ä―²–Α 1966 –≥. –€–Η–Ϋ–Η―¹―²―Ä–Α –Ζ–¥―Ä–Α–≤–Ψ–Ψ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η―è –Γ–Γ–Γ–†).
–ù–Α –Κ–Ψ―Ä–Φ–Κ―É―Ö–Ϋ–Β –≤–Η–≤–Α―Ä–Η―è –¥–Ψ–Μ–Ε–Ϋ―΄ –±―΄―²―¨ –≤―΄–≤–Β―à–Β–Ϋ―΄ –Ϋ–Ψ―Ä–Φ―΄ –Κ–Ψ―Ä–Φ–Μ–Β–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Η –≤―΄―Ö–Ψ–¥ –Ω―Ä–Ψ–¥―É–Κ―²–Ψ–≤ (–≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Η –≤–Α―Ä–Β–Ϋ―΄―Ö –Κ–Ψ―Ä–Φ–Ψ–≤) –¥–Μ―è –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –≤―¹–Β―Ö –≤–Η–¥–Ψ–≤, ―¹–Ψ–¥–Β―Ä–Ε–Α―â–Η―Ö―¹―è –≤ –≤–Η–≤–Α―Ä–Η–Η, –Α ―²–Α–Κ–Ε–Β ―É–Κ–Α–Ζ–Α–Ϋ–Η–Β ―΅–Α―¹–Ψ–≤, –≤ –Κ–Ψ―²–Ψ―Ä―΄–Β –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¹―è –Κ–Ψ―Ä–Φ–Μ–Β–Ϋ–Η–Β –Η ―¹–Φ–Β–Ϋ–Α –≤–Ψ–¥―΄ –≤ –Ω–Ψ–Η–Μ–Κ–Α―Ö.
–£―΄–¥–Α―΅–Α –Κ–Ψ―Ä–Φ–Ψ–≤ –¥–Ψ–Μ–Ε–Ϋ–Α –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¨―¹―è –Ζ–Α–≤–Β–¥―É―é―â–Η–Φ ―¹–Κ–Μ–Α–¥–Ψ–Φ (―³―É―Ä–Α–Ε–Ψ―Ä–Ψ–Φ) ―¹ –≤–Β―¹–Α. –ö–Α–Ε–¥―΄–Ι ―Ä–Α–±–Ψ―΅–Η–Ι –Ψ–±―è–Ζ–Α–Ϋ ―Ä–Α―¹–Ω–Η―¹―΄–≤–Α―²―¨―¹―è –≤ –Ε―É―Ä–Ϋ–Α–Μ–Β –Ζ–Α –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄–Β –Η–Φ –Κ–Ψ―Ä–Φ–Α. –£―΄–¥–Α–≤–Α–Β–Φ―΄–Β –Κ–Ψ―Ä–Φ–Α –¥–Ψ–Μ–Ε–Ϋ―΄ –Ψ―²–≤–Β―΅–Α―²―¨ –Ϋ–Ψ―Ä–Φ–Α–Φ –Ω–Ψ –≤–Β―¹―É, –Α―¹―¹–Ψ―Ä―²–Η–Φ–Β–Ϋ―²―É –Η –Κ–Α―΅–Β―¹―²–≤―É. –£–Ψ –≤―¹–Β―Ö –Κ–Μ–Β―²–Κ–Α―Ö –¥–Ψ–Μ–Ε–Ϋ―΄ –Ϋ–Α―Ö–Ψ–¥–Η―²―¨―¹―è –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ–Ψ –Ϋ–Β–Ψ–Ω―Ä–Ψ–Κ–Η–¥―΄–≤–Α―é―â–Η–Β―¹―è –Ω–Ψ–Η–Μ–Κ–Η ―¹–Ψ ―¹–≤–Β–Ε–Β–Ι –≤–Ψ–¥–Ψ–Ι. –†–Β–Ε–Η–Φ –Κ–Ψ―Ä–Φ–Μ–Β–Ϋ–Η―è –≤ –≤―΄―Ö–Ψ–¥–Ϋ―΄–Β –Η –Ω―Ä–Α–Ζ–¥–Ϋ–Η―΅–Ϋ―΄–Β –¥–Ϋ–Η –¥–Ψ–Μ–Ε–Β–Ϋ –±―΄―²―¨ ―²–Α–Κ–Η–Φ –Ε–Β, –Κ–Α–Κ –≤ –±―É–¥–Ϋ–Η.
5. –†–Α–Ζ–Φ–Β―Ä –Κ–Μ–Β―²–Ψ–Κ –¥–Μ―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö (–Κ―Ä–Ψ–Φ–Β –Ψ–±–Β–Ζ―¨―è–Ϋ) –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É―é―â–Β–Φ ―Ä–Α–Ζ–¥–Β–Μ–Β –Γ–Α–Ϋ–Η―²–Α―Ä–Ϋ―΄―Ö –Ω―Ä–Α–≤–Η–Μ, –Ϋ–Ψ –Ψ–Ϋ –¥–Ψ–Μ–Ε–Β–Ϋ –Ψ–±–Β―¹–Ω–Β―΅–Η–≤–Α―²―¨ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–Β –Ω–Β―Ä–Β–¥–≤–Η–Ε–Β–Ϋ–Η–Β. –€–Β–Μ–Κ–Η―Ö –Ψ–±–Β–Ζ―¨―è–Ϋ (–Φ–Α–Κ–Α–Κ–Η –Η –¥―Ä.) ―¹–Μ–Β–¥―É–Β―² ―¹–Ψ–¥–Β―Ä–Ε–Α―²―¨ –Ω–Ψ –Ψ–¥–Ϋ–Ψ–Ι –≤ –Κ–Μ–Β―²–Κ–Α―Ö ―¹ –Ω―Ä–Η–Ε–Η–Φ–Ϋ―΄–Φ ―É―¹―²―Ä–Ψ–Ι―¹―²–≤–Ψ–Φ ―Ä–Α–Ζ–Φ–Β―Ä–Ψ–Φ –Ϋ–Β –Φ–Β–Ϋ–Β–Β ―΅–Β–Φ 1,5 x 1,5 x 1,5 –Φ. –ö―Ä―É–Ω–Ϋ―΄–Β –Ψ–±–Β–Ζ―¨―è–Ϋ―΄ ―¹–Ψ–¥–Β―Ä–Ε–Α―²―¹―è –≤ –Κ–Ψ–Φ–Ϋ–Α―²–Α―Ö-–≤–Ψ–Μ―¨–Β―Ä–Α―Ö. –Δ–Β–Φ–Ω–Β―Ä–Α―²―É―Ä–Α –≤–Ψ–Ζ–¥―É―Ö–Α –≤ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η–Η –¥–Μ―è –Ψ–±–Β–Ζ―¨―è–Ϋ –¥–Ψ–Μ–Ε–Ϋ–Α –±―΄―²―¨ –Ϋ–Β –Ϋ–Η–Ε–Β +25 –≥―Ä–Α–¥. –Γ. –Γ–Ψ–±–Α–Κ–Η –≤ ―Ö―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Ψ–Φ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Β –¥–Ψ–Μ–Ε–Ϋ―΄ –≤―΄–≤–Ψ–¥–Η―²―¨―¹―è –Η–Ζ –Κ–Μ–Β―²–Ψ–Κ –¥–Μ―è –≤―΄–≥―É–Μ–Α.
–ü―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 3
–ü–û–†–·–î–û–ö –ü–†–û–£–ï–î–ï–ù–‰–· –ü–†–û–Π–ï–î–Θ–† –ù–ê –•–‰–£–û–Δ–ù–Ϊ–Ξ
I. –ü–Ψ–¥–≥–Ψ―²–Ψ–≤–Κ–Α –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Κ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²―É
1. –£ –Ω–Β―Ä–Η–Ψ–¥ –≤–≤–Β–¥–Β–Ϋ–Η―è –≤ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―² –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Α–¥–Α–Ω―²–Η―Ä–Ψ–≤–Α―²―¨―¹―è –Κ –Ψ–±―¹―²–Α–Ϋ–Ψ–≤–Κ–Β –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η–Η –Η –Ω―Ä–Η–≤―΄–Κ–Ϋ―É―²―¨ –Κ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α―²–Ψ―Ä―É.
2. –ü―Ä–Η –¥–Ψ―¹―²–Α–≤–Κ–Β –≤ –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η―é –Κ―Ä―É–Ω–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Ζ–Α–Ω―Ä–Β―â–Α–Β―²―¹―è –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―¹–Η–Μ–Ψ–≤―΄―Ö –Η–Μ–Η –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄―Ö –Ω―Ä–Η–Β–Φ–Ψ–≤. –£ ―¹–Μ―É―΅–Α–Β –Α–≥―Ä–Β―¹―¹–Η–≤–Ϋ―΄―Ö –Η–Μ–Η –Η―¹―²–Β―Ä–Η―΅–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Φ–Ψ–Ε–Ϋ–Ψ ―¹–¥–Β–Μ–Α―²―¨ –Ω―Ä–Β–¥–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ―É―é –Ω―Ä–Β–Φ–Β–¥–Η–Κ–Α―Ü–Η―é ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –±–Β–Ζ―΄–≥–Ψ–Μ―¨–Ϋ―΄―Ö –Η–Ϋ―ä–Β–Κ―²–Ψ―Ä–Ψ–≤ ―¹ ―É–¥–Μ–Η–Ϋ–Β–Ϋ–Ϋ–Ψ–Ι –Ϋ–Α―¹–Α–¥–Κ–Ψ–Ι.
3. –€–Β–Μ–Κ–Η―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö (–≥―Ä―΄–Ζ―É–Ϋ–Ψ–≤ –Η –Ω―Ä.) ―¹–Μ–Β–¥―É–Β―² –±―Ä–Α―²―¨ –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ, –Ω―Ä–Η–Φ–Β–Ϋ―è―²―¨ –Κ–Ψ―Ä–Ϋ―Ü–Α–Ϋ–≥–Η ―²–Ψ–Μ―¨–Κ–Ψ ―¹ ―Ä–Β–Ζ–Η–Ϋ–Ψ–≤―΄–Φ–Η –Ϋ–Α―¹–Α–¥–Κ–Α–Φ–Η, –Ϋ–Β ―¹–Ε–Η–Φ–Α―²―¨ –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö ―¹–Η–Μ―¨–Ϋ–Ψ ―Ä―É–Κ–Α–Φ–Η, ―΅―²–Ψ –Ω―Ä–Η―΅–Η–Ϋ―è–Β―² –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ ―²―Ä–Α–≤–Φ―΄ –Η –±–Ψ–Μ―¨. (–Γ–Φ. –û.–ù. –ï–Μ–Η–Ζ–Α―Ä–Ψ–≤–Α –Η ―¹–Ψ–Α–≤―². –ü–Ψ―¹–Ψ–±–Η–Β –Ω–Ψ ―²–Ψ–Κ―¹–Η–Κ–Ψ–Μ–Ψ–≥–Η–Η –¥–Μ―è –Μ–Α–±–Ψ―Ä–Α–Ϋ―²–Ψ–≤. –€., 1974). –½–Α–Ω―Ä–Β―â–Α–Β―²―¹―è –Ψ―¹―²–Α–≤–Μ―è―²―¨ –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –≤ –Ψ–Ε–Η–¥–Α–Ϋ–Η–Η ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α –±–Ψ–Μ―¨―à–Β, ―΅–Β–Φ ―ç―²–Ψ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –¥–Μ―è –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è –Ω―Ä–Β–Φ–Β–¥–Η–Κ–Α―Ü–Η–Η.
5. –½–Α–Ω―Ä–Β―â–Α–Β―²―¹―è –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η―²―¨ –Φ–Β–Μ–Κ–Η―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Ω–Ψ ―Ö–Ψ–Μ–Ψ–¥―É –≤ –Ϋ–Β―É―²–Β–Ω–Μ–Β–Ϋ–Ϋ―΄―Ö –Κ–Μ–Β―²–Κ–Α―Ö.
II. –ü―Ä–Β–Φ–Β–¥–Η–Κ–Α―Ü–Η―è. –Λ–Η–Κ―¹–Α―Ü–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ
1. –ü―Ä–Β–Φ–Β–¥–Η–Κ–Α―Ü–Η―è –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¹―è –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ –Ζ–Α ―Ä–Α–±–Ψ―²―É ―¹ –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ –Μ–Η―Ü–Ψ–Φ –Η–Μ–Η –Ω–Ψ–¥ –Β–≥–Ψ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η–Β–Φ.
2. –ï―¹–Μ–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –Η―¹–Ω―É–≥–Α–Ϋ–Ψ –Η–Μ–Η ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α –Ϋ–Α―¹―²―É–Ω–Α–Β―² –Ϋ–Β ―¹―Ä–Α–Ζ―É, ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α―²–Ψ―Ä –¥–Ψ–Μ–Ε–Β–Ϋ –Ε–¥–Α―²―¨, –Ω–Ψ–Κ–Α –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –Ϋ–Β ―É―¹–Ω–Ψ–Κ–Ψ–Η―²―¹―è –Η–Μ–Η –Ϋ–Β –Ζ–Α―¹–Ϋ–Β―².
3. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –Φ–Ψ–Ε–Ϋ–Ψ ―³–Η–Κ―¹–Η―Ä–Ψ–≤–Α―²―¨ ―²–Ψ–Μ―¨–Κ–Ψ –Ω–Ψ―¹–Μ–Β ―²–Ψ–≥–Ψ, –Κ–Α–Κ –Ω–Ψ–¥–Β–Ι―¹―²–≤―É–Β―² –Ϋ–Α―Ä–Κ–Ψ–Ζ.
4. –ü―Ä–Η –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Η –Ω―Ä–Ψ―Ü–Β–¥―É―Ä, –Κ–Ψ―²–Ψ―Ä―΄–Β ―²―Ä–Β–±―É―é―² –Η–Φ–Φ–Ψ–±–Η–Μ–Η–Ζ–Α―Ü–Η–Η –±–Ψ–¥―Ä―¹―²–≤―É―é―â–Η―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö, ―Ä–Α–Ζ―Ä–Β―à–Α–Β―²―¹―è –Ω―Ä–Η–≤―è–Ζ―΄–≤–Α―²―¨ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –Κ –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–Ι –¥–Ψ―¹–Κ–Β ―²–Ψ–Μ―¨–Κ–Ψ –Ϋ–Α –Ϋ–Β–Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤―Ä–Β–Φ―è. –î–Μ―è –Η–Φ–Φ–Ψ–±–Η–Μ–Η–Ζ–Α―Ü–Η–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Ϋ–Α –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤―Ä–Β–Φ―è ―¹–Μ–Β–¥―É–Β―² –Ω―Ä–Η–Φ–Β–Ϋ―è―²―¨ ―è―â–Η–Κ–Η-–¥–Ψ–Φ–Η–Κ–Η –Η ―â–Η―²–Κ–Η-–Ψ―à–Β–Ι–Ϋ–Η–Κ–Η.
5. –ü–Ψ―¹–Μ–Β ―³–Η–Κ―¹–Α―Ü–Η–Η ―¹–Ψ–±–Α–Κ ―¹ –Ϋ–Η―Ö ―¹–Ϋ–Η–Φ–Α―é―²―¹―è –Ω–Ψ–≤―è–Ζ–Κ–Η-–Ϋ–Α–Φ–Ψ―Ä–¥–Ϋ–Η–Κ–Η.
6. –ü–Ψ–≤―è–Ζ–Κ–Η –Ϋ–Α –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²―è―Ö –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –¥–Ψ–Μ–Ε–Ϋ―΄ –±―΄―²―¨ –Φ―è–≥–Κ–Η–Φ–Η, –Ϋ–Β –Ω―Ä–Β–Ω―è―²―¹―²–≤–Ψ–≤–Α―²―¨ –Κ―Ä–Ψ–≤–Ψ–Ψ–±―Ä–Α―â–Β–Ϋ–Η―é; –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É –Ϋ–Β –¥–Ψ–Μ–Ε–Ϋ–Α –±―΄―²―¨ –Ω―Ä–Η–¥–Α–Ϋ–Α –Ϋ–Β―É–¥–Ψ–±–Ϋ–Α―è –Ω–Ψ–Ζ–Α ―¹ –≤―΄–≤–Β―Ä–Ϋ―É―²―΄–Φ–Η –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²―è–Φ–Η.
7. –ü―Ä–Η –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η–Η –±–Ψ–¥―Ä―¹―²–≤―É―é―â–Β–≥–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ ―¹―²–Β―Ä–Β–Ψ―²–Α–Κ―¹–Η―΅–Β―¹–Κ–Η–Ι –Α–Ω–Ω–Α―Ä–Α―² –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –Ω―Ä–Ψ–≤–Β―¹―²–Η –Φ–Β―¹―²–Ϋ–Ψ–Β –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η–Β ―É―΅–Α―¹―²–Κ–Ψ–≤ –≥–Ψ–Μ–Ψ–≤―΄, –Ω–Ψ–¥–≤–Β―Ä–≥–Α―é―â–Η―Ö―¹―è ―¹–¥–Α–≤–Μ–Β–Ϋ–Η―é.
III. –û–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η–Β
1. –ü–Ψ―¹–Μ–Β –¥–Α―΅–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ –Ω–Ψ―¹―²–Ψ―è–Ϋ–Ϋ―΄–Ι –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ ―¹–Ψ ―¹―²–Ψ―Ä–Ψ–Ϋ―΄ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α―²–Ψ―Ä–Α (–Η–Μ–Η –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥–Α) –Ζ–Α ―É―Ä–Ψ–≤–Ϋ–Β–Φ –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α. –ü―Ä–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Η –Φ–Η–Ψ―Ä–Β–Μ–Α–Κ―¹–Α–Ϋ―²–Ψ–≤ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥―É–Β―²―¹―è ―¹–Η―¹―²–Β–Φ–Α―²–Η―΅–Β―¹–Κ–Ψ–Β –≤―΄–≤–Β–¥–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Η–Ζ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Ψ–±–Β–Ζ–¥–≤–Η–Ε–Β–Ϋ–Η―è –¥–Μ―è –Ω―Ä–Ψ–≤–Β―Ä–Κ–Η ―É―Ä–Ψ–≤–Ϋ―è –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α. –ü―Ä–Η –Ω–Β―Ä–≤―΄―Ö –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Α―Ö –Ψ―¹–Μ–Α–±–Μ–Β–Ϋ–Η―è –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α –Ψ–Ϋ –¥–Ψ–Μ–Ε–Β–Ϋ –±―΄―²―¨ ―É–≥–Μ―É–±–Μ–Β–Ϋ. –½–Α–Ω―Ä–Β―â–Α–Β―²―¹―è –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―¹―Ä–Β–¥―¹―²–≤, –Ω―Ä–Β–Ω―è―²―¹―²–≤―É―é―â–Η―Ö –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―é –Ζ–Α ―É―Ä–Ψ–≤–Ϋ–Β–Φ –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α: –Α―³–Ψ–Ϋ–Η–Η, –Ζ–Α–≤―è–Ζ―΄–≤–Α–Ϋ–Η―è –Φ–Ψ―Ä–¥―΄ –Η ―².–¥.
2. –£―¹–Β ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²―΄ ―¹ –Ϋ–Α–Ϋ–Β―¹–Β–Ϋ–Η–Β–Φ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄―Ö –Ψ―â―É―â–Β–Ϋ–Η–Ι, –≤–Κ–Μ―é―΅–Α―è ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²―΄ –Ω–Ψ –Η–Ζ―É―΅–Β–Ϋ–Η―é ―à–Ψ–Κ–Α, –¥–Ψ–Μ–Ε–Ϋ―΄ –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨―¹―è ―¹ –Ψ―²–Κ–Μ―é―΅–Β–Ϋ–Η–Β–Φ ―¹–Ψ–Ζ–Ϋ–Α–Ϋ–Η―è ―É –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ. –î–Ψ–Ω―É―¹–Κ–Α–Β―²―¹―è –Ϋ–Α–Ϋ–Β―¹–Β–Ϋ–Η–Β –Ω–Ψ―Ä–Ψ–≥–Ψ–≤–Ψ–Ι –±–Ψ–Μ–Η –Ω―Ä–Η –Η–Ζ―É―΅–Β–Ϋ–Η–Η –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Α –±–Ψ–Μ–Η –Η –≤–Μ–Η―è–Ϋ–Η―è –Ϋ–Α –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ –Α–Ϋ–Α–Μ―¨–≥–Β―²–Η–Κ–Ψ–≤ –Η –Α–Ϋ–Β―¹―²–Β―²–Η–Κ–Ψ–≤. –ü–Ψ―Ä–Ψ–≥ –±–Ψ–Μ–Η –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Β―²―¹―è –Η–Ϋ–¥–Η–≤–Η–¥―É–Α–Μ―¨–Ϋ–Ψ –¥–Μ―è –Κ–Α–Ε–¥–Ψ–≥–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ; –Κ―Ä–Η―²–Β―Ä–Η–Β–Φ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Ω–Ψ―Ä–Ψ–≥–Ψ–≤–Ψ–≥–Ψ –±–Ψ–Μ–Β–≤–Ψ–≥–Ψ –Ψ―â―É―â–Β–Ϋ–Η―è ―¹–Μ–Β–¥―É–Β―² ―¹―΅–Η―²–Α―²―¨ ―Ä–Β–Α–Κ―Ü–Η―é –Η–Ζ–±–Β–≥–Α–Ϋ–Η―è: –Ψ―²–¥–Β―Ä–≥–Η–≤–Α–Ϋ–Η–Β –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Η, –Ω–Β―Ä–Β–Φ–Β–Ϋ―É –Φ–Β―¹―²–Α, –Ω―Ä―΄–Ε–Ψ–Κ. –ù–Α–Ϋ–Β―¹–Β–Ϋ–Η–Β –±–Ψ–Μ–Β–≤―΄―Ö ―Ä–Α–Ζ–¥―Ä–Α–Ε–Β–Ϋ–Η–Ι, –≤―΄–Ζ―΄–≤–Α―é―â–Η―Ö –≥–Ψ–Μ–Ψ―¹–Ψ–≤―É―é –Η –Α–Κ―²–Η–≤–Ϋ―É―é –¥–≤–Η–≥–Α―²–Β–Μ―¨–Ϋ―É―é (–Ψ–±–Ψ―Ä–Ψ–Ϋ–Η―²–Β–Μ―¨–Ϋ―É―é) ―Ä–Β–Α–Κ―Ü–Η–Η –Ζ–Α–Ω―Ä–Β―â–Α–Β―²―¹―è. –ü–Ψ―Ä–Ψ–≥–Ψ–≤―΄–Β –±–Ψ–Μ–Β–≤―΄–Β ―Ä–Α–Ζ–¥―Ä–Α–Ε–Β–Ϋ–Η―è –Ϋ–Α–Ϋ–Ψ―¹―è―²―¹―è –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–≥–Ψ –Ω–Ψ–≤–Β–¥–Β–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ. –ù–Α–Ϋ–Ψ―¹–Η–Φ–Α―è –Ω–Ψ―Ä–Ψ–≥–Ψ–≤–Α―è –±–Ψ–Μ―¨ –¥–Ψ–Μ–Ε–Ϋ–Α –±―΄―²―¨ –Ϋ–Β–Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι. –†–Α–Ζ–≤–Η―²–Η–Β ―¹―²―Ä–Β―¹―¹–Ψ–≤―΄―Ö ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Ι ―É –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Β –±–Ψ–Μ–Β–≤―΄―Ö ―Ä–Α–Ζ–¥―Ä–Α–Ε–Β–Ϋ–Η–Ι –Η –¥―Ä―É–≥–Η―Ö –Φ―É―΅–Η―²–Β–Μ―¨–Ϋ―΄―Ö ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Ι –Ϋ–Β–¥–Ψ–Ω―É―¹―²–Η–Φ–Ψ.
3. –ü―Ä–Η –±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Φ ―²–Β―¹―²–Η―Ä–Ψ–≤–Α–Ϋ–Η–Η –Η –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤–Β –Φ–Β–¥–Η–Κ–Ψ-–±–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –≤―¹–Β –Ω―Ä–Ψ―Ü–Β–¥―É―Ä―΄ –Ω―Ä–Ψ–≤–Ψ–¥―è―²―¹―è –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö ―â–Α–Ε–Β–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ; –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄–Β –Ω―Ä–Ψ―Ü–Β–¥―É―Ä―΄ –Ω―Ä–Η –Φ–Α―Ä–Κ–Η―Ä–Ψ–≤–Κ–Β –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö (–Ψ―²―Ä–Β–Ζ–Α–Ϋ–Η–Β –Ϋ–Ψ–≥―²–Β–≤―΄―Ö ―³–Α–Μ–Α–Ϋ–≥ –Η –¥―Ä.), –Ω―Ä–Η –≤–Ζ―è―²–Η–Η –Κ―Ä–Ψ–≤–Η, –Ω―Ä–Η –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η–Η –Ϋ–Α ―¹–Μ–Η–Ζ–Η―¹―²―É―é –≥–Μ–Α–Ζ–Α –Η ―². –¥. –¥–Ψ–Μ–Ε–Ϋ―΄ –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨―¹―è –Ω–Ψ–¥ –Φ–Β―¹―²–Ϋ–Ψ–Ι –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Β–Ι –Η–Μ–Η –¥―Ä―É–≥–Ψ–≥–Ψ ―Ä–Ψ–¥–Α –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η–Β–Φ.
4. –î–Ψ–Ζ―΄ –Η –≤―Ä–Β–Φ―è –≤–≤–Β–¥–Β–Ϋ–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –¥–Ψ–Μ–Ε–Ϋ―΄ ―³–Η–Κ―¹–Η―Ä–Ψ–≤–Α―²―¨―¹―è –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É―é―â–Η―Ö –¥–Ψ–Κ―É–Φ–Β–Ϋ―²–Α―Ö (–Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α).
IV. –Θ―Ö–Ψ–¥ –Ζ–Α –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ–Η –≤ –Ω–Ψ―¹–Μ–Β–Ψ–Ω–Β―Ä–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–Φ –Ω–Β―Ä–Η–Ψ–¥–Β
1. –ü―Ä–Η –¥–Ψ―¹―²–Α–≤–Κ–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ –Κ–Μ–Β―²–Κ―É –Ω–Ψ―¹–Μ–Β –Ψ–Ω–Β―Ä–Α―Ü–Η–Η –¥–Ψ–Μ–Ε–Ϋ―΄ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨―¹―è ―É–¥–Ψ–±–Ϋ―΄–Β –Ϋ–Ψ―¹–Η–Μ–Κ–Η, –Η―¹–Κ–Μ―é―΅–Α―é―â–Η–Β –Ϋ–Α–Ϋ–Β―¹–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Φ―É ―²―Ä–Α–≤–Φ, ―¹–¥–≤–Η–≥–Α–Ϋ–Η―è –Ω–Ψ–≤―è–Ζ–Ψ–Κ. –£ ―¹–Μ―É―΅–Α–Β –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –Φ–Η–Ψ―Ä–Β–Μ–Α–Κ―¹–Α–Ϋ―²–Ψ–≤ –Η –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –¥―΄―Ö–Α–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ψ―¹―²–Α–≤–Α―²―¨―¹―è –≤ –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Η–Η –¥–Ψ –Ω–Ψ–Μ–Ϋ–Ψ–≥–Ψ –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η―è –¥―΄―Ö–Α–Ϋ–Η―è. –™―Ä―΄–Ζ―É–Ϋ―΄, –Ω–Ψ–Μ―É―΅–Η–≤―à–Η–Β ―²―Ä–Α–≤–Φ―΄, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, –Ω―Ä–Η –≤–Ζ―è―²–Η–Η –Κ―Ä–Ψ–≤–Η –Η–Ζ ―Ö–≤–Ψ―¹―²–Α, –Ψ―²―¹–Α–Ε–Η–≤–Α―é―²―¹―è –≤ –Ψ―²–¥–Β–Μ―¨–Ϋ―É―é –Κ–Μ–Β―²–Κ―É –≤–Ψ –Η–Ζ–±–Β–Ε–Α–Ϋ–Η–Β –Ω–Ψ–Κ―É―¹–Ψ–≤.
2. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –≤ ―Ö―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Ψ–Φ –Ψ–Ω―΄―²–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –±―΄―²―¨ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Ψ –≤ ―É–¥–Ψ–±–Ϋ―É―é –Κ–Μ–Β―²–Κ―É, –Ψ–±–Μ–Β–≥―΅–Α―é―â―É―é ―²–Α–Κ–Ε–Β ―É―¹–Μ–Ψ–≤–Η―è –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –Η ―É―Ö–Ψ–¥–Α –Ζ–Α –Ε–Η–≤–Ψ―²–Ϋ―΄–Φ. –Γ –Φ–Ψ–Φ–Β–Ϋ―²–Α –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è ―É –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –±–Ψ–Μ–Β–Ι, –Ψ–Ϋ–Ψ –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ω–Ψ–Μ―É―΅–Α―²―¨ ―¹–Β–¥–Α―²–Η–≤–Ϋ―΄–Β –Η –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α―é―â–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²―΄. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ω–Ψ–Μ―É―΅–Α―²―¨ –Κ–≤–Α–Μ–Η―³–Η―Ü–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι ―É―Ö–Ψ–¥ –Ω–Ψ–¥ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Β–Φ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α―²–Ψ―Ä–Α.
3. –ü–Ψ―¹–Μ–Β –Ψ―¹–Ψ–±–Ψ ―¹–Μ–Ψ–Ε–Ϋ―΄―Ö –Η –Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Ψ–Ω–Β―Ä–Α―Ü–Η–Ι ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥―É–Β―²―¹―è –Ω–Β―Ä–≤―΄–Β ―¹―É―²–Κ–Η ―É―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α―²―¨ –Κ―Ä―É–≥–Μ–Ψ―¹―É―²–Ψ―΅–Ϋ–Ψ–Β –¥–Β–Ε―É―Ä―¹―²–≤–Ψ –Ψ–Κ–Ψ–Μ–Ψ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ.
4. –Γ–Ψ―¹―²–Ψ―è–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Η –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –¥–Ψ–Μ–Ε–Ϋ―΄ –Ψ―²–Φ–Β―΅–Α―²―¨―¹―è –≤ –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ–Β ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α.
–ü―Ä–Η–Μ–Ψ–Ε–Β–Ϋ–Η–Β β³• 4
–ü–û–†–·–î–û–ö –ü–†–û–£–ï–î–ï–ù–‰–· –≠–£–Δ–ê–ù–ê–½–‰–‰
(–Θ–€–ï–†–©–£–¦–ï–ù–‰–· –•–‰–£–û–Δ–ù–û–™–û)
1. –™―É–Φ–Α–Ϋ–Ϋ―΄–Φ ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β–Φ –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ (―ç–≤―²–Α–Ϋ–Α–Ζ–Η–Β–Ι) –Ϋ–Α–Ζ―΄–≤–Α–Β―²―¹―è –±―΄―¹―²―Ä–Ψ–Β –Η –±–Β–Ζ–±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ–Ψ–Β ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ, –Ϋ–Β ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α―é―â–Β–Β―¹―è ―É –Ϋ–Β–≥–Ψ ―΅―É–≤―¹―²–≤–Ψ–Φ ―²―Ä–Β–≤–Ψ–≥–Η –Η ―¹―²―Ä–Α―Ö–Α.
2. –•–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ω–Ψ–Μ―É―΅–Α―²―¨ –Α–¥–Β–Κ–≤–Α―²–Ϋ―΄–Ι ―É―Ö–Ψ–¥ (–Α–Ϋ–Β―¹―²–Β―²–Η–Κ–Η, –Ω–Η―²–Α–Ϋ–Η–Β, –Ω–Ψ–Β–Ϋ–Η–Β –Η ―². –Ω.) –≤–Ω–Μ–Ψ―²―¨ –¥–Ψ ―¹–Α–Φ–Ψ–≥–Ψ –Φ–Ψ–Φ–Β–Ϋ―²–Α –Β–≥–Ψ ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η―è.
3. –Θ–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Ϋ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¨―¹―è –≤ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η–Η, –≥–¥–Β ―¹–Ψ–¥–Β―Ä–Ε–Α―²―¹―è –Ε–Η–≤–Ψ―²–Ϋ―΄–Β, –Ζ–Α–Ω―Ä–Β―â–Α–Β―²―¹―è ―É–Φ–Β―Ä―â–≤–Μ―è―²―¨ –Ψ–¥–Ϋ–Η―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö –Ϋ–Α –≥–Μ–Α–Ζ–Α―Ö ―É –¥―Ä―É–≥–Η―Ö.
4. –£ –Ψ―¹―²―Ä―΄―Ö –Ψ–Ω―΄―²–Α―Ö –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ ―É–Φ–Β―Ä―â–≤–Μ―è―²―¨―¹―è –¥–Ψ –Ω―Ä–Β–Κ―Ä–Α―â–Β–Ϋ–Η―è –¥–Β–Ι―¹―²–≤–Η―è –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α. –£–Ψ –≤―¹–Β―Ö ―¹–Μ―É―΅–Α―è―Ö –Ε–Η–≤–Ψ―²–Ϋ–Ψ–Β –¥–Ψ–Μ–Ε–Ϋ–Ψ ―É–Φ–Β―Ä―â–≤–Μ―è―²―¨―¹―è ―¹–≤–Ψ–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ βÄ™ –¥–Ψ –Ϋ–Α―¹―²―É–Ω–Μ–Β–Ϋ–Η―è ―É –Ϋ–Β–≥–Ψ –±–Ψ–Μ–Β–Ζ–Ϋ–Β–Ϋ–Ϋ―΄―Ö ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Ι.
5. –û–Ω―²–Η–Φ–Α–Μ―¨–Ϋ―΄–Φ –Η ―É–Ϋ–Η–≤–Β―Ä―¹–Α–Μ―¨–Ϋ―΄–Φ –Φ–Β―²–Ψ–¥–Ψ–Φ ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η―è –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö ―è–≤–Μ―è–Β―²―¹―è –Ω–Β―Ä–Β–¥–Ψ–Ζ–Η―Ä–Ψ–≤–Κ–Α –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α βÄ™ –≤–≤–Β–¥–Β–Ϋ–Η–Β –Α–Ϋ–Β―¹―²–Β―²–Η–Κ–Α –≤ –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ–Ι –¥–Ψ–Ζ–Β (–¥–Ψ–Ζ–Η―Ä–Ψ–≤–Κ–Α –¥–Μ―è –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α –Ξ 3).
6. –ü―Ä–Η ―¹–Ψ–±–Μ―é–¥–Β–Ϋ–Η–Η ―ç―²–Η―Ö ―É―¹–Μ–Ψ–≤–Η–Ι –¥–Ψ–Ω―É―¹―²–Η–Φ–Ψ ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –¥―Ä―É–≥–Η–Φ–Η –Φ–Β―²–Ψ–¥–Α–Φ–Η:
–Φ–Β–Μ–Κ–Η―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö: –Φ―΄―à–Β–Ι, –Κ―Ä―΄―¹, –Μ―è–≥―É―à–Β–Κ, –Ω―²–Η―Ü –Η ―².–¥. βÄ™ –Ω―É―²–Β–Φ –¥–Β–Κ–Α–Ω–Η―²–Α―Ü–Η–Η;
–Κ―Ä–Ψ–Μ–Η–Κ–Ψ–≤ βÄ™ –Ω―É―²–Β–Φ –≤–Ψ–Ζ–¥―É―à–Ϋ–Ψ–Ι ―ç–Φ–±–Ψ–Μ–Η–Η;
–Κ―Ä―É–Ω–Ϋ―΄―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö: –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö ―¹–Ψ–±–Α–Κ, ―¹–≤–Η–Ϋ–Β–Ι –Η –Ω―Ä. βÄ™ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ω―Ä–Ψ–Ω―É―¹–Κ–Α–Ϋ–Η―è ―ç–Μ–Β–Κ―²―Ä–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―²–Ψ–Κ–Α, –Ω―Ä–Η ―ç―²–Ψ–Φ ―ç–Μ–Β–Κ―²―Ä–Ψ–¥―΄ –≤–≤–Ψ–¥―è―²―¹―è –≤ –Ψ–±–Μ–Α―¹―²―¨ –Ω―Ä–Ψ–¥–Ψ–Μ–≥–Ψ–≤–Α―²–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α –Η –≤ –Ψ–±–Μ–Α―¹―²―¨ –Κ―Ä–Β―¹―²―Ü–Α.
7. –ü―Ä–Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η –Η–Ζ―É―΅–Α―²―¨ ―É–Μ―¨―²―Ä–Α―¹―²―Ä―É–Κ―²―É―Ä―É –Φ–Ψ–Ζ–≥–Α –Ω―Ä–Η–Φ–Β–Ϋ―è―é―²―¹―è –Φ–≥–Ϋ–Ψ–≤–Β–Ϋ–Ϋ―΄–Β –Φ–Β―²–Ψ–¥―΄ ―ç–≤―²–Α–Ϋ–Α–Ζ–Η–Η (–Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, –Φ–≥–Ϋ–Ψ–≤–Β–Ϋ–Ϋ–Ψ–Β –Ζ–Α–Φ–Ψ―Ä–Α–Ε–Η–≤–Α–Ϋ–Η–Β –Ω―Ä–Η –Ω–Ψ–≥―Ä―É–Ε–Β–Ϋ–Η–Η –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –≤ –Ε–Η–¥–Κ–Η–Ι –Α–Ζ–Ψ―²). –‰―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –≤ ―ç―²–Ψ–Φ ―¹–Μ―É―΅–Α–Β ―ç–Μ–Β–Κ―²―Ä–Ψ―²–Ψ–Κ–Α –Ϋ–Β–¥–Ψ–Ω―É―¹―²–Η–Φ–Ψ.
–ï―¹–Μ–Η –Ω―Ä–Β–¥―É―¹–Φ–Α―²―Ä–Η–≤–Α–Β―²―¹―è –Φ–Ψ―Ä―³–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Ι –Α–Ϋ–Α–Μ–Η–Ζ ―²–Κ–Α–Ϋ–Β–Ι –Φ–Ψ–Ζ–≥–Α ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ ―¹–≤–Β―²–Ψ–≤–Ψ–≥–Ψ –Φ–Η–Κ―Ä–Ψ―¹–Κ–Ψ–Ω–Α, ―²–Ψ –¥–Μ―è ―ç–≤―²–Α–Ϋ–Α–Ζ–Η–Η –¥–Ψ–Μ–Ε–Ϋ―΄ –Ω―Ä–Η–Φ–Β–Ϋ―è―²―¨―¹―è –Α–Ϋ–Β―¹―²–Β―²–Η–Κ–Η.
8. –î–Ψ–Ω―É―¹–Κ–Α–Β―²―¹―è ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö, –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β–Φ―΄―Ö –≤ –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―Ü–Β–Μ―è―Ö, –Ω―É―²–Β–Φ –Ψ–±–Β―¹–Κ―Ä–Ψ–≤–Μ–Η–≤–Α–Ϋ–Η―è. –ü―Ä–Η ―ç―²–Ψ–Φ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –Ω–Ψ–¥–Ψ–±―Ä–Α–Ϋ –Φ–Β―²–Ψ–¥ –Ψ–±–Β–Ζ–±–Ψ–Μ–Η–≤–Α–Ϋ–Η―è, –Ψ―²–Μ–Η―΅–Ϋ―΄–Ι –Ψ―² ―³–Α―Ä–Φ–Α–Κ–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è.
9. –ü―Ä–Η –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Η ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α ―¹ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ –Φ–Η–Ψ―Ä–Β–Μ–Α–Κ―¹–Α–Ϋ―²–Ψ–≤ –¥–Ψ–Ω―É―¹–Κ–Α–Β―²―¹―è ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Ε–Η–≤–Ψ―²–Ϋ–Ψ–≥–Ψ –Ω―É―²–Β–Φ –Ψ―²–Κ–Μ―é―΅–Β–Ϋ–Η―è –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ–Ψ–≥–Ψ –¥―΄―Ö–Α–Ϋ–Η―è, –Ϋ–Ψ –Μ–Η―à―¨ –≤ ―É―¹–Μ–Ψ–≤–Η―è―Ö ―¹–Ψ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η―è –Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–≥–Ψ –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α.
10. –î–Ψ–Ω―É―¹–Κ–Α–Β―²―¹―è ―É–Φ–Β―Ä―â–≤–Μ–Β–Ϋ–Η–Β –Φ–Β–Μ–Κ–Η―Ö –Ε–Η–≤–Ψ―²–Ϋ―΄―Ö ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Η–Ϋ–≥–Α–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–≥–Ψ –Ϋ–Α―Ä–Κ–Ψ–Ζ–Α –±–Β–Ζ –Ω―Ä–Β–¥–≤–Α―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –≤–≤–Β–¥–Β–Ϋ–Η―è –¥―Ä―É–≥–Η―Ö –≤–Η–¥–Ψ–≤ –Α–Ϋ–Β―¹―²–Β―²–Η–Κ–Ψ–≤. –ù–Α–Η–±–Ψ–Μ–Β–Β –Ω―Ä–Η–≥–Ψ–¥–Ϋ―΄–Φ –¥–Μ―è ―ç―²–Ψ–Ι ―Ü–Β–Μ–Η ―è–≤–Μ―è–Β―²―¹―è ―Ö–Μ–Ψ―Ä–Ψ―³–Ψ―Ä–Φ. –ù–Ψ –Ω―Ä–Η ―ç―²–Ψ–Φ ―ç–≤―²–Α–Ϋ–Α–Ζ–Η―è –¥–Ψ–Μ–Ε–Ϋ–Α –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²―¨―¹―è –≤ ―¹–Ω–Β―Ü–Η–Α–Μ―¨–Ϋ–Ψ–Ι –Κ–Α–Φ–Β―Ä–Β, –≤ ―²–Β–Ω–Μ–Ψ–Φ –Ω–Ψ–Φ–Β―â–Β–Ϋ–Η–Η; –Ω–Ψ–¥–Α―΅–Α ―Ö–Μ–Ψ―Ä–Ψ―³–Ψ―Ä–Φ–Α –¥–Ψ–Μ–Ε–Ϋ–Α –≤–Β―¹―²–Η―¹―¨ –Ψ―΅–Β–Ϋ―¨ –Ϋ–Β–±–Ψ–Μ―¨―à–Η–Φ–Η –¥–Ψ–Ζ–Α–Φ–Η βÄ™ –Ω–Ψ –Κ–Α–Ω–Μ–Β.
| 















