–Ю–Ї—А–∞—И–Є–≤–∞–љ–Є–µ –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є
–Я—А–Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞ —Б–≤–µ—В–Њ–Њ–њ—В–Є—З–µ—Б–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ –њ—А–Є–Љ–µ–љ—П—О—В –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Љ–µ—В–Њ–і–Њ–≤ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П, –Љ–љ–Њ–≥–Є–µ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–і–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л. –І–∞—Й–µ –≤—Б–µ–≥–Њ —Н—В–Њ –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ—Л–µ (—Н–ї–µ–Ї—В–Є–≤–љ—Л–µ) –Љ–µ—В–Њ–і—Л, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Њ–і–љ–Њ–≥–Њ –Є–ї–Є –і–≤—Г—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤. –° –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є —Ж–µ–ї—М—О –њ—А–Є–Љ–µ–љ—П—О—В –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л.
–§–Ш–Ъ–°–Р–¶–Ш–ѓ
–Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є –Є–Ј –њ—А–Њ—Б—В—Л—Е —Д–Є–Ї—Б–∞—В–Њ—А–Њ–≤ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В 10 вАФ 20 % —А–∞—Б—В–≤–Њ—А —Д–Њ—А–Љ–∞–ї—М–і–µ–≥–Є–і–∞ –Є 96 % –Є 100 % —Б–њ–Є—А—В, –Є–Ј —Д–Є–Ї—Б–Є—А—Г—О—Й–Є—Е —Б–Љ–µ—Б–µ–є вАФ —Б—Г–ї–µ–Љ—Г –Є –њ–Є—А–Є–і–Є–љ. –°—Г—Й–µ—Б—В–≤—Г—О—В —В–∞–Ї–ґ–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ —Д–Є–Ї—Б–∞—В–Њ—А—Л, –њ—А–Є–Љ–µ–љ—П—О—Й–Є–µ—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є.
–§–Є–Ї—Б–Є—А—Г—О—Й–∞—П —Б–Љ–µ—Б—М –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—П (–і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –≥–ї–Є–Є):
–љ–µ–є—В—А–∞–ї—М–љ—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ 15 –Љ–ї
–±—А–Њ–Љ–Є–і –∞–Љ–Љ–Њ–љ–Є—П 20 –≥
–і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–∞—П –≤–Њ–і–∞ 85 –Љ–ї
–°–Љ–µ—Б—М –њ—А–Є–Љ–µ–љ—П—О—В –і–ї—П —Б–µ—А–µ–±—А–µ–љ–Є—П –≥–ї–Є–Є –њ–Њ –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—О вАФ–•–Њ—А—В–µ–≥–µ.
–Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Д–Є–Ї—Б–∞—Ж–Є–Є —В–Њ–љ–Ї–Є—Е (–і–Њ 1,5 —Б–Љ) –Ї—Г—Б–Њ—З–Ї–Њ–≤ –Љ–∞—В–µ—А–Є–∞–ї–∞ 2 вАФ 15 –і–љ–µ–є.
–Я—А–Њ–Љ—Л–≤–∞–љ–Є–µ –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ.
–§–Є–Ї—Б–Є—А—Г—О—Й–∞—П —Б–Љ–µ—Б—М –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—П (–і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ–є—А–Њ-—Д–Є–±—А–Є–ї–ї):
–њ–Є—А–Є–і–Є–љ 40 –Љ–ї
96 % —Б–њ–Є—А—В 30 –Љ–ї
–Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Д–Є–Ї—Б–∞—Ж–Є–Є 2 —З.
–Я—А–Њ–Љ—Л–≤–∞–љ–Є–µ –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –≤ —В–µ—З–µ–љ–Є–µ 1 —З.
–Ю–С–Х–Ч–Т–Ю–Ц–Ш–Т–Р–Э–Ш–Х
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –Њ–±—А–∞–±–Њ—В–Ї–Є –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є —П–≤–ї—П–µ—В—Б—П –µ–µ —В—Й–∞—В–µ–ї—М–љ–Њ–µ –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є–µ. –Ф–ї—П –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є—П –Ї—Г—Б–Њ—З–Ї–Њ–≤ —В–Њ–ї—Й–Є–љ–Њ–є 5 вАФ–± –Љ–Љ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —Б–ї–µ–і—Г—О—Й—Г—О —Б—Е–µ–Љ—Г:
50 % —Б–њ–Є—А—В 2 —З
70 % —Б–њ–Є—А—В 6 —З
80 % —Б–њ–Є—А—В 6 —З
96 % —Б–њ–Є—А—В 6 —З
100 % —Б–њ–Є—А—В I 6 —З
100% —Б–њ–Є—А—В II 6 —З
–Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є—П 32 —З
–Э–Х–Ъ–Ю–Ґ–Ю–†–Ђ–Х –Ю–°–Ю–С–Х–Э–Э–Ю–°–Ґ–Ш –Ч–Р–Ы–Ш–Т–Ъ–Ш –Э–Х–†–Т–Э–Ю–Щ –Ґ–Ъ–Р–Э–Ш
–Э–µ—А–≤–љ—Г—О —В–Ї–∞–љ—М –і–ї—П –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ј–∞–ї–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ, —Ж–µ–ї–ї–Њ–Є–і–Є–љ –Є –ґ–µ–ї–∞—В–Є–љ. –Ь–µ—В–Њ–і–Є–Ї–∞ –Ј–∞–ї–Є–≤–Ї–Є –≤ –њ–∞—А–∞—Д–Є–љ –Є —Ж–µ–ї–ї–Њ–Є–і–Є–љ –љ–Є–Ї–∞–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є –љ–∞ —Н—В–Њ–є —Б—В–∞–і–Є–Є –љ–µ—В.
–Ч–∞–ї–Є–≤–Ї–∞ –≤ –ґ–µ–ї–∞—В–Є–љ –њ–Њ –°–љ–µ—Б–∞—А–µ–≤—Г
–Ь–µ—В–Њ–і –њ—А–Є–≥–Њ–і–µ–љ –і–ї—П —Н–Љ–±—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –µ–≥–Њ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –Њ–љ –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Љ–Њ—А—Й–Є–≤–∞–љ–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —В–Њ–љ–Ї–Њ–є –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є, –∞ —В–∞–Ї–ґ–µ –і–ї—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.
–Ф–ї—П –Ј–∞–ї–Є–≤–Ї–Є –±–µ—А—Г—В –±–µ—Б—Ж–≤–µ—В–љ—Л–є –њ—А–Њ–Ј—А–∞—З–љ—Л–є –њ–Є—Й–µ–≤–Њ–є –ґ–µ–ї–∞—В–Є–љ –Є –≤–љ–∞—З–∞–ї–µ –Є–Ј –љ–µ–≥–Њ –≥–Њ—В–Њ–≤—П—В 25 % —А–∞—Б—В–≤–Њ—А. –Ф–ї—П —Н—В–Њ–≥–Њ –Љ–µ–ї–Ї–Њ –љ–∞—А–µ–Ј–∞—О—В –љ—Г–ґ–љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –ґ–µ–ї–∞—В–Є–љ–∞, –љ–∞—Б—Л–њ–∞—О—В –≤ —И–Є—А–Њ–Ї–Њ–≥–Њ—А–ї—Г—О –±–∞–љ–Ї—Г –Є —Б—В–∞–≤—П—В –≤ —В–µ—А–Љ–Њ—Б—В–∞—В –њ—А–Є 37 ¬∞–° –і–Њ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —З–∞—Б—В—М –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –ґ–µ–ї–∞—В–Є–љ–∞ —А–∞–Ј–≤–Њ–і—П—В –њ–Њ–њ–Њ–ї–∞–Љ —В–µ–њ–ї—Л–Љ 1 % —А–∞—Б—В–≤–Њ—А–Њ–Љ —Д–µ–љ–Њ–ї–∞ (–Ї–∞—А–±–Њ–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л) –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –њ–Њ–ї—Г—З–∞—О—В 12,5 % —А–∞—Б—В–≤–Њ—А. –†–∞—Б—В–≤–Њ—А—Л –ґ–µ–ї–∞—В–Є–љ–∞ –ї—Г—З—И–µ –≥–Њ—В–Њ–≤–Є—В—М –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е –њ–Њ –Љ–µ—А–µ –љ–∞–і–Њ–±–љ–Њ—Б—В–Є.
–Я–Њ—Б–ї–µ —Д–Є–Ї—Б–∞—Ж–Є–Є —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л—В—Л–є –Љ–∞—В–µ—А–Є–∞–ї –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 12,5 % —А–∞—Б—В–≤–Њ—А –ґ–µ–ї–∞—В–Є–љ–∞, –≥–і–µ –і–µ—А–ґ–∞—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л –Ї—Г—Б–Њ—З–Ї–Њ–≤ –Њ—В 1 вАФ 2 —З –і–Њ 1 вАФ 2 —Б—Г—В, –Ј–∞—В–µ–Љ –љ–∞ —В–∞–Ї–Њ–µ –ґ–µ –≤—А–µ–Љ—П –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 25 % —А–∞—Б—В–≤–Њ—А –ґ–µ–ї–∞—В–Є–љ–∞ –њ—А–Є 37 ¬∞–°. –Я–Њ—Б–ї–µ –Ј–∞–ї–Є–≤–Ї–Є —Б–ї–µ–і—Г—О—В –±—Л—Б—В—А–Њ–µ –Њ—Е–ї–∞–ґ–і–µ–љ–Є–µ –≤ —Е–Њ–ї–Њ–і–Є–ї—М–љ–Є–Ї–µ –Є —Г–њ–ї–Њ—В–љ–µ–љ–Є–µ –≤ 5вАФ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ. –С–ї–Њ–Ї–Є —А–µ–ґ—Г—В —В–Њ–ї—М–Ї–Њ –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ.
–Ю–Ъ–†–Р–®–Ш–Т–Р–Э–Ш–Х –Э–Х–Щ–†–Ю–Э–Ю–Т
–Ю–Ї—А–∞—И–Є–≤–∞–љ–Є–µ –Љ–µ—В–Є–ї–µ–љ–Њ–≤—Л–Љ —Б–Є–љ–Є–Љ, –Ї–Њ—В–Њ—А–Њ–µ –Э–Є—Б—Б–ї—М –њ–Њ–ї–Њ–ґ–Є–ї –≤ –Њ—Б–љ–Њ–≤—Г –Є–Ј—Г—З–µ–љ–Є—П —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –Ї–∞—А—В–Є–љ—Л –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ –њ–µ—А–µ–Ї—А–∞—И–Є–≤–∞–љ–Є–Є —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤ —Б–њ–Є—А—В–µ —Б—А–µ–Ј–Њ–≤ –Њ—Б–љ–Њ–≤–љ—Л–Љ –∞–љ–Є–ї–Є–љ–Њ–≤—Л–Љ –Ї—А–∞—Б–Є—В–µ–ї–µ–Љ —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Њ—В–Љ—Л–≤–∞–љ–Є–µ–Љ –µ–≥–Њ –Є–Ј–±—Л—В–Ї–∞ —Б–њ–Є—А—В–Њ–Љ. –Я—А–Є —Н—В–Њ–Љ —Б–Њ—Б—В–∞–≤–љ—Л–µ —З–∞—Б—В–Є –Ї–ї–µ—В–Њ–Ї —Б–Є–ї—М–љ–µ–µ —Г–і–µ—А–ґ–Є–≤–∞—О—В –Ї—А–∞—Б–Є—В–µ–ї—М, —З–µ–Љ –Љ–∞—Б—Б–∞ –≤–Њ–ї–Њ–Ї–Њ–љ, –Ї–Њ—В–Њ—А–∞—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г–µ—В—Б—П –±—Л—Б—В—А–µ–µ. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ –Њ–Ї—А–∞—И–µ–љ–љ—Л–є –Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї —А–µ–Ј–Ї–Њ –≤—Л–і–µ–ї—П–µ—В—Б—П –љ–∞ –±–µ—Б—Ж–≤–µ—В–љ–Њ–Љ —Д–Њ–љ–µ. –Т –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–Є –Ї–ї–µ—В–Њ–Ї —Г—З–∞—Б—В–≤—Г—О—В –Ї–∞–Ї —П–і–µ—А–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л, —В–∞–Ї –Є –≤–µ—Й–µ—Б—В–≤–∞, –љ–∞—Е–Њ–і—П—Й–Є–µ—Б—П –≤ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–µ –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї,вАФ —В–Є–≥—А–Њ–Є–і–љ—Л–µ –≥–ї—Л–±–Ї–Є; –≥–ї—Л–±–Ї–Є, –Є–ї–Є –≤–µ—Й–µ—Б—В–≤–Њ –Э–Є—Б—Б–ї—П.
–Я–Њ–і —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є –Ї–∞—А—В–Є–љ–Њ–є –Ї–ї–µ—В–Ї–Є F. Nissl –њ–Њ–љ–Є–Љ–∞–ї ¬Ђ–Ї–∞—А—В–Є–љ—Г –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –Є–Љ–µ—О—Й–Є—Е—Б—П –≤ —В–Ї–∞–љ–Є –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ, —Г–±–Є—В–Њ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–∞ –њ—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Љ–Є–Ї—А–Њ—В–µ—Е–љ–Є–Ї–µ –Њ–±—А–∞–±–Њ—В–Ї–Є –љ–µ—А–≤–љ–Њ–є —В–Ї–∞–љ–Є, –љ–∞—Е–Њ–і—П—Й–µ–є—Б—П –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е¬ї.
–°–Њ –≤—А–µ–Љ–µ–љ–µ–Љ –Љ–µ—В–Њ–і –Э–Є—Б—Б–ї—П –±—Л–ї —Г–њ—А–Њ—Й–µ–љ. –Ф–∞–ґ–µ –Њ—Б–љ–Њ–≤–љ–Њ–µ —В—А–µ–±–Њ–≤–∞–љ–Є–µ F. Nissl - —Д–Є–Ї—Б–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Н—В–Є–ї–Њ–≤—Л–Љ —Б–њ–Є—А—В–Њ–Љ вАФ –≤—Л–њ–Њ–ї–љ—П—О—В —З–∞—Б—В–Є—З–љ–Њ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Љ–µ—В–Њ–і —З–∞—Б—В–Њ –њ—А–Є–Љ–µ–љ—П—О—В –і–ї—П –Њ–±—А–∞–±–Њ—В–Ї–Є –Љ–∞—В–µ—А–Є–∞–ї–∞, —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ. –Ю–і–љ–∞–Ї–Њ –≤ –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л—Е —Б–ї—Г—З–∞—П—Е —Б–ї–µ–і—Г–µ—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є—В—М –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ –Љ–∞—В–µ—А–Є–∞–ї–∞, –Ї–Њ—В–Њ—А—Л–є –±—Л–ї —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ –њ–Њ –њ—А–Њ–њ–Є—Б–Є –≤ —Б–њ–Є—А—В–µ. –І—В–Њ –ґ–µ –Ї–∞—Б–∞–µ—В—Б—П —Г–Ї–∞–Ј–∞–љ–Є–є F. Nissl –Њ —А–µ–Ј–∞–љ–Є–Є –Є –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–Є, —В–Њ –Є—Е –≤–њ–Њ–ї–љ–µ –Љ–Њ–ґ–љ–Њ –Ј–∞–Љ–µ–љ–Є—В—М –±–µ–Ј —Г—Й–µ—А–±–∞ –і–ї—П —А–µ–Ј—Г–ї—М—В–∞—В–∞ –Њ–±—Л—З–љ—Л–Љ —Б–њ–Є—А—В-—Ж–µ–ї–ї–Њ–Є–і–Є–љ–Њ–≤—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Є –±–Њ–ї–µ–µ –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–Љ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ–Љ —В–Њ–ї—Г–Є–і–Є–љ–Њ–≤—Л–Љ —Б–Є–љ–Є–Љ –Є–ї–Є —В–Є–Њ–љ–Є–љ–Њ–Љ.
==========================================================
–Ь–µ—В–Њ–і –Э–Є—Б—Б–ї—П
–§–Є–Ї—Б–∞—Ж–Є—П.
–Ю—Б—В—А—Л–Љ–Є –љ–Њ–ґ–љ–Є—Ж–∞–Љ–Є –≤—Л—А–µ–Ј–∞—О—В –Ї—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ –≤ —Д–Њ—А–Љ–µ –Ї—Г–±–Є–Ї–Њ–≤ –Є —Б—А–∞–Ј—Г, –±–µ–Ј —Б–Њ–њ—А–Є–Ї–Њ—Б–љ–Њ–≤–µ–љ–Є—П —Б –≤–Њ–і–Њ–є, –њ–Њ–Љ–µ—Й–∞—О—В –≤ –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ 96 % —Б–њ–Є—А—В–∞. –Ъ—Г—Б–Њ—З–Ї–Є –љ–µ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –љ–Є —Б–ї–Є—И–Ї–Њ–Љ –±–Њ–ї—М—И–Є–Љ–Є, –љ–Є —Б–ї–Є—И–Ї–Њ–Љ –Љ–∞–ї–µ–љ—М–Ї–Є–Љ–Є (–і–ї–Є–љ–∞ —Б—В–Њ—А–Њ–љ –љ–µ –Љ–µ–љ–µ–µ 1 —Б–Љ). –Т–∞–ґ–љ–Њ, —З—В–Њ–±—Л –Ї—Г—Б–Њ—З–µ–Ї —В–Ї–∞–љ–Є —Б–Њ –≤—Б–µ—Е —Б—В–Њ—А–Њ–љ –Њ–Љ—Л–≤–∞–ї—Б—П —Б–њ–Є—А—В–Њ–Љ (–њ–Њ–ї–Њ–ґ–Є—В—М –љ–∞ –≤–∞—В—Г), –Ї–Њ—В–Њ—А—Л–є –≤ 1-–є –і–µ–љ—М –љ—Г–ґ–љ–Њ —Б–Љ–µ–љ–Є—В—М, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ, 1 —А–∞–Ј, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –Њ–±–љ–Њ–≤–ї—П—В—М –Ї–∞–ґ–і—Л–µ 2 –і–љ—П.
–Я–Њ–ї—Г—З–µ–љ–Є–µ —Б—А–µ–Ј–Њ–≤.
–І–µ—А–µ–Ј 5 –і–љ–µ–є –±–ї–Њ–Ї –Њ–±—Л—З–љ–Њ –і–Њ—Б—В–Є–≥–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–є –Ї–Њ–љ—Б–Є—Б—В–µ–љ—Ж–Є–Є. –Х–≥–Њ —Б—В–Њ—А–Њ–љ—Г, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Г—О –і–ї—П –љ–∞–Ї–ї–µ–є–Ї–Є, —А–Њ–≤–љ–Њ —Б—А–µ–Ј–∞—О—В –Њ—Б—В—А–Њ–є –±—А–Є—В–≤–Њ–є —В–∞–Ї, —З—В–Њ–±—Л —В–Њ–ї—Й–Є–љ–∞ –±–ї–Њ–Ї–∞ –љ–µ –±—Л–ї–∞ –±–Њ–ї–µ–µ 6 вАФ 8 –Љ–Љ, —А–∞–Ј–Љ–µ—А –њ–ї–Њ—Б–Ї–Њ—Б—В–Є —Б—А–µ–Ј–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –ї—О–±—Л–Љ. –Э–∞ —А–Њ–≤–љ—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –і–µ—А–µ–≤—П–љ–љ–Њ–є –Ї–Њ–ї–Њ–і–Ї–Є, —Б–ї—Г–ґ–∞—Й—Г—О –і–ї—П –љ–∞–Ї–ї–µ–є–Ї–Є, –љ–∞–љ–Њ—Б—П—В —А–∞—Б—В–≤–Њ—А –≥—Г–Љ–Љ–Є–∞—А–∞–±–Є–Ї–∞ –Ї–Њ–љ—Б–Є—Б—В–µ–љ—Ж–Є–Є –Љ–µ–і–∞. –Я–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Ї—Г—Б–Њ—З–Ї–∞ –Љ–Њ–Ј–≥–∞ –њ—А–Њ–Љ–Њ–Ї–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є –Є –ї–µ–≥–Ї–Є–Љ –љ–∞–ґ–Є–Љ–Њ–Љ –≤–і–∞–≤–ї–Є–≤–∞—О—В –≤ —А–∞—Б—В–≤–Њ—А –≥—Г–Љ–Љ–Є–∞—А–∞–±–Є–Ї–∞ —В–∞–Ї, —З—В–Њ–±—Л –Њ–љ –≤—Б—О–і—Г —Е–Њ—А–Њ—И–Њ –њ—А–Є–ї–µ–≥–∞–ї –Ї –і–µ—А–µ–≤—П–љ–љ–Њ–є –Ї–Њ–ї–Њ–і–Ї–µ. –Ч–∞—В–µ–Љ –±–ї–Њ–Ї –њ–µ—А–µ–љ–Њ—Б—П—В –Њ–±—А–∞—В–љ–Њ –≤ 96 % —Б–њ–Є—А—В, –≥–і–µ –≥—Г–Љ–Љ–Є–∞—А–∞–±–Є–Ї –±–µ–ї–µ–µ—В –Є –±—Л—Б—В—А–Њ —Г–њ–ї–Њ—В–љ—П–µ—В—Б—П. –І–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–Є–љ—Г—В –±–ї–Њ–Ї –Љ–Њ–ґ–љ–Њ —А–µ–Ј–∞—В—М.
–С–ї–Њ–Ї —А–µ–ґ—Г—В –Ї–Њ—Б–Њ –њ–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ –љ–Њ–ґ–Њ–Љ, —Б–Љ–Њ—З–µ–љ–љ—Л–Љ —Б–њ–Є—А—В–Њ–Љ, –њ—А–Є—З–µ–Љ —Б—В–∞—А–∞—О—В—Б—П —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 10вАФ15 –Љ–Ї–Љ –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–ї–љ–Њ—Б—В—М—О —А–∞—Б–њ—А–∞–≤–Є—В—М —Б –њ–Њ–Љ–Њ—Й—М—О —Б–Љ–Њ—З–µ–љ–љ–Њ–є —Б–њ–Є—А—В–Њ–Љ –Ї–Є—Б—В–Њ—З–Ї–Є. –°—А–µ–Ј—Л —Б–Њ–±–Є—А–∞—О—В –≤ —З–∞—И–Ї—Г —Б 96 % —Б–њ–Є—А—В–Њ–Љ. –Ф–Њ–ї–≥–Њ —Е—А–∞–љ–Є—В—М –Є—Е –≤ —Б–њ–Є—А—В–µ –љ–µ–ї—М–Ј—П, —Б–ї–µ–і—Г–µ—В —Б—А–∞–Ј—Г –ґ–µ –њ–Њ–і–≥–Њ—В–Њ–≤–Є—В—М –Ї –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—О. –С–ї–Њ–Ї, –љ–∞–Њ–±–Њ—А–Њ—В, –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М –≤ —Б–њ–Є—А—В–µ –і–Њ–≤–Њ–ї—М–љ–Њ –і–Њ–ї–≥–Њ: –і–ї—П —Н—В–Њ–≥–Њ –µ–≥–Њ –љ—Г–ґ–љ–Њ —Б–љ—П—В—М —Б –і–µ—А–µ–≤—П–љ–љ–Њ–є –Ї–Њ–ї–Њ–і–Ї–Є.
–Ю–Ї—А–∞—И–Є–≤–∞–љ–Є–µ —Б—А–µ–Ј–Њ–≤.
–°—А–µ–Ј—Л –Њ–Ї—А–∞—И–Є–≤–∞—О—В –≤ —З–∞—Б–Њ–≤–Њ–Љ —Б—В–µ–Ї–ї–µ —Б –Ї—А–∞—Б—П—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ, –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤—Е–Њ–і—П—В 3,75 –≥ –Љ–µ—В–Є–ї–µ–љ–Њ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ –Т, 1,75 –≥ –љ–∞—Б–Ї–Њ–±–ї–µ–љ–љ–Њ–≥–Њ –≤–µ–љ–µ—Ж–Є–∞–љ—Б–Ї–Њ–≥–Њ –Љ—Л–ї–∞, 1 –ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Ъ—А–∞—Б—П—Й–Є–є —А–∞—Б—В–≤–Њ—А –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –њ–Њ–і–Њ–≥—А–µ–≤–∞—О—В –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–∞—А–Њ–≤. –Ч–∞—В–µ–Љ —А–∞—Б–њ—А–∞–≤–ї–µ–љ–љ—Л–µ —Б—А–µ–Ј—Л –њ–µ—А–µ–љ–Њ—Б—П—В –і–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –≤ —Б–≤–µ–ґ–µ–њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Г—О —Б–Љ–µ—Б—М –Є–Ј 10 –Љ–ї —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –њ—А–Њ–Ј—А–∞—З–љ–Њ–≥–Њ –∞–љ–Є–ї–Є–љ–Њ–≤–Њ–≥–Њ –Љ–∞—Б–ї–∞ –Є 90 –Љ–ї 96 % —Б–њ–Є—А—В–∞. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –і–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –Ї—А—Г–њ–љ—Л—Е –Њ–±–ї–∞—З–Ї–Њ–≤ –Ї—А–∞—Б–Ї–Є. –Ч–∞—В–µ–Љ —Б—А–µ–Ј –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –њ—А–Њ—Б—Г—И–Є–≤–∞—О—В –≥–ї–∞–і–Ї–Њ–є —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є, –±—Л—Б—В—А–Њ –њ–Њ–Ї—А—Л–≤–∞—О—В –Ї–∞–є–µ–њ—Г—В–Њ–≤—Л–Љ –Љ–∞—Б–ї–Њ–Љ, —Б–љ–Њ–≤–∞ –њ—А–Њ—Б—Г—И–Є–≤–∞—О—В, –њ–Њ–ї–Є–≤–∞—О—В –±–µ–љ–Ј–Є–љ–Њ–Љ (–љ–µ –і–∞–≤–∞—В—М –њ–Њ–і—Б–Њ—Е–љ—Г—В—М!) –Є –њ–Њ–Ї—А—Л–≤–∞—О—В –Ї–∞–љ–Є—Д–Њ–ї—М—О —Б –Ї—Б–Є–ї–Њ–ї–Њ–Љ (–љ–∞—Б—Л—Й–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –Ї–∞–љ–Є—Д–Њ–ї–Є –≤ –Ї—Б–Є–ї–Њ–ї–µ). –Я—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –њ–Њ–і–Њ–≥—А–µ–≤–∞—О—В –і–Њ –Є—Б–њ–∞—А–µ–љ–Є—П –Ї—Б–Є–ї–Њ–ї–∞, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –љ–∞ –µ—Й–µ –≥–Њ—А—П—З–Є–є —Б–ї–Њ–є –Ї–∞–љ–Є—Д–Њ–ї–Є –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В –њ–Њ–і–Њ–≥—А–µ—В–Њ–µ –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ. –Ъ—А–∞—Б—П—Й–Є–є —А–∞—Б—В–≤–Њ—А –њ–µ—А–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤–Ј–±–∞–ї—В—Л–≤–∞—О—В –Є —Д–Є–ї—М—В—А—Г—О—В.
–°–≤–µ–ґ–µ–њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–є –Ї—А–∞—Б—П—Й–Є–є —А–∞—Б—В–≤–Њ—А –і–Њ–ї–ґ–µ–љ —Б–Њ–Ј—А–µ–≤–∞—В—М –љ–µ –Љ–µ–љ–µ–µ 3 –Љ–µ—Б. –≠—В–Њ—В –Љ–µ—В–Њ–і —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –≤—Л—Б–Њ–Ї–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Њ–є –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –≤ –љ–Є—Е –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б–≤–µ—В–Њ–≤–Њ–Љ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–µ. –Ю—Б–љ–Њ–≤—Г –µ–≥–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤—Л—П–≤–ї—П—В—М —Б –њ–Њ–Љ–Њ—Й—М—О –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї—А–∞—Б–Є—В–µ–ї–µ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ—Л–є –і–ї—П –љ–µ–є—А–Њ–љ–Њ–≤ –љ—Г–Ї–ї–µ–Њ–њ—А–Њ—В–µ–Є–і–љ—Л–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б (—В–Є–≥—А–Њ–Є–і), —Б–Њ–і–µ—А–ґ–∞—Й–Є–є—Б—П –≤ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–µ –Є –і–µ–љ–і—А–Є—В–∞—Е, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б—Л –†–Э–Ъ –Є –Њ—Б–љ–Њ–≤–љ—Л—Е –±–µ–ї–Ї–Њ–≤ (—П–і—А—Л—И–Ї–Њ, —Е—А–Њ–Љ–∞—В–Є–љ —П–і—А–∞).
==========================================================
–Ю–Ї—А–∞—И–Є–≤–∞–љ–Є–µ —Е—А–Њ–Љ–∞—В–Њ—Д–Є–ї—М–љ–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–Є –њ–Њ –Љ–µ—В–Њ–і—Г –Э–Є—Б—Б–ї—П –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Ь–∞–є–µ—А–∞
–Я—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ —А–∞—Б—В–≤–Њ—А–∞:
–Ґ–Ш–Ю–Э–Ш–Э–Р-2,0 –Є –С–Ю–†–Э–Ю–Щ –Ъ–Ш–°–Ы–Ю–Ґ–Ђ-1,0 –≥. —А–∞—Б—В–≤–Њ—А—П—О—В –≤ 1000 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –Ј–∞—В–µ–Љ –њ—А–Є–±–∞–≤–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —В–Є–Љ–Њ–ї–∞.
–Я–µ—А–µ–і —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ —А–∞—Б—В–≤–Њ—А —Д–Є–ї—М—В—А—Г—О—В.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П:
–†–∞—Б–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –њ–∞—А–∞—Д–Є–љ–Њ–≤—Л–µ —Б—А–µ–Ј—Л –±–µ–Ј –љ–∞–Ї–ї–µ–є–Ї–Є –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ –Є –±–µ–Ј –і–µ–њ–∞—А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–Є—П –њ–µ—А–µ–љ–Њ—Б—П—В –≤ —А–∞—Б—В–≤–Њ—А —В–Є–Њ–љ–Є–љ–∞ –љ–∞ 24 —З–∞—Б–∞, –њ—А–Є —Н—В–Њ–Љ —Б—А–µ–Ј—Л –і–Њ–ї–ґ–љ—Л –њ–ї–∞–≤–∞—В—М –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї—А–∞—Б–Є—В–µ–ї—П
–°—А–µ–Ј—Л –≤—Л–ї–∞–≤–ї–Є–≤–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –Ј–∞—В–µ–Љ –≤—Л—Б—Г—И–Є–≤–∞—О—В –≤ —В–µ—А–Љ–Њ—Б—В–∞—В–µ –њ—А–Є 37"–°. –Ф–µ–њ–∞—А–∞—Д–Є–љ–Є—А—Г—О—В —Б—А–µ–Ј—Л –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –Ї–∞–љ–∞–і—Б–Ї–Є–є –±–∞–ї—М–Ј–∞–Љ –Є–ї–Є –њ–Њ–ї–Є—Б—В–Є—А–Њ–ї
–†–Х–Ч–£–Ы–ђ–Ґ–Р–Ґ–Ђ:
–ѓ–і—А—Л—И–Ї–Њ –Є —Е—А–Њ–Љ–∞—В–Њ—Д–Є–ї—М–љ–∞—П —Б—Г–±—Б—В–∞–љ—Ж–Є—П —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ—Л —Б–Є–љ–µ-—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞
–Ю–Ї—А–∞—Б–Ї–∞ –њ–Њ –Э–Є—Б—Б–ї—О
==========================================================
–£–њ—А–Њ—Й–µ–љ–љ—Л–є –Љ–µ—В–Њ–і –Э–Є—Б—Б–ї—П
–§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–є –≤ —Б–њ–Є—А—В–µ –Љ–∞—В–µ—А–Є–∞–ї –Ј–∞–ї–Є–≤–∞—О—В –≤ —Б–њ–Є—А—В-—Ж–µ–ї–ї–Њ–Є–і–Є–љ.
–°—А–µ–Ј—Л —Б–Њ–±–Є—А–∞—О—В –≤ 70 % —Б–њ–Є—А—В, –≥–і–µ –Є—Е –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –†–∞—Б–њ—А–∞–≤–ї–µ–љ–љ—Л–µ —Б—А–µ–Ј—Л –њ–Њ–Љ–µ—Й–∞—О—В –≤ 0,1 % —А–∞—Б—В–≤–Њ—А —В–Њ–ї—Г–Є–і–Є–љ–Њ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ –Є–ї–Є —В–Є–Њ–љ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –і–≤–∞–ґ–і—Л –љ–∞–≥—А–µ–≤–∞—О—В –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–∞—А–Њ–≤.
2. –Я–Њ—Б–ї–µ –Њ—Е–ї–∞–ґ–і–µ–љ–Є—П –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –≤–Њ–і–µ –Є 70 % —Б–њ–Є—А—В–µ.
3. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ 96 % —Б–њ–Є—А—В–µ.
4. –Я—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 100 % —Б–њ–Є—А—В, –Ї—Б–Є–ї–Њ–ї, –±–∞–ї—М–Ј–∞–Љ –Є–ї–Є –Њ–Ї—А–∞—И–Є–≤–∞—О—В, –Ї–∞–Ї —Г–Ї–∞–Ј–∞–љ–Њ –≤—Л—И–µ; –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ –∞–љ–Є–ї–Є–љ–Њ–≤–Њ–Љ –Љ–∞—Б–ї–µ —Б–Њ —Б–њ–Є—А—В–Њ–Љ.
5. –Ш–Ј–≤–ї–µ–Ї–∞—О—В —Б—А–µ–Ј—Л –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –њ—А–Њ—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є.
6. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –Ї–∞–є–µ–њ—Г—В–Њ–≤—Л–Љ –Љ–∞—Б–ї–Њ–Љ, –Ј–∞—В–µ–Љ –Љ–∞—Б–ї–Њ —Б–ї–Є–≤–∞—О—В.
7. –Я—А–Њ—Б—Г—И–Є–≤–∞—О—В, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –Ї—Б–Є–ї–Њ–ї –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
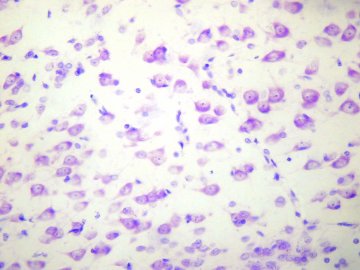
–†–µ–Ј—Г–ї—М—В–∞—В: –≥–ї—Л–±–Ї–Є —В–Є–≥—А–Њ–Є–і–∞, —П–і–µ—А–љ–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –Є —П–і—А—Л—И–Ї–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ —Б–Є–љ–Є–µ –Є–ї–Є —Д–Є–Њ–ї–µ—В–Њ–≤—Л–µ, —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Є –≥–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –±–ї–µ–і–љ–Њ-—Б–Є–љ—П—П, –≤–Њ–ї–Њ–Ї–љ–Є—Б—В–Њ–µ –љ–µ—А–≤–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –љ–µ –Њ–Ї—А–∞—И–µ–љ–Њ.
==========================================================
–Ь–µ—В–Њ–і –Э–Є—Б—Б–ї—П –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –°–љ–µ—Б–∞—А–µ–≤–∞
–Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –љ–µ—А–≤–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞—Е, –Њ–Ї—А–∞—И–µ–љ–љ—Л—Е –њ–Њ –Э–Є—Б—Б–ї—О, –≤—Л—П–≤–ї—П—О—В—Б—П –Ї–ї–µ—В–Њ—З–љ—Л–µ —Н–ї–µ–Љ–µ–љ—В—Л –Љ—П–≥–Ї–Њ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Є –µ–µ —Б–Њ—Б—Г–і–Њ–≤, –≤–љ—Г—В—А–Є–Љ–Њ–Ј–≥–Њ–≤—Л—Е —Б–Њ—Б—Г–і–Њ–≤, —П–і—А–∞ –≥–ї–Є–Є –Є –Є–љ—Д–Є–ї—М—В—А–∞—В–Є–≤–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –ї–Є–њ–Њ—Д—Г—Б—Ж–Є–љ, –Ј–µ–ї–µ–љ—Л–є –њ–Є–≥–Љ–µ–љ—В, –±–∞–Ј–Њ—Д–Є–ї—М–љ—Л–µ –Ї–Њ–∞–≥—Г–ї—П—В—Л –≤ —Б–Њ—Б—Г–і–∞—Е, –њ—А–Њ—В–Њ–њ–ї–∞–Ј–Љ–µ–љ–љ–∞—П —А–µ–∞–Ї—Ж–Є—П –∞—Б—В—А–Њ—Ж–Є—В–Њ–≤. –Ь–µ—В–Њ–і –Э–Є—Б—Б–ї—П —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –і–ї—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –љ–µ–є—А–Њ—Н–Ї—В–Њ–і–µ—А–Љ–∞–ї—М–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є –Є –њ–∞—А–∞–Ј–Є—В–∞—А–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Љ–Њ–Ј–≥–∞.
–°—А–µ–Ј—Л –Љ–∞—В–µ—А–Є–∞–ї–∞, –Ј–∞–ї–Є—В–Њ–≥–Њ –≤ —Ж–µ–ї–ї–Њ–Є–і–Є–љ, –њ–Њ–ї—Г—З–∞—О—В –љ–∞ —Б–∞–љ–љ–Њ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ. –Ґ–Њ–ї—Й–Є–љ–∞ —Б—А–µ–Ј–Њ–≤ 8-10 –Љ–Ї–Љ. –Ш—Е —Е—А–∞–љ—П—В –≤ 96 % —Б–њ–Є—А—В–µ.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –°—А–µ–Ј—Л –≤ 96 % —Б–њ–Є—А—В–µ –њ–Њ–і–Њ–≥—А–µ–≤–∞—О—В –љ–∞ –≤–Њ–і—П–љ–Њ–є –±–∞–љ–µ –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ—Г–Ј—Л—А—М–Ї–Њ–≤ –Є –Њ—Е–ї–∞–ґ–і–∞—О—В.
2. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 0,2 % —А–∞—Б—В–≤–Њ—А —В–Є–Њ–љ–Є–љ–∞, –њ–Њ–і–Њ–≥—А–µ–≤–∞—О—В –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–∞—А–Њ–≤ –Є –Њ—Е–ї–∞–ґ–і–∞—О—В.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л; –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 2 —Б–Љ–µ–љ—Л 96 % —Б–њ–Є—А—В–∞ (–і–Њ –њ–Њ–±–ї–µ–і–љ–µ–љ–Є—П —Б—А–µ–Ј–Њ–≤) –њ–Њ 30 вАФ40 —Б –≤ –Ї–∞–ґ–і–Њ–є.
4. –Я—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–µ —В–Є–Њ–љ–Є–љ–∞ –≤ —Б–њ–Є—А—В–∞—Е –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Н–≤–Ї–∞–ї–Є–њ—В–Њ–≤—Л–є —Б–њ–Є—А—В (10 –Љ–ї 96 % —Б–њ–Є—А—В–∞ + 1 –Ї–∞–њ–ї—П —Н–≤–Ї–∞–ї–Є–њ—В–Њ–≤–Њ–≥–Њ –Љ–∞—Б–ї–∞) 3-5 —Б; —В—Й–∞—В–µ–ї—М–љ–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е 96 % —Б–њ–Є—А—В–∞, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–њ–Є—А—В-–Ї—Б–Є–ї–Њ–ї (2 —З–∞—Б—В–Є –Ї—Б–Є–ї–Њ–ї–∞ –Є 1 —З–∞—Б—В—М 96 % —Б–њ–Є—А—В–∞), 100 % —Б–њ–Є—А—В-–Ї—Б–Є–ї–Њ–ї, –Ї—Б–Є–ї–Њ–ї.
5. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
6. –У–Њ—В–Њ–≤—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л —Г–Ї–ї–∞–і—Л–≤–∞—О—В –љ–∞ –і–Њ—Б–Ї–Є –Є –і–µ—А–ґ–∞—В –љ–∞ —Б–≤–µ—В—Г –і–Њ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П —Д–Њ–љ–∞ (–Ї–Њ–љ—В—А–Њ–ї—М –њ–Њ–і –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Њ–Љ).
–†–∞—Б—В–≤–Њ—А —В–Є–Њ–љ–Є–љ–∞. –У–Њ—В–Њ–≤—П—В –Є–Ј 1 –≥ —В–Є–Њ–љ–Є–љ–∞ –Є 500 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Ґ–Є–Њ–љ–Є–љ —А–∞—Б—В–Є—А–∞—О—В –≤ —Б—В—Г–њ–Ї–µ –≤ —В–µ—З–µ–љ–Є–µ 45-60 –Љ–Є–љ, –і–Њ–±–∞–≤–ї—П—П –њ–Њ –Ї–∞–њ–ї—П–Љ –њ–Њ–і–Њ–≥—А–µ—В—Г—О –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г. –Ч–∞—В–µ–Љ –і–Њ–ї–Є–≤–∞—О—В –Њ—Б—В–∞–≤—И—Г—О—Б—П –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г, –њ–Њ–і–Њ–≥—А–µ–≤–∞—О—В, –і–Њ–≤–Њ–і—П—В –і–Њ –Ї–Є–њ–µ–љ–Є—П –Є —Д–Є–ї—М—В—А—Г—О—В —З–µ—А–µ–Ј 6 —Д–Є–ї—М—В—А–Њ–≤.
–Я–µ—А–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —В–Є–Њ–љ–Є–љ–∞ –µ–≥–Њ —В–∞–Ї–ґ–µ —Б–ї–µ–і—Г–µ—В –њ—А–Њ—Д–Є–ї—М—В—А–Њ–≤–∞—В—М. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–љ—Л–є –Ї—А–∞—Б–Є—В–µ–ї—М —Б–ї–Є–≤–∞—О—В –≤ –Њ—В–і–µ–ї—М–љ—Л–є —Б–Њ—Б—Г–і, —В–∞–Ї –Ї–∞–Ї –Њ–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –≤–љ–Њ–≤—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: –љ–∞ —Б–≤–µ—В–ї–Њ–Љ —Д–Њ–љ–µ –≤—Л—П–≤–ї—П—О—В—Б—П –љ–µ—А–≤–љ—Л–µ –Ї–ї–µ—В–Ї–Є —Б–Є–љ–µ-—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—В—В–µ–љ–Ї–Њ–≤.
–Ь–µ—В–Њ–і –Э–Є—Б—Б–ї—П –Њ—В–ї–Є—З–∞–µ—В—Б—П –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–Њ–Љ –Є –±–Њ–ї—М—И–Њ–є –љ–∞–і–µ–ґ–љ–Њ—Б—В—М—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Ю—Б–љ–Њ–≤–Њ–є –µ–≥–Њ —Г—Б–њ–µ—И–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —П–≤–ї—П—О—В—Б—П –њ—А–∞–≤–Є–ї—М–љ–∞—П —Д–Є–Ї—Б–∞—Ж–Є—П –Љ–∞—В–µ—А–Є–∞–ї–∞ –Є, —З—В–Њ –Њ—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ, —В—Й–∞—В–µ–ї—М–љ–Њ–µ –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є–µ –≤ —Б–њ–Є—А—В–∞—Е –≤–Њ—Б—Е–Њ–і—П—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –њ—А–Є –Ј–∞–ї–Є–≤–Ї–µ –≤ —Ж–µ–ї–ї–Њ–Є–і–Є–љ –Є–ї–Є –њ–∞—А–∞—Д–Є–љ. –Я—А–Є –љ–µ—Б–Њ–±–ї—О–і–µ–љ–Є–Є —Н—В–Є—Е —Г—Б–ї–Њ–≤–Є–є –њ—А–µ–њ–∞—А–∞—В—Л –і–∞—О—В –љ–µ–Њ—В—З–µ—В–ї–Є–≤–Њ–µ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є–µ, –Є–Љ–µ—О—В –Ј–µ–ї–µ–љ—Л–є –Њ—В—В–µ–љ–Њ–Ї –Є –±—Л—Б—В—А–Њ –Њ–±–µ—Б—Ж–≤–µ—З–Є–≤–∞—О—В—Б—П.
==========================================================
–Ю–Ъ–†–Р–®–Ш–Т–Р–Э–Ш–Х –Э–Х–†–Т–Э–Ђ–• –Т–Ю–Ы–Ю–Ъ–Ю–Э
–Ь–µ—В–Њ–і–Є–Ї–∞ –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–Є–µ–ї–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ–Њ –®–њ–Є–ї—М–Љ–µ–є–µ—А—Г
–Ф–∞–љ–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–∞ –і–ї—П —Н–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Љ–Є–µ–ї–Є–љ–Њ–≤—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –≤—Л—П–≤–ї—П–µ—В—Б—П –і—А–µ–љ–∞–ґ–љ–∞—П –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є—П.
–Ъ—Г—Б–Њ—З–Ї–Є —Е—А–∞–љ—П—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ, —А–µ–ґ—Г—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ (—В–Њ–ї—Й–Є–љ–∞ —Б—А–µ–Ј–Њ–≤ 15 вАФ 20 –Љ–Ї–Љ). –°—А–µ–Ј—Л –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М —В–∞–Ї–ґ–µ –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
2. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ —Б–Љ–µ—Б—М—О –±–µ–ї–Ї–∞ —Б –≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ, –Є –њ–Њ–і—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ.
3. –Я–Њ–≥—А—Г–ґ–∞—О—В –≤ 2,5 % —А–∞—Б—В–≤–Њ—А –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ –љ–∞ 2 —Б—Г—В (–Љ–Њ–ґ–љ–Њ –і–Њ–ї—М—И–µ) –Є –і–µ—А–ґ–∞—В –≤ —В–µ–Љ–љ–Њ–Љ –Љ–µ—Б—В–µ.
4. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –Њ–±–µ–Ј–ґ–Є—А–Є–≤–∞—О—В –≤ 96 % —Б–њ–Є—А—В–µ 15 вАФ 30 –Љ–Є–љ.
5. –Я–Њ–Љ–µ—Й–∞—О—В –≤ –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ (15 –Љ–ї –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–∞ –С–µ–Љ–µ—А–∞ –Є 85 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) –љ–∞ 1 —Б—Г—В –Є –і–µ—А–ґ–∞—В –љ–∞ —Б–≤–µ—В—Г.
6. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ 2,5 % —А–∞—Б—В–≤–Њ—А–µ –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ (–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—П –њ—А–Њ—Ж–µ—Б—Б –њ–Њ–і –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Њ–Љ).
7. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –Ј–∞—В–µ–Љ –Њ—Б—В–∞–≤–ї—П—О—В –љ–∞ 30 –Љ–Є–љ –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ.
8. –Я—А–Њ—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –Ї—Б–Є–ї–Њ–ї –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–У–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ –С–µ–Љ–µ—А–∞ –≥–Њ—В–Њ–≤—П—В –Є–Ј –і–≤—Г—Е —А–∞—Б—В–≤–Њ—А–Њ–≤. –Я–µ—А–≤—Л–є —А–∞—Б—В–≤–Њ—А: 1 –≥ –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–∞ –≤ 10 –Љ–ї –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ —Б–њ–Є—А—В–∞; –≤—В–Њ—А–Њ–є: 8 –≥ –∞–ї—О–Љ–Њ–Ї–∞–ї–Є–µ–≤—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ —А–∞—Б—В–≤–Њ—А—П—О—В –њ—А–Є –љ–∞–≥—А–µ–≤–∞–љ–Є–Є –≤ 200 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –њ–Њ—Б–ї–µ —З–µ–≥–Њ —А–∞—Б—В–≤–Њ—А –Њ—Б—В—Г–ґ–∞—О—В –Є —Д–Є–ї—М—В—А—Г—О—В. –І–µ—А–µ–Ј 1 —Б—Г—В –њ–Њ—Б–ї–µ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —А–∞—Б—В–≤–Њ—А—Л —Б–Љ–µ—И–Є–≤–∞—О—В –Є –і–∞—О—В —Б–Љ–µ—Б–Є —Б–Њ–Ј—А–µ—В—М –љ–∞ —Б–≤–µ—В—Г –≤ —И–Є—А–Њ–Ї–Њ–≥–Њ—А–ї–Њ–Љ –Њ—В–Ї—А—Л—В–Њ–Љ —Б–Њ—Б—Г–і–µ 10вАФ14 —Б—Г—В, –њ–Њ—Б–ї–µ —З–µ–≥–Њ —Д–Є–ї—М—В—А—Г—О—В –Є –і–Њ–±–∞–≤–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ —В–Є–Љ–Њ–ї–∞.
–†–∞—Б—В–≤–Њ—А –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤: 2,5 –≥ –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ –Є 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л —А–∞–Ј–Љ–µ—И–∞—В—М –Є –њ—А–Њ—Д–Є–ї—М—В—А–Њ–≤–∞—В—М.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: –љ–∞ —Б–≤–µ—В–ї–Њ–Љ —Б–ї–µ–≥–Ї–∞ –ґ–µ–ї—В–Њ–≤–∞—В–Њ–Љ —Д–Њ–љ–µ –Љ–Є–µ–ї–Є–љ–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ —В–µ–Љ–љ–Њ-—Б–µ—А–Њ-—Б–Є–љ–µ–≤–∞—В–Њ–≥–Њ –Њ—В—В–µ–љ–Ї–∞; —П–і—А–∞ –і—А–µ–љ–∞–ґ–љ–Њ–є –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Є –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ —В–Њ–≥–Њ –ґ–µ –Њ—В—В–µ–љ–Ї–∞.
–Т –Њ–і–љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ —А–µ–і–Ї–Њ —Г–і–∞–µ—В—Б—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –≤—Л—П–≤–Є—В—М –Ї–∞—Б–∞—В–µ–ї—М–љ—Л–µ (—В–∞–љ–≥–µ–љ—Ж–Є–∞–ї—М–љ—Л–µ) –Є –њ—А–Њ–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞, –њ–Њ—В–Њ–Љ—Г —З—В–Њ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–Є–µ–ї–Є–љ–Њ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —А–∞–Ј–љ—Л—Е —Б–Є—Б—В–µ–Љ (–Є–љ—В—А–∞–Ї–Њ—А—В–Є–Ї–∞–ї—М–љ—Л–µ, –њ—А–Њ–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Є —Б–њ–∞–µ—З–љ—Л–µ) —В—А–µ–±—Г–µ—В—Б—П —А–∞–Ј–ї–Є—З–љ–∞—П –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є —Б—А–µ–Ј–Њ–≤ –≤ –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–∞—Е. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –Њ–і–љ–Њ —Б—В–µ–Ї–ї–Њ —Б–Њ —Б—А–µ–Ј–Њ–Љ, –Њ–Ї—А–∞—И–µ–љ–љ—Л–Љ –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–Њ–Љ, —Б —В–µ–Љ —З—В–Њ–±—Л –њ–Њ–ї—Г—З–Є—В—М —З–µ—В–Ї—Г—О –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї—Г –≤–Њ–ї–Њ–Ї–Њ–љ, –∞ —В–∞–Ї–ґ–µ —В–Њ–љ–Ї—Г—О —Б—В—А—Г–Ї—В—Г—А—Г –Љ–Є–µ–ї–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ—А–Њ–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ, –љ—Г–ґ–љ–Њ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М –≤ 2,5 % —А–∞—Б—В–≤–Њ—А–µ –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤, —В–Њ–≥–і–∞ –Ї–∞–Ї –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є –≤–Њ–ї–Њ–Ї–Њ–љ –Є —Б—В—А—Г–Ї—В—Г—А—Л –Љ–Є–µ–ї–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї–∞—Б–∞—В–µ–ї—М–љ—Л—Е (—В–∞–љ–≥–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е) –≤–Њ–ї–Њ–Ї–Њ–љ –і—А—Г–≥–Њ–µ —Б—В–µ–Ї–ї–Њ —Б–Њ —Б—А–µ–Ј–Њ–Љ, –Њ–Ї—А–∞—И–µ–љ–љ—Л–Љ –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–Њ–Љ, –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ 2,5 % —А–∞—Б—В–≤–Њ—А –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ –љ–∞ –±–Њ–ї–µ–µ –Ї–Њ—А–Њ—В–Ї–Є–є —Б—А–Њ–Ї. –Т –њ—А–Њ—Ж–µ—Б—Б–µ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Љ–Њ–≥—Г—В –њ–Њ—П–≤–ї—П—В—М—Б—П –∞—А—В–µ—Д–∞–Ї—В–љ—Л–µ –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–µ –±–µ–ї—Л–µ –њ—П—В–љ–∞ –љ–µ–Њ–Ї—А–∞—И–µ–љ–љ–Њ–є —В–Ї–∞–љ–Є. –Т —В–∞–Ї–Є—Е —Б–ї—Г—З–∞—П—Е —Б—А–µ–Ј—Л –љ—Г–ґ–љ–Њ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –Њ–±–µ–Ј–ґ–Є—А–Є–≤–∞—В—М –≤ 96 % —Б–њ–Є—А—В–µ.
==========================================================
–Ь–µ—В–Њ–і –®–њ–Є–ї—М–Љ–µ–є–µ—А–∞ –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –°–Њ–Ї–Њ–ї—П–љ—Б–Ї–Њ–≥–Њ
–Ф–∞–љ–љ—Л–є –Љ–µ—В–Њ–і –њ—А–Є–Љ–µ–љ—П—О—В –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–Є–µ–ї–Є–љ–Њ–≤—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ. –° –µ–≥–Њ –њ–Њ–Љ–Њ—Й—М—О –±–Њ–ї–µ–µ —З–µ—В–Ї–Њ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤–Њ–ї–Њ–Ї–Њ–љ–љ–∞—П –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–∞ –Є —Б—В—А—Г–Ї—В—Г—А–∞ –≤–Њ–ї–Њ–Ї–љ–∞, –љ–Њ —Е—Г–ґ–µ –Њ–Ї—А–∞—И–Є–≤–∞–µ—В—Б—П –Љ–Є–µ–ї–Є–љ. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ–Ї—А–∞—И–Є–≤–∞–µ—В—Б—П –і—А–µ–љ–∞–ґ–љ–∞—П –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є—П –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ (–њ—А–Є –Њ–Ї—А–∞—Б–Ї–µ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Ї—А—Л—Б –ї—Г—З—И–µ –њ—А–Є–Љ–µ–љ—П—В—М –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—О –°–Њ–Ї–Њ–ї—П–љ—Б–Ї–Њ–≥–Њ).
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ.
–°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 10 вАФ 15 –Љ–Ї–Љ –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
2. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ –±–µ–ї–Ї–Њ–Љ –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ –Є –њ–Њ–і—Б—Г—И–Є–≤–∞—О—В.
3. –Я–Њ–Љ–µ—Й–∞—О—В –≤ –љ–∞—Б—Л—Й–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П –љ–∞ 24 —З (–Љ–Њ–ґ–љ–Њ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б—Г—В–Њ–Ї) –Є –і–µ—А–ґ–∞—В –љ–∞ —Б–≤–µ—В—Г.
4. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
5. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 2,5 % —А–∞—Б—В–≤–Њ—А –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ –Є –і–µ—А–ґ–∞—В –≤ —В–µ–Љ–љ–Њ—В–µ 24 —З (–Љ–Њ–ґ–љ–Њ –і–Њ–ї—М—И–µ).
6. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ (–љ–µ–Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ).
7. –Ю–Ї—А–∞—И–Є–≤–∞—О—В –≤ —В–µ—З–µ–љ–Є–µ 24 —З (–Љ–Њ–ґ–љ–Њ –і–Њ–ї—М—И–µ) –љ–∞ —Б–≤–µ—В—Г –≤ –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–µ (15 –Љ–ї –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–∞ –С–µ–Љ–µ—А–∞ + 85 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л).
8. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
9. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ 2,5 % —А–∞—Б—В–≤–Њ—А–µ –ґ–µ–ї–µ–Ј–Њ–∞–Љ–Љ–Њ–љ–Є–є–љ—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤.
10. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 96 % —Б–њ–Є—А—В, –Ї–∞—А–±–Њ–ї-–Ї—Б–Є–ї–Њ–ї, –Ї—Б–Є–ї–Њ–ї –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–µ—А–Њ–≤–∞—В–Њ–Љ —Д–Њ–љ–µ –Љ–Є–µ–ї–Є–љ–Њ–≤–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —Б–Є—А–µ–љ–µ–≤–∞—П; —П–і—А–∞ –і—А–µ–љ–∞–ґ–љ–Њ–є –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Є –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ —В–∞–Ї–Њ–≥–Њ –ґ–µ –Њ—В—В–µ–љ–Ї–∞.
==========================================================
–Т—Л—П–≤–ї–µ–љ–Є–µ –Љ–Є–µ–ї–Є–љ–Њ–≤–Њ–є –Є –љ–µ–є—А–Њ–Ї–µ—А–∞—В–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–µ–Ї –њ–Њ –Р–≤—Ж—Л–љ—Г
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ, –Ј–∞–ї–Є–≤–∞—О—В –≤ –ґ–µ–ї–∞—В–Є–љ. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є –і–Њ 10 –Љ–Ї–Љ –Њ—В–Љ—Л–≤–∞—О—В –Њ—В —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –Ј–∞—В–µ–Љ –њ–Њ–Љ–µ—Й–∞—О—В –≤ —Б–њ–Є—А—В–Њ–≤–Њ–є —А–∞—Б—В–≤–Њ—А –њ–Є—А–Є–і–Є–љ–∞ (—З–Є—Б—В—Л–є –њ–Є—А–Є–і–Є–љ + 96 % —Б–њ–Є—А—В –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:1) –љ–∞ 1 —Б—Г—В.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 вАФ 5 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 0,5 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞.
2. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
3. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 10 % –љ–µ–є—В—А–∞–ї—М–љ—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ (3 –њ–Њ—А—Ж–Є–Є, –≤ –Ї–∞–ґ–і–Њ–є –њ–Њ 3 –Љ–Є–љ).
4. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
5. –Ю–њ—Г—Б–Ї–∞—О—В –≤ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–µ —Б–µ—А–µ–±—А–Њ –љ–∞ 30 —Б.
6. –С—Л—Б—В—А–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
7. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 10 % –љ–µ–є—В—А–∞–ї—М–љ—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ –љ–∞ 2 –Љ–Є–љ.
8. –Я–Њ–≥—А—Г–ґ–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—П –њ—А–Њ—Ж–µ—Б—Б –њ–Њ–і –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Њ–Љ.
9. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–µ —Б–µ—А–µ–±—А–Њ (–≤ —В–Њ–є –ґ–µ –±–∞–љ–Ї–µ).
10. –Я–Њ–Љ–µ—Й–∞—О—В –≤ 10 % –љ–µ–є—В—А–∞–ї—М–љ—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ –љ–∞ 2 –Љ–Є–љ. –Ш. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
12. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–µ —Б–µ—А–µ–±—А–Њ (—В–∞–Ї –і–Њ 3 вАФ 4 —А–∞–Ј, –∞ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —В–∞–љ–≥–µ–љ—Ж–Є–∞–ї—М–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ вАФ –і–Њ 7 —А–∞–Ј).
13. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—П –њ—А–Њ—Ж–µ—Б—Б –њ–Њ–і –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Њ–Љ.
14. –Ю—Б—В–Њ—А–Њ–ґ–љ–Њ –љ–∞—В—П–≥–Є–≤–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ —Б–Љ–µ—Б—М—О –±–µ–ї–Ї–∞ —Б –≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ.
15. –Я–Њ–і—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ 8вАФ10 –Љ–Є–љ, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –Ї—Б–Є–ї–Њ–ї –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ –±–µ—А—Г—В 4 –Љ–ї 20 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –Є 1 –Љ–ї 1 % —А–∞—Б—В–≤–Њ—А–∞ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –і–Њ–±–∞–≤–ї—П—О—В –њ–Њ –Ї–∞–њ–ї—П–Љ 25 % —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞–Ї–∞ –і–Њ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Њ—Б–∞–і–Ї–∞, –і–Њ–ї–Є–≤–∞—О—В –і–Њ 15 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–≤–µ—В–ї–Њ-—Б–Є—А–µ–љ–µ–≤–Њ–Љ —Д–Њ–љ–µ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –љ–µ–є—А–Њ–Ї–µ—А–∞—В–Є–љ–Њ–≤–∞—П –Є –Љ–Є–µ–ї–Є–љ–Њ–≤–∞—П –Њ–±–Њ–ї–Њ—З–Ї–Є –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞; –≤ —Б–Њ—Б—Г–і–∞—Е –≤—Л—П–≤–ї—П—О—В—Б—П —Н—А–Є—В—А–Њ—Ж–Є—В—Л —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞.
–Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П —Н—В–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —В—А–µ–±—Г–µ—В—Б—П —В—Й–∞—В–µ–ї—М–љ–Њ–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є: —Б–≤–µ–ґ–Є–є, –њ—А–Њ–Ј—А–∞—З–љ—Л–є —А–∞—Б—В–≤–Њ—А —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–≥–Њ —Б–µ—А–µ–±—А–∞, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є —В–Њ–ї—Й–Є–љ—Л —Б—А–µ–Ј—Л, —Е–Є–Љ–Є—З–µ—Б–Ї–Є —З–Є—Б—В–∞—П –њ–Њ—Б—Г–і–∞. –Т –њ—А–Њ—В–Є–≤–љ–Њ–Љ —Б–ї—Г—З–∞–µ —Д–Њ–љ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ –Ї–Њ—А–Є—З–љ–µ–≤—Л–Љ, –∞ —Б–µ—А–µ–±—А–Њ, –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–µ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ, –≤—Л–њ–∞–і–∞–µ—В –≤ –Њ—Б–∞–і–Њ–Ї –≤ –≤–Є–і–µ –Ј–µ—А–µ–љ —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞.
==========================================================
–Т—Л—П–≤–ї–µ–љ–Є–µ –Њ–±–Њ–ї–Њ—З–µ–Ї –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –њ–Њ –•–µ–Ї–≤–Є—Б—В—Г
–Ь–∞—В–µ—А–Є–∞–ї (–Ї—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є —А–∞–Ј–Љ–µ—А–Њ–Љ –і–Њ 3 —Б–Љ) —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ, –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Д–Є–Ї—Б–∞—Ж–Є–Є –љ–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–∞. –Я–Њ—Б–ї–µ —Д–Є–Ї—Б–∞—Ж–Є–Є –Ї—Г—Б–Њ—З–µ–Ї –њ—А–Њ–Љ—Л–≤–∞—О—В –і–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –Ј–∞–њ–∞—Е–∞ —Д–Њ—А–Љ–∞–ї–Є–љ–∞.
–Ч–∞—В–µ–Љ –Ї—Г—Б–Њ—З–Ї–Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 5 % —А–∞—Б—В–≤–Њ—А –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П –љ–∞ 14 –і–љ–µ–є, –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ 24 —З, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–њ–Є—А—В—Л (70 %, 96 % –Є 100 %) –Є –Ј–∞–ї–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –°—А–µ–Ј—Л –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 100 %, 96 %, 80 %, 70 % —Б–њ–Є—А—В—Л –Є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г.
2. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 0,5 % —А–∞—Б—В–≤–Њ—А —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ –љ–Њ—З—М. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –≥–Њ—В–Њ–≤—П—В –Ї—А–∞—Б–Є—В–µ–ї—М (35 –Љ–ї 1 % –≤–Њ–і–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –Љ–µ—В–Є–ї–µ–љ–Њ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ + 35 –Љ–ї 1 % –≤–Њ–і–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –ґ–µ–ї—В–Њ–≥–Њ –Є–ї–Є –Ї—А–∞—Б–љ–Њ–≥–Њ —Н–Њ–Ј–Є–љ–∞, —З–µ—А–µ–Ј 1 —Б—Г—В –њ–Њ—Б–ї–µ –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —А–∞—Б—В–≤–Њ—А—Л —Б–ї–Є–≤–∞—О—В –Є –і–Њ–±–∞–≤–ї—П—О—В 120 –Љ–ї –≤–Њ–і—Л).
3. –°—А–µ–Ј—Л –±—Л—Б—В—А–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –љ–Њ—З—М –≤ –Ї—А–∞—Б–Є—В–µ–ї—М.
4. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –≤–Њ–і–µ, –±—Л—Б—В—А–Њ –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–њ–Є—А—В—Л –Є –Ї—Б–Є–ї–Њ–ї, –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: –љ–∞ —Б–Є–љ–µ–Љ —Д–Њ–љ–µ —В–Ї–∞–љ–Є –Љ–Є–µ–ї–Є–љ–Њ–≤–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –Њ–Ї—А–∞—Б–Ї—Г –Њ—В —А–Њ–Ј–Њ–≤–Њ–є –і–Њ —П—А–Ї–Њ-–Ї—А–∞—Б–љ–Њ–є, –Њ—Б–µ–≤—Л–µ —Ж–Є–ї–Є–љ–і—А—Л –Њ–Ї—А–∞—И–Є–≤–∞—О—В—Б—П –≤ —В–µ–Љ–љ–Њ-—Б–Є–љ–Є–є —Ж–≤–µ—В.
–†–Є—Б—Г–љ–Њ–Ї –Љ–Є–µ–ї–Є–љ–Њ–≤–Њ–≥–Њ –≤–Њ–ї–Њ–Ї–љ–∞ –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М —А–∞–Ј–Љ—Л—В—Л–є —Д–Њ–љ –њ—А–Є –Ј–∞–і–µ—А–ґ–Ї–µ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞–љ–Є—П –≤ –≤–Њ–і–µ.
==========================================================
==========================================================
–Т–Ђ–ѓ–Т–Ы–Х–Э–Ш–Х –У–Р–Э–У–Ы–Ш–Х–Т –Ш –Ш–• –Ю–Ґ–†–Ю–°–Ґ–Ъ–Ю–Т
–°—А–µ–і–Є –Љ–µ—В–Њ–і–Њ–≤ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –Љ–µ—В–∞–ї–ї–∞–Љ–Є –њ–µ—А–≤–Њ–µ –Љ–µ—Б—В–Њ –Ј–∞–љ–Є–Љ–∞—О—В –Љ–µ—В–Њ–і—Л –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є —Б–µ—А–µ–±—А–Њ–Љ –У–Њ–ї—М–і–ґ–Є. –Ю–љ–Є –Њ—Б–љ–Њ–≤–∞–љ—Л –љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є–є —Б–µ—А–µ–±—А–∞, –Ї–Њ—В–Њ—А—Л–µ –Њ—Б–∞–ґ–і–∞—О—В—Б—П –љ–∞ –Њ—В–і–µ–ї—М–љ—Л—Е –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –Є –Є—Е –Њ—В—А–Њ—Б—В–Ї–∞—Е, –∞ —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ –љ–∞ –≥–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е, —Б–Њ—Б—Г–і–∞—Е –Є –і—А—Г–≥–Є—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П—Е. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є –±—Л—Б—В—А—Л–є –Љ–µ—В–Њ–і –У–Њ–ї—М–і–ґ–Є. –Т–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е –≤–Љ–µ—Б—В–Њ –љ–µ–≥–Њ –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–Њ—Б—В–Њ–є –Љ–µ—В–Њ–і —Б–µ—А–µ–±—А–µ–љ–Є—П –®—Г–ї—М—В—Ж–µ. –Э–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ, –љ–Њ –≤ —В–Њ –ґ–µ –≤—А–µ–Љ—П –Є –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–Њ–Љ –Љ–µ—В–Њ–і–∞ –У–Њ–ї—М–і–ґ–Є —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –љ–Є–Ї–Њ–≥–і–∞ –љ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П–µ—В—Б—П –љ–∞ –≤—Б–µ –Ї–ї–µ—В–Ї–Є, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—П—Б—М –Њ—В–і–µ–ї—М–љ—Л–Љ–Є —Н–ї–µ–Љ–µ–љ—В–∞–Љ–Є. –С–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г –њ–Њ–ї—Г—З–∞–µ—В—Б—П –Ї–∞—А—В–Є–љ–∞, —Е–Њ—В—П –Є –љ–µ –њ–Њ–ї–љ–∞—П, –љ–Њ –±–Њ–ї–µ–µ —П—Б–љ–∞—П, —З–µ–Љ –µ—Б–ї–Є –±—Л –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л –≤—Б–µ –Ї–ї–µ—В–Ї–Є.
–Ь–µ—В–Њ–і –У–Њ–ї—М–і–ґ–Є –Є–Љ–µ–µ—В –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –љ–µ —В–Њ–ї—М–Ї–Њ –і–ї—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –љ–Њ –Є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ—А–≤–љ—Л—Е –Њ–Ї–Њ–љ—З–∞–љ–Є–є, —Б–µ–Ї—А–µ—В–Њ—А–љ—Л—Е –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤, –ґ–µ–ї–µ–Ј–Є—Б—В—Л—Е —Е–Њ–і–Њ–≤, –≥—А–∞–љ–Є—Ж –Ї–ї–µ—В–Њ–Ї –Є —В.–њ. –•–Њ—В—П –Љ–µ—В–Њ–і –У–Њ–ї—М–і–ґ–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–ї—Г—З–Є—В—М –ї–Є—И—М —В–µ–љ–µ–≤—Г—О –Ї–∞—А—В–Є–љ—Г, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е —Б–ї—Г—З–∞—П—Е —Б –µ–≥–Њ –њ–Њ–Љ–Њ—Й—М—О —Б —Г—Б–њ–µ—Е–Њ–Љ –≤—Л—П–≤–ї—П—О—В —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ —В–Ї–∞–љ–µ–≤—Л–µ —Н–ї–µ–Љ–µ–љ—В—Л. –Я—А–Є –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є, –Ї–Њ–љ–µ—З–љ–Њ, –љ—Г–ґ–љ–Њ –њ–Њ—Б—В–Њ—П–љ–љ–Њ —Б–Њ–Ј–љ–∞–≤–∞—В—М, —З—В–Њ –≤—Л—П–≤–ї–µ–љ–Є–µ —Б—В—А—Г–Ї—В—Г—А –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –Њ—Б–∞–і–Ї–∞, –Ї–Њ—В–Њ—А—Л–є –њ—А–Є –Є–Ј–≤–µ—Б—В–љ—Л—Е –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞—Е –Љ–Њ–ґ–µ—В –і–∞—В—М –Ї–∞—А—В–Є–љ—Г –љ–µ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є—Е –≤ –і–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б—В—А—Г–Ї—В—Г—А. –Э—Г–ґ–љ–Њ —В–∞–Ї–ґ–µ —Г—З–Є—В—Л–≤–∞—В—М, —З—В–Њ –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Є–ї–Є —Б—В—А—Г–Ї—В—Г—А—Л –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –љ–µ–њ–Њ–ї–љ–Њ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є. –Ъ–∞–Ї–Є–µ –Є–Љ–µ–љ–љ–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –±—Г–і—Г—В –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ—Л, —П–≤–ї—П–µ—В—Б—П –≤ –Є–Ј–≤–µ—Б—В–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –і–µ–ї–Њ–Љ —Б–ї—Г—З–∞—П, —В–∞–Ї –Ї–∞–Ї —Г—Б–ї–Њ–≤–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А—Л—Е –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Њ—Б–∞–і–Ї–∞, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –µ—Й–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–Ј–≤–µ—Б—В–љ—Л. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –і–ї—П –њ—А–∞–≤–Є–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —В—А–µ–±—Г—О—В—Б—П –Ј–љ–∞–љ–Є—П –Є –Њ–њ—Л—В.
–£—Б–Ї–Њ—А–µ–љ–љ—Л–є –Љ–µ—В–Њ–і –У–Њ–ї—М–і–ґ–Є
1. –Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є, –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б–≤–µ–ґ–µ–є, –њ–Њ–Љ–µ—Й–∞—О—В –≤ —Б–Љ–µ—Б—М –Є–Ј 40 –Љ–ї 2,5 % (–і–Њ 3,5 % –њ–Њ –Ъ–∞—Е–∞–ї—О) –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П –Є 10 –Љ–ї 4 % —В–µ—В—А–∞–Њ–Ї—Б–Є–і–∞ –Њ—Б–Љ–Є—П –њ—А–Є 20 вАФ 25 ¬∞–° –≤ –Ї–Њ—А–Є—З–љ–µ–≤—Г—О —Б–Ї–ї—П–љ–Ї—Г –љ–∞ —Б—В–µ–Ї¬≠–ї—П–љ–љ—Г—О –≤–∞—В—Г —В–∞–Ї, —З—В–Њ–±—Л –ґ–Є–і–Ї–Њ—Б—В—М –њ—А–Њ–љ–Є–Ї–∞–ї–∞ —Б–Њ –≤—Б–µ—Е —Б—В–Њ—А–Њ–љ. –£–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞, –ґ–Є–і–Ї–Њ—Б—В–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–ї—П 5 вАФ 6 –Ї—Г—Б–Њ—З–Ї–Њ–≤. –Ъ—Г¬≠—Б–Њ—З–Ї–Є –љ–µ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —Б–ї–Є—И–Ї–Њ–Љ –±–Њ–ї—М—И–Є–Љ–Є –Є–ї–Є —Б–ї–Є—И–Ї–Њ–Љ –Љ–∞–ї–µ–љ—М¬≠–Ї–Є–Љ–Є (—В–Њ–ї—Й–Є–љ–∞ 2 вАФ 3 –Љ–Љ, –њ–ї–Њ—Й–∞–і—М –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є 5 вАФ 10 –Љ–Љ2).
–Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Ј–∞—А–∞–љ–µ–µ –љ–µ–ї—М–Ј—П —Г–Ї–∞–Ј–∞—В—М, —В–∞–Ї –Ї–∞–Ї –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –Њ–±—К–µ–Ї—В–∞ –Њ–љ–∞ —А–∞–Ј–ї–Є—З–љ–∞, –њ–Њ—Н—В–Њ–Љ—Г –≤—Б–µ–≥–і–∞ –Ї–ї–∞–і—Г—В –≤ —Б–Љ–µ—Б—М –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї—Г—Б–Њ—З–Ї–Њ–≤ –Є –≤—Л–љ–Є–Љ–∞—О—В –Є—Е –Є–Ј —А–∞—Б—В–≤–Њ—А–∞ –≤ —В–µ—З–µ–љ–Є–µ 2 вАФ 7 –і–љ–µ–є —Б –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–∞–Љ–Є –Њ–Ї–Њ–ї–Њ 12 —З.
2. –Ъ—Г—Б–Њ—З–Ї–Є –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є –Є –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ 0,75 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –Ї–Њ—В–Њ—А—Л–є –≤ —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –Љ–µ–љ—П—О—В –і–Њ –њ—А–µ¬≠–Ї—А–∞—Й–µ–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Њ—Б–∞–і–Ї–∞, –Ј–∞—В–µ–Љ –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 1 вАФ 2 –і–љ—П (–љ–∞ 1-6 –і–љ–µ–є –њ–Њ –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—О) –≤ 100 –Љ–ї 0,75 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞¬≠—В–∞ —Б–µ—А–µ–±—А–∞ –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ –Є–ї–Є 35 ¬∞–° (–љ–µ –≤—Л—И–µ), –ї—Г—З—И–µ –≤ —В–µ–Љ–љ–Њ—В–µ.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 40 % —Б–њ–Є—А—В–µ (1 вАФ2 —З), —Б–Љ–µ–љ—П—П –µ–≥–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 80 % –Є 96 % —Б–њ–Є—А—В—Л. –Ч–∞—В–µ–Љ –Ї—Г—Б–Њ—З–Ї–Є –Ј–∞–ґ–Є–Љ–∞—О—В –≤ —Г–њ–ї–Њ—В–љ–µ–љ–љ—Г—О –њ–µ—З–µ–љ—М –Є–ї–Є –њ—А–Њ–Ї–ї–µ–Є–≤–∞—О—В –≥—Г–Љ–Љ–Є–∞—А–∞–±–Є–Ї–Њ–Љ –Є —А–µ–ґ—Г—В –±—А–Є—В–≤–Њ–є –Є–ї–Є –љ–∞ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ, —Б–Љ–∞—З–Є–≤–∞—П —Б–њ–Є—А—В–Њ–Љ (—В–Њ–ї—Й–Є–љ–∞ —Б—А–µ–Ј–Њ–≤ 20-100 –Љ–Ї–Љ). –Х—Б–ї–Є –Ї—Г—Б–Њ—З–Ї–Є –њ–Њ—Б–ї–µ —Г–њ–ї–Њ—В–љ–µ–љ–Є—П –≤ —Б–њ–Є—А—В–µ –њ–µ—А–µ–љ–µ—Б—В–Є –Њ–±—А–∞—В–љ–Њ –≤ –≤–Њ–і—Г, —В–Њ –Є—Е –Љ–Њ–ґ–љ–Њ —А–µ–Ј–∞—В—М –Є –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ. –Ъ—Г—Б–Њ—З–Ї–Є –Љ–Њ–ґ–љ–Њ —В–∞–Ї–ґ–µ –±—Л—Б—В—А–Њ –Ј–∞–ї–Є—В—М –≤ —Ж–µ–ї–ї–Њ–Є–і–Є–љ, –і–ї—П —З–µ–≥–Њ –Є—Е –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В –≤ 100 % —Б–њ–Є—А—В–µ 12 —З, —Б–њ–Є—А—В-—Н—Д–Є—А–µ 2 вАФ4 —З, 4 % —Ж–µ–ї–ї–Њ–Є–і–Є–љ–µ 1 вАФ 2 –і–љ—П, –љ–∞–Ї–ї–∞–і—Л–≤–∞—О—В –љ–∞ –і–µ—А–µ–≤—П–љ–љ—Л–є –Є–ї–Є –ї—Г—З—И–µ —Б—В–∞–±–Є–ї–Є—В–Њ–≤—Л–є –±–ї–Њ–Ї, –Њ–±–ї–Є–≤–∞—О—В –≥—Г—Б—В—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ —Ж–µ–ї–ї–Њ–Є–і–Є–љ–∞ –Є —Г–њ–ї–Њ—В–љ—П—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ –Є–ї–Є –≤ 80 % —Б–њ–Є—А—В–µ. –Х—Б–ї–Є —В–Ї–∞–љ—М –њ—А–Є —А–µ–Ј–Ї–µ —Б–Є–ї—М–љ–Њ –Ї—А–Њ—И–Є—В—Б—П, —В–Њ –±–ї–Њ–Ї –њ–Њ—Б–ї–µ –Ї–∞–ґ–і–Њ–≥–Њ —Б—А–µ–Ј–∞ —Б–Љ–∞–Ј—Л–≤–∞—О—В –ґ–Є–і–Ї–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ —Ж–µ–ї–ї–Њ–Є–і–Є–љ–∞.
–Ъ—Г—Б–Њ—З–Ї–Є —В–∞–Ї–ґ–µ –Љ–Њ–ґ–љ–Њ –њ–Њ–Љ–µ—Б—В–Є—В—М –љ–∞ 1вАФ4—З –≤ 100% —Б–њ–Є—А—В, –љ–∞ 1 —З –≤ —Б–Љ–µ—Б—М 100 % —Б–њ–Є—А—В–∞ –Є —Н—Д–Є—А–∞ (1:1), –∞ –Ј–∞—В–µ–Љ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —З–∞—Б–Њ–≤ –≤ –ґ–Є–і–Ї–Є–є —Ж–µ–ї–ї–Њ–Є–і–Є–љ (–≤ —Б–Њ—Б—Г–і —Б–Њ —Б–≤–Њ–±–Њ–і–љ–Њ —Б–Є–і—П—Й–µ–є –њ—А–Њ–±–Ї–Њ–є). –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Њ–±—К–µ–Ї—В —Г–њ–ї–Њ—В–љ—П—О—В –≤ –њ–∞—А–∞—Е —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–∞ –Є —А–µ–ґ—Г—В –≤ 96 % —Б–њ–Є—А—В–µ.
–°—А–µ–Ј—Л —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 80 % —Б–њ–Є—А—В–µ –і–ї—П —Г–і–∞–ї–µ–љ–Є—П –Є–Ј–±—Л—В–Ї–∞ —Б–µ—А–µ–±—А–∞, –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В –≤ –∞–±—Б–Њ–ї—О—В–љ–Њ–Љ —Б–њ–Є—А—В–µ, –њ—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—А–µ–Њ–Ј–Њ—В–µ, –∞ –Ј–∞—В–µ–Љ –≤ —Б–Ї–Є–њ–Є–і–∞—А–µ.
–Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —Б—А–µ–Ј—Л –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –Њ—В—Б–∞—Б—Л–≤–∞—О—В –Љ–∞—Б–ї–Њ –Є –љ–∞–љ–Њ—Б—П—В –Ї–∞–њ–ї—О –≥—Г—Б—В–Њ–≥–Њ –±–∞–ї—М–Ј–∞–Љ–∞, –Ї–Њ—В–Њ—А—Г—О —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П—О—В –њ–Њ –≤—Б–µ–Љ—Г –њ—А–µ–њ–∞—А–∞—В—Г. –Т —В–∞–Ї–Њ–Љ –≤–Є–і–µ –њ—А–µ–њ–∞—А–∞—В –Њ—Б—В–∞–≤–ї—П—О—В –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–љ–µ–є —Б–Њ—Е–љ—Г—В—М –≤ –Љ–µ—Б—В–µ, –Ј–∞—Й–Є—Й–µ–љ–љ–Њ–Љ –Њ—В –њ—Л–ї–Є, –Є, –љ–∞–Ї–Њ–љ–µ—Ж, —Г–Ї—А–µ–њ–ї—П—О—В –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ —Б—А–µ–Ј–Њ–Љ –≤–љ–Є–Ј –љ–∞ –њ—А–Њ–і—Л—А—П–≤–ї–µ–љ–љ–Њ–Љ –њ—А–µ–і–Љ–µ—В–љ–Њ–Љ —Б—В–µ–Ї–ї–µ –Є–ї–Є –і–µ—А–µ–≤—П–љ–љ–Њ–є –і–Њ—Й–µ—З–Ї–µ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–µ–њ–∞—А–∞—В –љ–µ —Б–ї–µ–і—Г–µ—В –Ј–∞–Ї–ї—О—З–∞—В—М –Љ–µ–ґ–і—Г –њ—А–µ–і–Љ–µ—В–љ—Л–Љ –Є –њ–Њ–Ї—А–Њ–≤–љ—Л–Љ —Б—В–µ–Ї–ї–∞–Љ–Є, —В–∞–Ї –Ї–∞–Ї –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П —А–∞–Ј—А—Г—И–∞–µ—В—Б—П –≤ –Ї–Њ—А–Њ—В–Ї–Є–є —Б—А–Њ–Ї.
–†–µ–Ј—Г–ї—М—В–∞—В: –њ—А–Є —Г–і–∞–≤—И–µ–є—Б—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –љ–∞ —Б–≤–µ—В–ї–Њ–Љ —Д–Њ–љ–µ –≤—Л–і–µ–ї—П—О—В—Б—П –Њ—В–і–µ–ї—М–љ—Л–µ —В–µ–Љ–љ–Њ-—З–µ—А–љ—Л–µ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л–µ –Ї–ї–µ—В–Ї–Є –≤–Љ–µ—Б—В–µ —Б –Њ—В—А–Њ—Б—В–Ї–∞–Љ–Є.
–Э–∞–Є–±–Њ–ї–µ–µ –ї–µ–≥–Ї–Њ —Г–і–∞–µ—В—Б—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –љ–∞ –Љ–∞—В–µ—А–Є–∞–ї–µ, –≤–Ј—П—В–Њ–Љ –Њ—В –Љ–Њ–ї–Њ–і—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е (–њ–Њ–Ј–і–љ–Є–µ —Н–Љ–±—А–Є–Њ–љ—Л, 1 вАФ10-–і–љ–µ–≤–љ—Л–µ –ґ–Є–≤–Њ—В–љ—Л–µ). –Ю—Б–Њ–±–µ–љ–љ–Њ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ–Є –Њ–±—К–µ–Ї—В–∞¬≠–Љ–Є —П–≤–ї—П—О—В—Б—П –≥–Њ–ї–Њ–≤–љ–Њ–є –Є —Б–њ–Є–љ–љ–Њ–є –Љ–Њ–Ј–≥ –њ—В–µ–љ—Ж–Њ–≤ –≥–Њ–ї—Г–±—П.
–Т—Л—А–∞–ґ–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Е—А–Њ–Љ–Є—А–Њ–≤–∞–љ–Є—П. –Ґ–Њ—З–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –і–∞—В—М –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —В–∞–Ї –Ї–∞–Ї –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –Њ–±—К–µ–Ї—В–∞ –Њ–љ–∞ —А–∞–Ј–ї–Є—З–љ–∞ –Є –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б–Њ—Б—В–Њ—П–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞, —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –ґ–Є–і–Ї–Њ—Б—В–Є –Є –і—А. –°—А–Њ–Ї–Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В —З–Є—Б—В–Њ —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є: –і–ї—П –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –¶–Э–° –Њ–±—Л—З–љ–Њ 3 вАФ 5 –і–љ–µ–є, –і–ї—П –≥–ї–Є–Є 2 вАФ 3 –і–љ—П, –і–ї—П –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ 5-7 –і–љ–µ–є. –Я—А–Є —Б–ї–Є—И–Ї–Њ–Љ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Е—А–Њ–Љ–Є—А–Њ–≤–∞–љ–Є–Є –њ–Њ—П–≤–ї—П–µ—В—Б—П –ї–Є—И—М –і–Є—Д—Д—Г–Ј–љ—Л–є –Њ—Б–∞–і–Њ–Ї —Е—А–Њ–Љ–∞—В–∞ —Б–µ—А–µ–±—А–∞, –њ—А–Є —Б–ї–Є—И–Ї–Њ–Љ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –љ–∞—Е–Њ–і—П—В —В–Њ–ї—М–Ї–Њ —А–µ–Ј–Ї–Њ –Њ—В–≥—А–∞–љ–Є—З–µ–љ–љ—Л–µ –Ї—А–Є—Б—В–∞–ї–ї—Л, –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –ґ–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –Њ–±—Л—З–љ–Њ –Њ–Ї—А—Г–ґ–µ–љ—Л —В–Њ–ї—Б—В—Л–Љ —Б–ї–Њ–µ–Љ –Њ—Б–∞–і–Ї–∞ —Б–µ—А–µ–±—А–∞, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В –Ј–∞—В—А—Г–і–љ—П—В—М –љ–∞–±–ї—О–і–µ–љ–Є–µ, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–ї—Г—З–∞–µ —В–Њ–љ–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–µ–Љ–±—А–∞–љ, —В–∞–Ї –Ї–∞–Ї –њ–Њ–Ї—А—Л–≤–∞–µ—В –±–Њ–ї—М—И—Г—О —З–∞—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –њ–µ—А–µ–і –њ–Њ–Љ–µ—Й–µ–љ–Є–µ–Љ –Ї—Г—Б–Њ—З–Ї–Њ–≤ –≤ —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –±—Л—Б—В—А–Њ –њ–Њ–≥—А—Г–Ј–Є—В—М –Є—Е –≤ 10 % —А–∞—Б—В–≤–Њ—А –ґ–µ–ї–∞—В–Є–љ–∞, —В.–µ. –Њ–Ї—А—Г–ґ–Є—В—М –ґ–µ–ї–∞—В–Є–љ–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є. –Я–Њ—Б–ї–µ —Б–µ—А–µ–±—А–µ–љ–Є—П –Њ—В –ґ–µ–ї–∞—В–Є–љ–∞ –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—В—Б—П –њ—Г—В–µ–Љ –±—Л—Б—В—А–Њ–≥–Њ –њ–Њ–≥—А—Г–ґ–µ–љ–Є—П –Ї—Г—Б–Њ—З–Ї–Њ–≤ –≤ —В–µ–њ–ї—Г—О –≤–Њ–і—Г, –љ–∞—Б—Л—Й–µ–љ–љ—Г—О —Е—А–Њ–Љ–∞—В–Њ–Љ —Б–µ—А–µ–±—А–∞.
–Ю–±—К–µ–Ї—В—Л, –љ–∞—Е–Њ–і–Є–≤—И–Є–µ—Б—П —Б–ї–Є—И–Ї–Њ–Љ –і–Њ–ї–≥–Њ –≤ —А–∞—Б—В–≤–Њ—А–∞—Е, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —Е—А–Њ–Љ, –µ—Й–µ –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–Є–≥–Њ–і–љ—Л –і–ї—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –њ–Њ –У–Њ–ї—М–і–ґ–Є, –µ—Б–ї–Є –Є—Е –Њ–±—А–∞–±–∞—В—Л–≤–∞—В—М –≤ —В–µ—З–µ–љ–Є–µ 1 вАФ 14 –і–љ–µ–є –≤ —З–∞—Б—В–Њ —Б–Љ–µ–љ—П–µ–Љ–Њ–є —Б–Љ–µ—Б–Є —А–∞–≤–љ—Л—Е —З–∞—Б—В–µ–є 2 вАФ 3 % —А–∞—Б—В–≤–Њ—А–∞ –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П –Є 4 вАФ5 % —А–∞—Б—В–≤–Њ—А–∞ —Б—Г–ї—М—Д–∞—В–∞ –Љ–µ–і–Є; –Є–Ј —Н—В–Њ–є —Б–Љ–µ—Б–Є –Њ–±—К–µ–Ї—В –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –≤–∞–љ–љ—Г —Б –љ–Є—В—А–∞—В–Њ–Љ —Б–µ—А–µ–±—А–∞.
–Э–∞–і–µ–ґ–љ–Њ—Б—В—М –Љ–µ—В–Њ–і–∞ –У–Њ–ї—М–і–ґ–Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є 2- –Є–ї–Є 3-–Ї—А–∞—В–љ–Њ–Љ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–Є–Є –њ–Њ –Ъ–∞—Е–∞–ї—О. –С–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г —З–∞—Б—В–Њ –Љ–Њ–ґ–љ–Њ ¬Ђ—Б–њ–∞—Б—В–Є¬ї –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—О, –Њ–Ї–∞–Ј–∞–≤—И—Г—О—Б—П –≤ –њ–µ—А–≤—Л–є —А–∞–Ј –љ–µ—Г–і–∞—З–љ–Њ–є.
–Я—А–Є –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–Є–Є –њ–Њ—Б—В—Г–њ–∞—О—В —В–∞–Ї, –Ї–∞–Ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—В–Њ–і–∞ –У–Њ–ї—М–і–ґ–Є (–±—Л—Б—В—А–Њ–≥–Њ). –Ю–±—Б—Г—И–Є–≤–∞—О—В –Ї—Г—Б–Њ—З–µ–Ї –љ–∞ —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–µ –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ —А–∞–љ–µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–≤—И—Г—О—Б—П —Б–Љ–µ—Б—М –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П –Є —В–µ—В—А–∞–Њ–Ї—Б–Є–і–∞ –Њ—Б–Љ–Є—П, –∞ –Ј–∞—В–µ–Љ –љ–∞ 1 —Б—Г—В –≤ —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –њ—А–Є–Љ–µ–љ—П–≤—И–Є–є—Б—П —А–∞–љ–µ–µ. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є, –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є. –Я–Њ–≥—А—Г–ґ–∞—О—В –љ–∞ 1 вАФ 2 –Љ–Є–љ –≤ 96 % —Б–њ–Є—А—В, –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є. –Ф–µ–ї–∞—О—В –±–ї–Њ–Ї —Б –њ–Њ–Љ–Њ—Й—М—О –≥—Г–Љ–Љ–Є–∞—А–∞–±–Є–Ї–∞ –Є–ї–Є –њ–∞—А–∞—Д–Є–љ–∞ –Є —А–µ–ґ—Г—В, —Б–Љ–∞—З–Є–≤–∞—П 96 % —Б–њ–Є—А—В–Њ–Љ. –Ґ–Њ–ї—Й–Є–љ–∞ —Б—А–µ–Ј–Њ–≤ 80вАФ100 –Љ–Ї–Љ; —Б—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 96 % —Б–њ–Є—А—В–µ, —Б–Љ–µ–љ—П–µ–Љ–Њ–Љ 5 вАФ 6 —А–∞–Ј, –≤ –Њ–±—Й–µ–є —Б–ї–Њ–ґ–љ–Њ—Б—В–Є –љ–µ –і–Њ–ї—М—И–µ 30 –Љ–Є–љ. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –њ—А–Є–ґ–Є–Љ–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є –Є –Ј–∞–Ї–ї—О—З–∞—О—В (–њ–Њ –Љ–µ—В–Њ–і—Г –У–Њ–ї—М–і–ґ–Є). –Я—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤—Л—И–µ –њ—А–Њ—Ж–µ–і—Г—А—Л –Љ–Њ–ґ–љ–Њ –њ–Њ–≤—В–Њ—А–Є—В—М –Є –≤ 3-–є —А–∞–Ј.
==========================================================
–Ь–µ–і–ї–µ–љ–љ—Л–є –Љ–µ—В–Њ–і –У–Њ–ї—М–і–ґ–Є
–Ь–∞–ї–µ–љ—М–Ї–Є–µ –Ї—Г—Б–Њ—З–Ї–Є –Њ—А–≥–∞–љ–Њ–≤ –њ–Њ–Љ–µ—Й–∞—О—В –≤ –ґ–Є–і–Ї–Њ—Б—В—М –Ь—О–ї–ї–µ—А–∞ –Є–ї–Є 3 % —А–∞—Б—В–≤–Њ—А –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П, –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞—О—В –і–Њ 5 % (–≤ —Б–Њ—Б—Г–і–µ –Є–Ј –Ї–Њ—А–Є—З–љ–µ–≤–Њ–≥–Њ —Б—В–µ–Ї–ї–∞). –І–µ—А–µ–Ј 4 вАФ 6 –љ–µ–і–µ–ї—М –њ—А–Њ–≤–Њ–і—П—В –њ–µ—А–≤—Г—О –њ—А–Њ–±—Г; –і–ї—П —Н—В–Њ–≥–Њ –Њ–і–Є–љ –Ї—Г—Б–Њ—З–µ–Ї –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є, –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 0,75 % —А–∞—Б—В–≤–Њ—А–µ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –∞ –Ј–∞—В–µ–Љ –Ї–ї–∞–і—Г—В –≤ —В–∞–Ї–Њ–є –ґ–µ —А–∞—Б—В–≤–Њ—А –љ–∞ 24 —З. –Х—Б–ї–Є –љ–∞ —Б–і–µ–ї–∞–љ–љ—Л—Е –±—А–Є—В–≤–Њ–є —Б—А–µ–Ј–∞—Е —Б –Љ–∞—В–µ—А–Є–∞–ї–∞ –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –љ–Є–Ї–∞–Ї–Њ–є –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є, —В–Њ –њ—А–Њ–±—Г –њ–Њ–≤—В–Њ—А—П—О—В —З–µ—А–µ–Ј 8 –і–љ–µ–є. –Я–Њ—Б–ї–µ —В–Њ–≥–Њ –Ї–∞–Ї –љ–∞—Б—В—Г–њ–Є—В –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П, –Љ–∞—В–µ—А–Є–∞–ї –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –њ–Њ –Љ–µ—В–Њ–і—Г –У–Њ–ї—М–і–ґ–Є, –љ–∞—З–Є–љ–∞—П —Б –њ—Г–љ–Ї—В–∞ 3.
–°–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Љ–µ—В–Њ–і–Є–Ї–Є –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б –Њ—В—А–Њ—Б—В–Ї–∞–Љ–Є –Є –Ї–Њ–љ—В–∞–Ї—В–љ—Л–Љ –∞–њ–њ–∞—А–∞—В–Њ–Љ
–Ю—А–Є–≥–Є–љ–∞–ї—М–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –У–Њ–ї—М–і–ґ–Є
–Ф–∞–љ–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –≤ –Є–Ј—Г—З–µ–љ–Є–Є —В–Њ–љ–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –і–µ–љ–і—А–Є—В–Њ–≤, —И–Є–њ–Є–Ї–Њ–≤ –Є –∞–Ї—Б–Њ–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –љ–µ–є—А–Њ–љ–Њ–≤, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –±–Њ–ї–µ–µ –њ–Њ–ї–љ–Њ –≤—Л—П–≤–Є—В—М –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –љ–µ–є—А–Њ–љ–Њ–≤ –Є –Љ–µ–ґ–љ–µ–є—А–Њ–љ–∞–ї—М–љ—Л—Е —Б–≤—П–Ј–µ–є.
1. –Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ –Њ—В 1 –і–Њ 15 –і–љ–µ–є. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Д–Є–Ї—Б–∞—Ж–Є–Є –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ —Г—Е—Г–і—И–∞–µ—В –Ї–∞—З–µ—Б—В–≤–Њ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є. –Ґ–Њ–ї—Й–Є–љ–∞ –Ї—Г—Б–Њ—З–Ї–Њ–≤ –љ–µ –і–Њ–ї–ґ–љ–∞ –њ—А–µ–≤—Л—И–∞—В—М 3 вАФ 3,5 –Љ–Љ.
2. –§–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ –Ї—Г—Б–Њ—З–Ї–Є –њ–µ—А–µ–љ–Њ—Б—П—В (–±–µ–Ј –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П) –љ–∞ 3 —Б—Г—В –≤ –ґ–Є–і–Ї–Њ—Б—В—М –Ь—О–ї–ї–µ—А–∞ –≤ —В–µ—А–Љ–Њ—Б—В–∞—В.
3. –Я–Њ–Љ–µ—Й–∞—О—В (–±–µ–Ј –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П) –≤ —Д–Є–Ї—Б–∞—В–Њ—А, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј 5 –Љ–ї 1 % —В–µ—В—А–∞–Њ–Ї—Б–Є–і–∞ –Њ—Б–Љ–Є—П –Є 25 –Љ–ї 3 % –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П, –Ї–Њ—В–Њ—А—Л–є –≥–Њ—В–Њ–≤—П—В –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ, —Б—В–∞–≤—П—В –±—О–Ї—Б —Б –њ—А–Є—В–µ—А—В–Њ–є –Ї—А—Л—И–Ї–Њ–є –љ–∞ 2 –і–љ—П –≤ —В–µ—А–Љ–Њ—Б—В–∞—В –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 37 ¬∞–°. –Ф–ї—П —Д–Є–Ї—Б–∞—Ж–Є–Є –Њ–і–љ–Њ–≥–Њ –Ї—Г—Б–Њ—З–Ї–∞ —В—А–µ–±—Г–µ—В—Б—П –љ–µ –Љ–µ–љ–µ–µ 30 –Љ–ї —Г–Ї–∞–Ј–∞–љ–љ–Њ–є —Б–Љ–µ—Б–Є.
4. –Я—А–Њ–Љ—Л–≤–∞—О—В –Ї—Г—Б–Њ—З–Ї–Є –≤ 2 —Б–Љ–µ–љ–∞—Е 1 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –љ–∞ 20 % —А–∞—Б—В–≤–Њ—А–µ –≥–ї—О–Ї–Њ–Ј—Л.
5. –Ъ—Г—Б–Њ—З–Ї–Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –±–∞–љ–Њ—З–Ї–Є –Є–Ј —В–µ–Љ–љ–Њ–≥–Њ —Б—В–µ–Ї–ї–∞ –љ–∞ —Б—В–µ–Ї–ї—П–љ–љ—Г—О –≤–∞—В—Г –Є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –љ–∞–ї–Є–≤–∞—О—В —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ –≥–ї—О–Ї–Њ–Ј–µ (–љ–∞ 1 –Ї—Г—Б–Њ—З–µ–Ї –њ—А–Є–Љ–µ—А–љ–Њ 40 вАФ 50 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞). –Ю–±—А–∞—Й–∞—В—М—Б—П —Б –Ї—Г—Б–Њ—З–Ї–∞–Љ–Є —Б–ї–µ–і—Г–µ—В —Б –±–Њ–ї—М—И–Њ–є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М—О: –±—А–∞—В—М –Є—Е –Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –њ–ї–∞—Б—В–Љ–∞—Б—Б–Њ–≤–Њ–є –Є–ї–Є —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –ї–Њ–њ–∞—В–Њ—З–Ї–Њ–є, –љ–µ —Б–ї–µ–і—Г–µ—В –њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –Љ–µ—В–∞–ї–ї–Є—З–µ—Б–Ї–Є–Љ —И–њ–∞—В–µ–ї–µ–Љ. –Ш–Љ–њ—А–µ–≥–љ–∞—Ж–Є—О –Ї—Г—Б–Њ—З–Ї–Њ–≤ –њ—А–Њ–≤–Њ–і—П—В –≤ —В–µ—З–µ–љ–Є–µ 14 вАФ 20 –і–љ–µ–є –≤ —В–µ–њ–ї–Њ–Љ –Љ–µ—Б—В–µ.
6. –Я—А–Њ–≤–Њ–і—П—В –њ–Њ —Б–њ–Є—А—В–∞–Љ –≤–Њ—Б—Е–Њ–і—П—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є:
| 70 % —Б–њ–Є—А—В I
| 15 –Љ–Є–љ
| 70 % —Б–њ–Є—А—В II
| 15 –Љ–Є–љ
| 96 % —Б–њ–Є—А—В I
| 30 –Љ–Є–љ
| 96 % —Б–њ–Є—А—В II
| 30 –Љ–Є–љ
| 96 % —Б–њ–Є—А—В II
| 30 –Љ–Є–љ
| 100 % —Б–њ–Є—А—В I
| 1 —З
| 100 % —Б–њ–Є—А—В II
| 1 —З
| 100 % —Б–њ–Є—А—В —Б —Н—Д–Є—А–Њ–Љ
| 30 –Љ–Є–љ
| —Ж–µ–ї–ї–Њ–Є–і–Є–љ –ґ–Є–і–Ї–Є–є (4 вАФ 5 %)
| 1,5—З
| —Ж–µ–ї–ї–Њ–Є–і–Є–љ —Б—А–µ–і–љ–Є–є (6 вАФ 7 %)
| 1 —З
| —Ж–µ–ї–ї–Њ–Є–і–Є–љ –≥—Г—Б—В–Њ–є (10вАФ11 %)
| –љ–∞ –љ–Њ—З—М
|
–Ч–∞–ї–Є–≤–Ї—Г –≤ —Ж–µ–ї–ї–Њ–Є–і–Є–љ –њ—А–Њ–≤–Њ–і—П—В –≤ —В–µ—З–µ–љ–Є–µ 2 —Б—Г—В. –Ъ—Г—Б–Њ—З–Ї–Є –≤—Л—А–µ–Ј–∞—О—В –Є –љ–∞–Ї–ї–µ–Є–≤–∞—О—В –љ–∞ –±–ї–Њ–Ї–Є. –Ф–ї—П –±–Њ–ї–µ–µ –њ–Њ–ї–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ї—Г—Б–Њ—З–Ї–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —Б–і–µ–ї–∞—В—М –љ–∞ –±–ї–Њ–Ї–µ –њ–Њ–і–Ї–ї–∞–і–Ї—Г –Є–Ј —Ж–µ–ї–ї–Њ–Є–і–Є–љ–∞, –љ–∞ –Ї–Њ—В–Њ—А—Г—О –Ї–ї–∞–і—Г—В –Ї—Г—Б–Њ—З–µ–Ї –Є –Ј–∞–ї–Є–≤–∞—О—В –≥—Г—Б—В—Л–Љ —Ж–µ–ї–ї–Њ–Є–і–Є–љ–Њ–Љ. –Ъ—Г—Б–Њ—З–Ї–Є –њ–Њ–і—Б—Г—И–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Е —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–∞ –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 70 % —Б–њ–Є—А—В. –Я—А–Њ–≤–Њ–і–Ї—Г –њ–Њ —Б–њ–Є—А—В–∞–Љ –Є –Ј–∞–ї–Є–≤–Ї—Г –≤ —Ж–µ–ї–ї–Њ–Є–і–Є–љ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—В –≤ —В–µ–Љ–љ–Њ—В–µ, –і–ї—П —Н—В–Њ–≥–Њ –±–∞–љ–Њ—З–Ї–Є —Б –Ї—Г—Б–Њ—З–Ї–∞–Љ–Є —Б–ї–µ–і—Г–µ—В –њ–Њ–Ї—А—Л—В—М –Ї–Њ–ї–њ–∞—З–Ї–∞–Љ–Є –Є–Ј —З–µ—А–љ–Њ–є –±—Г–Љ–∞–≥–Є.
7. –†–µ–ґ—Г—В –Ї—Г—Б–Њ—З–Ї–Є –љ–∞ —Б–∞–љ–љ–Њ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ (—В–Њ–ї—Й–Є–љ–∞ —Б—А–µ–Ј–Њ–≤ 90вАФ120 –Љ–Ї–Љ). –°–µ—А–Є–Є —Б—А–µ–Ј–Њ–≤ —Б–љ–Є–Љ–∞—О—В —Б –љ–Њ–ґ–∞ –Ї–Є—Б—В–Њ—З–Ї–Њ–є –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 96 % —Б–њ–Є—А—В –≤ —З–∞—И–Ї–Є –Я–µ—В—А–Є, —А–∞—Б–њ—А–∞–≤–ї—П—П —Б—А–µ–Ј—Л –Ї–Є—Б—В–Њ—З–Ї–Њ–є.
8. –Ъ–∞–ґ–і—Л–є —Б—А–µ–Ј –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –Њ—В–і–µ–ї—М–љ–Њ –≤ 96 % —Б–њ–Є—А—В–µ, –Ј–∞—В–µ–Љ –њ–µ—А–µ–љ–Њ—Б—П—В –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ –≤ –і–≤–µ –њ–Њ—А—Ж–Є–Є –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ —Б–њ–Є—А—В–∞ вАФ –≤ –Ї–∞–ґ–і—Г—О –љ–∞ 30 –Љ–Є–љ.
9. –Ш–Ј 100 % —Б–њ–Є—А—В–∞ —Б—А–µ–Ј—Л –њ–µ—А–µ–љ–Њ—Б—П—В –Ї–Є—Б—В–Њ—З–Ї–Њ–є –љ–∞ –±–Њ–ї—М—И–Є–µ (60 —Е 90 –Є–ї–Є 32 —Е 40 –Љ–Љ) –њ–Њ–Ї—А–Њ–≤–љ—Л–µ —Б—В–µ–Ї–ї–∞. –£–Ї–ї–∞–і—Л–≤–∞—О—В —Б—А–µ–Ј—Л –≤ –њ–Њ—А—П–і–Ї–µ —Б–µ—А–Є–Є. –°—В–µ–Ї–ї–∞ —Б–Њ —Б—А–µ–Ј–∞–Љ–Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ —З–∞—И–Ї–Є –Я–µ—В—А–Є –Є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –Ј–∞–ї–Є–≤–∞—О—В –њ—А–Њ—Д–Є–ї—М—В—А–Њ–≤–∞–љ–љ—Л–Љ —Н–≤–Ї–∞–ї–Є–њ—В–Њ–≤—Л–Љ –Љ–∞—Б–ї–Њ–Љ. –Х—Б–ї–Є —Б—А–µ–Ј—Л –њ—А–Є —Н—В–Њ–Љ –≤—Б–њ–ї—Л–≤–∞—О—В –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М, —В–Њ –Є—Е —Б–ї–µ–і—Г–µ—В –Ї–Є—Б—В–Њ—З–Ї–Њ–є –≤–љ–Њ–≤—М –Њ–њ—Г—Б—В–Є—В—М –љ–∞ –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –њ–Њ–Љ–µ—Й–µ–љ–љ–Њ–µ –љ–∞ –і–љ–Њ —З–∞—И–Ї–Є –Я–µ—В—А–Є. –Т —Н–≤–Ї–∞–ї–Є–њ—В–Њ–≤–Њ–Љ –Љ–∞—Б–ї–µ —Б—А–µ–Ј—Л –і–Њ–ї–ґ–љ—Л –љ–∞—Е–Њ–і–Є—В—М—Б—П –і–Њ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ 24 —З –≤ —В–µ–Љ–љ–Њ–Љ –Љ–µ—Б—В–µ. –≠–≤–Ї–∞–ї–Є–њ—В–Њ–≤–Њ–µ –Љ–∞—Б–ї–Њ –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј (–њ–Њ—Б–ї–µ —Д–Є–ї—М—В—А–∞—Ж–Є–Є) –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –Њ–љ–Њ –љ–µ –њ–Њ—В–µ–Љ–љ–µ–µ—В.
–Я–µ—А–µ–і –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ–Љ –≤ –±–∞–ї—М–Ј–∞–Љ –Љ–∞—Б–ї–Њ —Б–ї–Є–≤–∞—О—В, –њ—А–Њ–Љ–Њ–Ї–∞—О—В —Б—А–µ–Ј—Л –љ–∞ –њ–Њ–Ї—А–Њ–≤–љ—Л—Е —Б—В–µ–Ї–ї–∞—Е —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є –Є –Ј–∞–ї–Є–≤–∞—О—В —А–Њ–≤–љ—Л–Љ —Б–ї–Њ–µ–Љ –≥—Г—Б—В–Њ–≥–Њ –±–∞–ї—М–Ј–∞–Љ–∞. –Я–Њ—Б–ї–µ —В–Њ–≥–Њ –Ї–∞–Ї –±–∞–ї—М–Ј–∞–Љ –њ–Њ–і—Б–Њ—Е–љ–µ—В (–њ—А–Є–Љ–µ—А–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 3 —Б—Г—В), –њ–Њ –Ї—А–∞—П–Љ –њ–Њ–Ї—А–Њ–≤–љ–Њ–≥–Њ —Б—В–µ–Ї–ї–∞ —Б–Њ —Б—В–Њ—А–Њ–љ—Л –±–∞–ї—М–Ј–∞–Љ–∞ –њ—А–Є–Ї–ї–µ–Є–≤–∞—О—В —Б—В–µ–Ї–ї—П–љ–љ—Л–µ, –њ–∞—А–∞—Д–Є–љ–Њ–≤—Л–µ –Є–ї–Є —Б–њ–Є—З–µ—З–љ—Л–µ –љ–Њ–ґ–Ї–Є.
–Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –ґ–Є–і–Ї–Њ—Б—В–Є –Ь—О–ї–ї–µ—А–∞ 3 –≥ –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П —А–∞—Б—В–≤–Њ—А—П—О—В –≤ 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –Љ–Њ–ґ–љ–Њ –њ–Њ–і–Њ–≥—А–µ—В—М, –Ј–∞—В–µ–Љ –Њ—Б—В—Г–і–Є—В—М –Є –і–Њ–±–∞–≤–Є—В—М 1 –≥ —Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П. –§–Є–ї—М—В—А–Њ–≤–∞—В—М —А–∞—Б—В–≤–Њ—А –љ–µ –љ—Г–ґ–љ–Њ. –†–∞—Б—В–≤–Њ—А —Е—А–∞–љ—П—В –≤ —В–µ–Љ–љ–Њ–є —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –±–∞–љ–Ї–µ.
–†–µ–Ј—Г–ї—М—В–∞—В—Л: –љ–∞ —Б–≤–µ—В–ї–Њ-–ґ–µ–ї—В–Њ–Љ —Д–Њ–љ–µ –≤—Л—П–≤–ї—П—О—В—Б—П –љ–µ–є—А–Њ–љ—Л —Б –і–µ–љ–і—А–Є—В–∞–Љ–Є –Є –∞–Ї—Б–Њ–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є, –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤ —З–µ—А–љ—Л–є —Ж–≤–µ—В.
==========================================================
–Ь–µ—В–Њ–і –У–Њ–ї—М–і–ґ–ЄвАФ–Ф–µ–є–љ–µ–Ї–Є
(–і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П —Б–Є–љ–∞–њ—Б–Њ–≤)
1. –Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Б–≤–µ–ґ–µ–Љ —А–∞—Б—В–≤–Њ—А–µ –Р–§–Р (—Б–Њ—Б—В–Њ–Є—В –Є–Ј —А–∞–≤–љ—Л—Е —З–∞—Б—В–µ–є 96 % —Б–њ–Є—А—В–∞, 20 % –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є –љ–∞—Б—Л—Й–µ–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –Љ—Л—И—М—П–Ї–Њ–≤–Є—Б—В–Њ–є –Ї–Є—Б–ї–Њ—В—Л) –і–Њ 3 —З.
2. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 1 % —А–∞—Б—В–≤–Њ—А–µ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –Є –Њ—Б—В–∞–≤–ї—П—О—В –≤ —Н—В–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –љ–∞ —Б—А–Њ–Ї –Њ—В 18 –і–љ–µ–є –і–Њ 2,5 –Љ–µ—Б.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ 3 вАФ 4 –Љ–Є–љ.
4. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В–µ–ї—М–љ—Г—О —Б–Љ–µ—Б—М, –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А–Њ–є –≤—Е–Њ–і—П—В 2 –≥ –≥–Є–і—А–Њ—Е–Є–љ–Њ–љ–∞, 0,5 –≥ —Б—Г–ї—М—Д–Є—В–∞ –љ–∞—В—А–Є—П, 5 –Љ–ї 40 % –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –љ–∞ 1 —Б—Г—В.
5. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
6. –Я—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 70 %, 80 %, 96 % —Б–њ–Є—А—В—Л –њ–Њ 3 —З –≤ –Ї–∞–ґ–і–Њ–Љ –Є –Њ—Б—В–∞–≤–ї—П—О—В –≤ 100 % —Б–њ–Є—А—В–µ –љ–∞ –љ–Њ—З—М.
7. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 6 % —Ж–µ–ї–ї–Њ–Є–і–Є–љ –љ–∞ 2 вАФ 3 —Б—Г—В, –Ј–∞—В–µ–Љ –≤ 8 % —Ж–µ–ї–ї–Њ–Є–і–Є–љ –љ–∞ 2 —Б—Г—В (–ї—Г—З—И–µ —В–Њ–ї—М–Ї–Њ –≤ 6 % —Ж–µ–ї–ї–Њ–Є–і–Є–љ –љ–∞ 2 вАФ 3 —Б—Г—В).
8. –Я–Њ—Б–ї–µ –Ј–∞–ї–Є–≤–Ї–Є –љ–∞ –±–ї–Њ–Ї–∞—Е –≥–Њ—В–Њ–≤—П—В —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є –Њ—В 15 –і–Њ 30 –Љ–Ї–Љ –Є –њ–µ—А–µ–љ–Њ—Б—П—В –Є—Е –≤ 70 % —Б–њ–Є—А—В.
9. –Я—А–Њ–Љ—Л–≤–∞—О—В —Б—А–µ–Ј—Л –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –њ–Њ–≥—А—Г–ґ–∞—О—В –і–Њ –њ–Њ—З–µ—А–љ–µ–љ–Є—П –≤ –≤–Є—А–∞–ґ (1,5 –≥ —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П, 1,5 –≥ —В–Є–Њ—Ж–Є–∞–љ–∞—В–∞ –∞–Љ–Љ–Њ–љ–Є—П, 50 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –љ–∞ –Ї–∞–ґ–і—Л–µ 10 –Љ–ї –≤–Є—А–∞–ґ–∞ 1 –Љ–ї 1 % —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞).
10. –Я—А–Њ–Љ—Л–≤–∞—О—В 10 вАФ 30 –Љ–Є–љ –≤–Њ–і–Њ–њ—А–Њ–≤–Њ–і–љ–Њ–є, –Ј–∞—В–µ–Љ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є.
11. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –і–Њ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П –≤ —А–∞—Б—В–≤–Њ—А–µ –њ–µ—А–Љ–∞–љ–≥–∞–љ–∞—В–∞ –Ї–∞–ї–Є—П (2 вАФ 3 –Ї—А–Є—Б—В–∞–ї–ї–∞ –љ–∞ 50 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л + 1 –Ї–∞–њ–ї—П —Б–µ—А–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л).
12. –Э–µ –њ—А–Њ–Љ—Л–≤–∞—П —Б—А–µ–Ј—Л, –њ–Њ–≥—А—Г–ґ–∞—О—В –Є—Е –≤ 1 % —А–∞—Б—В–≤–Њ—А —Й–∞–≤–µ–ї–µ¬≠–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 1 вАФ 3 –Љ–Є–љ (—Й–∞–≤–µ–ї–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Њ—В–Љ—Л–≤–∞–µ—В –њ–µ—А–Љ–∞–љ–≥–∞–љ–∞—В –Ї–∞–ї–Є—П).
13. –Я—А–Њ–Љ—Л–≤–∞—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ —Б–њ–Є—А—В—Л –≤–Њ—Б—Е–Њ–і—П—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є (50 %, 70 %, 96 %, 100 %) –њ–Њ 2 вАФ3 –Љ–Є–љ.
14. –Я—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –Ї–∞—А–±–Њ–ї-–Ї—Б–Є–ї–Њ–ї 1вАФ2 –Љ–Є–љ, 2 вАФ 3 –њ–Њ—А—Ж–Є–Є –Ї—Б–Є–ї–Њ–ї–∞ –Є –Ј–∞–Ї–ї—О—З–∞—О—В.
–†–µ–Ј—Г–ї—М—В–∞—В: —Д–Њ–љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–≤–µ—В–ї—Л–є, —В–µ–ї–∞ –љ–µ–є—А–Њ–љ–Њ–≤ –Є –і–µ–љ–і—А–Є—В—Л —Б–≤–µ—В–ї–Њ-—Б–µ—А–Њ–≥–Њ —Ж–≤–µ—В–∞. –Р–Ї—Б–Њ–љ–љ—Л–µ —Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Є–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Є–Љ–њ—А–µ–≥–љ–Є—А—Г—О—В—Б—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ, –і–µ–љ–і—А–Є—В—Л вАФ –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ.
==========================================================
–Ь–µ—В–Њ–і –У–Њ–ї—М–і–ґ–Є –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –С–ї–Є–љ–Њ–≤–Њ–є
1. –Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ –Њ—В 1 –Љ–µ—Б –і–Њ 1 –≥–Њ–і–∞ (–њ–Њ–ї—Г—З–µ–љ—Л —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є —Д–Є–Ї—Б–∞—Ж–Є–Є –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ –±–Њ–ї–µ–µ 1 –≥–Њ–і–∞).
2. –Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 2 % —А–∞—Б—В–≤–Њ—А –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П (–≥–Њ—В–Њ–≤—П—В –љ–∞ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ) –љ–∞ 2 —Б—Г—В –≤ —В–µ—А–Љ–Њ—Б—В–∞—В –њ—А–Є 25-30 ¬∞–°.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–≤—Г—Е —Б–Љ–µ–љ–∞—Е 4 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –љ–∞ 20 % —А–∞—Б—В–≤–Њ—А–µ –≥–ї—О–Ї–Њ–Ј—Л.
4. –Я–Њ–Љ–µ—Й–∞—О—В –≤ —В–∞–Ї–Њ–є –ґ–µ —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 4вАФ 5 —Б—Г—В –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ –≤ —В–µ–Љ–љ–Њ–Љ –Љ–µ—Б—В–µ.
5. –Э–µ –Љ–µ–љ—П—П —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –±–∞–љ–Њ—З–Ї–Є —Б –Ї—Г—Б–Њ—З–Ї–∞–Љ–Є —В–Ї–∞–љ–Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ —В–µ—А–Љ–Њ—Б—В–∞—В –њ—А–Є 24 вАФ 30 ¬∞–° –љ–∞ 1 —Б—Г—В (–±–Њ–ї–µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–∞—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –Ї—Г—Б–Њ—З–Ї–Њ–≤ —В–Ї–∞–љ–Є –≤ —В–µ—А–Љ–Њ—Б—В–∞—В–µ —Г—Е—Г–і—И–∞–µ—В –Ї–∞—З–µ—Б—В–≤–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤)
6. –Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г –Є –њ–Њ–ї—Г—З–∞—О—В —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 40 вАФ 50 –Љ–Ї–Љ –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ.
7. –Ю–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В —Б—А–µ–Ј—Л –≤ —Б–њ–Є—А—В–∞—Е –≤–Њ—Б—Е–Њ–і—П—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є (70%, 80%, 96%) –Є –≤ 2 –њ–Њ—А—Ж–Є—П—Е 100 % —Б–њ–Є—А—В–∞, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –Ї—Б–Є–ї–Њ–ї, –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ –њ–Њ–і –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ.
–Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П 4 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 20 % —А–∞—Б—В–≤–Њ—А–µ –≥–ї—О–Ї–Њ–Ј—Л —А–∞—Б—В–≤–Њ—А—П—О—В 20 –≥ –≥–ї—О–Ї–Њ–Ј—Л (–Љ–Њ–ґ–љ–Њ –Ј–∞–Љ–µ–љ–Є—В—М —Б–∞—Е–∞—А–Њ–Ј–Њ–є) –≤ 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Т —Н—В–Њ—В —А–∞—Б—В–≤–Њ—А –і–Њ–±–∞–≤–ї—П—О—В 4 –≥ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞. –Т —Б–ї—Г—З–∞–µ –≤—Л–њ–∞–і–µ–љ–Є—П –Њ—Б–∞–і–Ї–∞ —А–∞—Б—В–≤–Њ—А—Г –і–∞—О—В –Њ—В—Б—В–Њ—П—В—М—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–і –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ. –Я–Њ–і–Њ–±–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –≥–Њ—В–Њ–≤—П—В –Є 1 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 20 % —А–∞—Б—В–≤–Њ—А–µ –≥–ї—О–Ї–Њ–Ј—Л.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–≤–µ—В–ї–Њ-–ґ–µ–ї—В–Њ–Љ –Є–ї–Є –њ–Њ—З—В–Є –±–µ—Б—Ж–≤–µ—В–љ–Њ–Љ —Д–Њ–љ–µ –љ–µ–є—А–Њ–љ—Л —Б –і–µ–љ–і—А–Є—В–∞–Љ–Є –Є —И–Є–њ–Є–Ї–∞–Љ–Є –љ–∞ –љ–Є—Е –Њ–Ї—А–∞—И–µ–љ—Л –≤ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ-—З–µ—А–љ—Л–є —Ж–≤–µ—В.
==========================================================
–Ь–µ—В–Њ–і –У–Њ–ї—М–і–ґ–ЄвАФ–Ъ–Њ–Ї—Б–∞ (–і–ї—П –ґ–Є–≤–Њ—В–љ—Л—Е)
1. –Ц–Є–≤–Њ—В–љ–Њ–µ –∞–љ–µ—Б—В–µ–Ј–Є—А—Г—О—В –љ–µ–Љ–±—Г—В–∞–ї–Њ–Љ (—Н—Д–Є—А –њ—А–Є–Љ–µ–љ—П—В—М –љ–µ–ї—М–Ј—П) –≤ –ї–µ—В–∞–ї—М–љ—Л—Е –і–Њ–Ј–∞—Е, –Ј–∞—В–µ–Љ –±–µ—А—Г—В –Ї—Г—Б–Њ—З–Ї–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –±—Л—Б—В—А–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ —В–µ–њ–ї–Њ–Љ –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 50 –Љ–ї —Б–ї–µ–і—Г—О—Й–µ–є —Б–Љ–µ—Б–Є: 20 –Љ–ї 5 % —А–∞—Б—В–≤–Њ—А–∞ –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П, 20 –Љ–ї 5 % —А–∞—Б—В–≤–Њ—А–∞ —Б—Г–ї–µ–Љ—Л, 40 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Ъ —Н—В–Њ–є —Б–Љ–µ—Б–Є –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ –њ–Њ–Љ–µ—И–Є–≤–∞–љ–Є–Є –і–Њ–±–∞–≤–ї—П—О—В 8 –Љ–ї 5 % —А–∞—Б—В–≤–Њ—А–∞ –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П. –Ъ—Г—Б–Њ—З–Ї–Є –≤ —Н—В–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ —Б—В–µ–Ї–ї—П–љ–љ—Г—О –≤–∞—В—Г. –С–∞–љ–Ї–Є —Е—А–∞–љ—П—В –≤ —В–µ–Љ–љ–Њ–Љ –Љ–µ—Б—В–µ –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ (–љ–µ –њ–µ—А–µ–Љ–µ—И–Є–≤–∞—П) –≤ —В–µ—З–µ–љ–Є–µ 8 –љ–µ–і. –Ф–ї—П –Ї–Њ—А—Л –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Ї–Њ—И–Ї–Є, –Ї–Њ—В–µ–љ–Ї–∞ –Є –Ї—А—Л—Б—Л —Н—В–Њ—В —Б—А–Њ–Ї –Љ–µ–љ—М—И–µ.
2. –Ъ—Г—Б–Њ—З–Ї–Є –±–µ–Ј –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ —Б–Љ–µ—Б–Є —А–∞–≤–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ –∞—Ж–µ—В–Њ–љ–∞ –Є 100 % —Б–њ–Є—А—В–∞, –Ј–∞—В–µ–Љ –њ–Њ–Љ–µ—Й–∞—О—В –≤ —В–∞–Ї—Г—О –ґ–µ —Б–Љ–µ—Б—М –љ–∞ 24 —З –≤ –Ј–∞–Ї—А—Л—В–Њ–є –њ–Њ—Б—Г–і–µ.
3. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ —Б–Љ–µ—Б—М —А–∞–≤–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ 100 % —Б–њ–Є—А—В–∞ –Є —Н—Д–Є—А–∞ –љ–∞ 4 —З.
4. –Я–Њ–Љ–µ—Й–∞—О—В –≤ 5 % —Ж–µ–ї–ї–Њ–Є–і–Є–љ –љ–∞ 24 —З, –Ј–∞—В–µ–Љ –≤ 12 % —Ж–µ–ї–ї–Њ–Є–і–Є–љ –љ–∞ 12 —З. –Ч–∞–ї–Є–≤–∞—О—В –љ–∞ –±–ї–Њ–Ї–Є –Є —Г–Ї—А–µ–њ–ї—П—О—В —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ.
5. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 100 вАФ 120 –Љ–Ї–Љ —А–µ–ґ—Г—В –љ–∞ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ –≤ 70 % —Б–њ–Є—А—В.
6. –Ф–Њ–≤–Њ–і—П—В –і–Њ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
7. –Ю—Б—Г—Й–µ—Б—В–≤–ї—П—О—В —А–µ–і—Г–Ї—Ж–Є—О –≤ 5 % —А–∞—Б—В–≤–Њ—А–µ —Б—Г–ї—М—Д–∞—В–∞ –Ї–∞–ї–Є—П (–Ї –±–Њ–ї—М—И–Њ–Љ—Г –Њ–±—К–µ–Љ—Г —А–∞—Б—В–≤–Њ—А–∞ –і–Њ–±–∞–≤–ї—П—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–∞–њ–µ–ї—М 5 % —А–∞—Б—В–≤–Њ—А–∞ —Й–∞–≤–µ–ї–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л) –і–ї—П –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П —Д–Њ–љ–∞ –Є –µ–≥–Њ –Њ–±–µ—Б—Ж–≤–µ—З–Є–≤–∞–љ–Є—П.
8. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –≤ —В–µ—З–µ–љ–Є–µ 5 –Љ–Є–љ. –Я—А–Њ–≤–Њ–і—П—В –≤ —Б–Љ–µ—Б–Є —А–∞–≤–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ —Б–њ–Є—А—В–∞ –Є —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–∞ –Є –љ–∞–Ї–ї–µ–Є–≤–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ 1 % —А–∞—Б—В–≤–Њ—А–Њ–Љ —Ж–µ–ї–ї–Њ–Є–і–Є–љ–∞.
9. –°—В–µ–Ї–ї–∞ —Б–Њ —Б—А–µ–Ј–∞–Љ–Є –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–Љ–µ—Б—М —А–∞–≤–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ –∞–±—Б–Њ–ї—О—В–љ–Њ–≥–Њ —Б–њ–Є—А—В–∞ –Є —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–∞.
10. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ —Б–Ї–Є–њ–Є–і–∞—А–µ –Є –Ј–∞–ї–Є–≤–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
==========================================================
–Ь–µ—В–Њ–і –У–ї–Є—Б—Б–∞ –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–Њ–є
1. –Э–µ–±–Њ–ї—М—И–Њ–є –Ї—Г—Б–Њ—З–µ–Ї —В–Ї–∞–љ–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ –ґ–Є–і–Ї–Њ—Б—В—М –С–Њ–і–Є–∞–љ–∞ (5 –Љ–ї —Д–Њ—А–Љ–∞–ї–Є–љ–∞, 5 –Љ–ї –ї–µ–і—П–љ–Њ–є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є 90 –Љ–ї 80 % —Б–њ–Є—А—В–∞) –љ–∞ 3 вАФ 4 –і–љ—П.
2. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –≤ —В–µ—З–µ–љ–Є–µ 24 —З.
3. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 12 вАФ 15 –Љ–Ї–Љ –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ, –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 24 —З –≤ 50 % —Б–њ–Є—А—В, –і–Њ–±–∞–≤–Є–≤ –≤ –љ–µ–≥–Њ 10 –Ї–∞–њ–µ–ї—М –Ї—А–µ–њ–Ї–Њ–≥–Њ –∞–Љ–Љ–Є–∞–Ї–∞.
4. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 10 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ —Б—А–Њ–Ї –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —З–∞—Б–Њ–≤ –і–Њ 5 –і–љ–µ–є (–њ–Њ–Ї–∞ —Б—А–µ–Ј –љ–µ —Б—В–∞–љ–µ—В –Ї–Њ—А–Є—З–љ–µ–≤—Л–Љ).
5. –Э–µ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—П, –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ, –Љ–µ–љ—П—П –µ–≥–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј, –њ–Њ–Ї–∞ –љ–µ –Є—Б—З–µ–Ј–љ–µ—В –Љ—Г—В—М.
6. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ.
7. –Я–Њ–≥—А—Г–ґ–∞—О—В –љ–∞ 30 —Б (–Љ–Њ–ґ–љ–Њ –і–Њ 1 –Љ–Є–љ) –≤ —Б–Љ–µ—Б—М, —Б–Њ—Б—В–Њ—П—Й—Г—О –Є–Ј 10 –Љ–ї 100 % —Б–њ–Є—А—В–∞ –Є 10 –Љ–ї 20 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ (–≤—Л–њ–∞–і–∞—О—Й–Є–є –Њ—Б–∞–і–Њ–Ї —А–∞—Б—В–≤–Њ—А—П—О—В –∞–Љ–Љ–Є–∞–Ї–Њ–Љ, –њ—А–Є–±–∞–≤–ї—П—П –µ–≥–Њ –њ–Њ –Ї–∞–њ–ї—П–Љ).
8. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ, –Љ–µ–љ—П—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –і–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –Љ—Г—В–Є.
9. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 1 % —А–∞—Б—В–≤–Њ—А —Е–ї–Њ—А–љ–Њ–≥–Њ –Ј–Њ–ї–Њ—В–∞ –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П —Б—В–∞–ї—М–љ–Њ–≥–Њ —Ж–≤–µ—В–∞.
10. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 5 % —А–∞—Б—В–≤–Њ—А —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П.
11. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
12. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –њ–Њ–і—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ, –Ј–∞—В–µ–Љ –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –∞—Ж–µ—В–Њ–љ, –Ї—Б–Є–ї–Њ–ї, –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–µ—А–Њ–Љ —Д–Њ–љ–µ –≤–Є–і–љ—Л —В–µ–Љ–љ—Л–µ –љ–µ—А–≤–љ—Л–µ –Ї–ї–µ—В–Ї–Є, —П–і—А–∞, –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—Л –≤ –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е –Є —Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–ї–Њ–Ї–љ–∞—Е, —Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Є–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П.
==========================================================
–Ь–µ—В–Њ–і—Л –С–Є–ї—М—И–Њ–≤—Б–Ї–Њ–≥–Њ
–Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Њ–є –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї, –њ–Њ –С–Є–ї—М—И–Њ–≤—Б–Ї–Њ–Љ—Г, —Б–ї—Г–ґ–Є—В —Д–Є–Ї—Б–∞—Ж–Є—П –љ–µ–є—В—А–∞–ї—М–љ—Л–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–Њ–Љ. –Ю–њ—В–Є–Љ–∞–ї—М–љ–∞—П –µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М вАФ 3 вАФ 6 –љ–µ–і –њ–Њ—Б–ї–µ –њ–Њ–Љ–µ—Й–µ–љ–Є—П –≤ —Д–Њ—А–Љ–∞–ї–Є–љ, –Њ–і–љ–∞–Ї–Њ –Љ–∞—В–µ—А–Є–∞–ї, –ї–µ–ґ–∞–≤—И–Є–є –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В, —В–∞–Ї–ґ–µ –і–∞–µ—В —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ–Њ—Б–ї–µ –Њ–±—А–∞–±–Њ—В–Ї–Є –њ–Є—А–Є–і–Є–љ–Њ–Љ. –Я—А–Њ–≤–Њ–і—П—В –Њ–Ї—А–∞—Б–Ї—Г —Б—А–µ–Ј–Њ–≤ (–Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П —Б—А–µ–Ј–Њ–≤) –Є–ї–Є –Ї—Г—Б–Њ—З–Ї–Њ–≤ (—В–Њ—В–∞–ї—М–љ–∞—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П). –Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П —Е–Њ—А–Њ—И–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л —В–Њ—З–љ–Њ–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ –њ—А–Њ–њ–Є—Б–µ–є (–Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л —В–Њ–ї—М–Ї–Њ —Б—В–µ–Ї–ї—П–љ–љ—Л–µ!) –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —З–Є—Б—В—Л—Е —А–µ–∞–Ї—В–Є–≤–Њ–≤.
–Ш–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П —Б—А–µ–Ј–Њ–≤
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —А–∞—Б—В–≤–Њ—А–µ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ (1:9) –љ–µ –Љ–µ–љ–µ–µ 14 –і–љ–µ–є (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —В–Њ–ї—Й–Є–љ–∞ –Ї—Г—Б–Њ—З–Ї–Њ–≤ 1 —Б–Љ); –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ 2 вАФ3 —З, –Ј–∞—В–µ–Љ –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ 1вАФ2 –і–љ—П; –љ–∞—А–µ–Ј–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є .5 вАФ 10 –Љ–Ї–Љ –Є —Б–Њ–±–Є—А–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г. –•–Њ—А–Њ—И–Є–µ —Б—А–µ–Ј—Л –≤—Л–ї–∞–≤–ї–Є–≤–∞—О—В –Є –њ—А–Њ–Љ—Л–≤–∞—О—В 1 вАФ 2 —А–∞–Ј–∞ –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –Ї–Њ—В–Њ—А—Г—О –Љ–µ–љ—П—О—В 3 вАФ 4 —А–∞–Ј–∞.
–Ш–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П:
1) —Б—А–µ–Ј—Л –њ–Њ–Љ–µ—Й–∞—О—В –≤ 2 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 24 —З;
2) –±—Л—Б—В—А–Њ (2 вАФ 3 —Б) –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г, —Б–Љ–µ–љ—П—П —Б—В–µ–Ї–ї—П–љ–љ—Л–µ –њ–∞–ї–Њ—З–Ї–Є;
3) –њ–Њ–Љ–µ—Й–∞—О—В –≤ —Б–≤–µ–ґ–µ–њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ¬≠—А–µ–±—А–∞: –Ї 10 –Љ–ї 10 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –і–Њ–±–∞–≤–ї—П—О—В 5 –Ї–∞–њ–µ–ї—М 40 % —А–∞—Б—В–≤–Њ—А–∞ –≥–Є–і—А–Њ–Ї—Б–Є–і–∞ –љ–∞—В—А–Є—П вАФ –Њ–±—А–∞–Ј—Г–µ—В—Б—П –Ї–Њ—А–Є—З–љ–µ–≤–Њ-—З–µ—А–љ—Л–є –Њ—Б–∞–і–Њ–Ї –Њ–Ї–Є—Б–Є —Б–µ—А–µ–±—А–∞. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ—А–Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–Љ –≤–Ј–±–∞–ї—В—Л–≤–∞–љ–Є–Є –Ї —А–∞—Б—В–≤–Њ—А—Г —Б–µ—А–µ–±—А–∞ –њ–Њ –Ї–∞–њ–ї—П–Љ –і–Њ–±–∞–≤–ї—П—О—В —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞–Ї–∞ (–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞ 0,875 вАФ 0,910) –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –Њ—В —А–∞—Б—В–≤–Њ—А—П—О—Й–µ–≥–Њ—Б—П –Њ—Б–∞–і–Ї–∞ –Њ—Б—В–∞–љ–µ—В—Б—П –ї–Є—И—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї—А—Г–њ–Є–љ–Њ–Ї. –Я–Њ—Б–ї–µ –Ї–∞–ґ–і–Њ–є –Ї–∞–њ–ї–Є –≤—Л–ґ–Є–і–∞—О—В 10 вАФ 20 —Б, –њ—А–µ–ґ–і–µ —З–µ–Љ –і–Њ–±–∞–≤–Є—В—М —Б–ї–µ–і—Г—О—Й—Г—О –Ї–∞–њ–ї—О. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є–Ј–±–µ–≥–∞—В—М –Є–Ј–±—Л—В–Ї–∞ –∞–Љ–Љ–Є–∞–Ї–∞. –†–∞—Б—В–≤–Њ—А —А–∞–Ј–≤–Њ–і—П—В –і–Њ 20 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є. –Т —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ —Б—А–µ–Ј—Л –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 10 вАФ 20 –Љ–Є–љ, –≤ –љ–µ–Љ –Њ–љ–Є –і–Њ–ї–ґ–љ—Л –њ—А–Є–Њ–±—А–µ—Б—В–Є –ґ–µ–ї—В–Њ–≤–∞—В—Л–є –Њ—В—В–µ–љ–Њ–Ї;
4) –±—Л—Б—В—А–Њ –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 2 вАФ 3 –њ–Њ—А—Ж–Є–Є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л;
5) –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –≤ —А–∞—Б—В–≤–Њ—А–µ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ (1:4), –љ–µ —Б–Њ–і–µ—А–ґ–∞—Й–µ–Љ –Ї–Є—Б–ї–Њ—В—Л –≤ —В–µ—З–µ–љ–Є–µ 10 –Љ–Є–љ, вАФ —Б—А–µ–Ј—Л –±—Л—Б—В—А–Њ –Њ–Ї—А–∞—И–Є–≤–∞—О—В—Б—П –≤ —В–µ–Љ–љ–Њ-—Б–µ—А—Л–є —Ж–≤–µ—В;
6) –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –≤–Њ–і–µ 15 –Љ–Є–љ;
7) –Ј–Њ–ї–Њ—В—П—В –≤ —А–∞–Ј–±–∞–≤–ї–µ–љ–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ (3 вАФ 5 –Ї–∞–њ–µ–ї—М 1 % —А–∞—Б—В–≤–Њ—А–∞ –ґ–µ–ї—В–Њ–≥–Њ —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ –љ–∞ 10 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –Ї–Њ—А–Є—З–љ–µ–≤—Л–є —В–Њ–љ –љ–µ –њ–µ—А–µ–є–і–µ—В –≤ —Б–µ—А—Л–є –Є–ї–Є —Б–µ—А–Њ-—Д–Є–Њ–ї–µ—В–Њ–≤—Л–є;
8) —Д–Є–Ї—Б–Є—А—Г—О—В 1вАФ2 –Љ–Є–љ –≤ 5 % —А–∞—Б—В–≤–Њ—А–µ —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П;
9) —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –Њ–±—Л—З–љ–Њ–є –≤–Њ–і–µ (1вАФ2 —З); –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–њ–Є—А—В—Л, –Ї–∞—А–±–Њ–ї-–Ї—Б–Є–ї–Њ–ї, –Ї—Б–Є–ї–Њ–ї (–љ–µ –і–Њ–ї—М—И–µ, —З–µ–Љ –љ—Г–ґ–љ–Њ) –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–Э–∞ —Е–Њ—А–Њ—И–Њ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—Л –Є –њ–µ—А–Є—Ж–µ–ї–ї—О–ї—П—А–љ—Л–µ —Б–µ—В—З–∞—В—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞ –≤—Л–і–µ–ї—П—О—В—Б—П –љ–∞ —Б–≤–µ—В–ї–Њ–Љ —Д–Њ–љ–µ, —В–∞–Ї –ґ–µ –Њ—В—З–µ—В–ї–Є–≤–Њ –≤–Є–і–љ—Л —В–Њ–љ—З–∞–є—И–Є–µ –Њ—Б–µ–≤—Л–µ —Ж–Є–ї–Є–љ–і—А—Л.
–Ъ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–µ–Љ—Г 4 % —А–∞—Б—В–≤–Њ—А—Г —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Љ–Њ–ґ–љ–Њ –і–Њ–±–∞–≤–Є—В—М 1 % —Ж–Є—В—А–∞—В –љ–∞—В—А–Є—П –≤ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є 1:9. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Ї–∞—А—В–Є–љ–∞, –њ–Њ–ї—Г—З–∞—О—Й–∞—П—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–µ—А–µ–±—А–µ–љ–Є—П, –Њ—З–µ–љ—М —А–∞–≤–љ–Њ–Љ–µ—А–љ–∞—П –Є –±–Њ–ї–µ–µ –Ї–Њ–љ—В—А–∞—Б—В–љ–∞—П.
==========================================================
–Ь–µ—В–Њ–і —Б–µ—А–µ–±—А–µ–љ–Є—П —Б –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Њ–є –њ–Є—А–Є–і–Є–љ–Њ–Љ
–Т —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Љ–∞—В–µ—А–Є–∞–ї –њ—А–µ–і–љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Њ—Б–µ–≤—Л—Е —Ж–Є–ї–Є–љ–і—А–Њ–≤, –∞ –љ–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї, –Ь. –С–Є–ї—М—И–Њ–≤—Б–Ї–Є–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –Њ–±—А–∞–±–Њ—В–∞—В—М –µ–≥–Њ –њ–Є—А–Є–і–Є–љ–Њ–Љ (–±–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г —Б–Є–ї—М–љ–Њ –њ–Њ–і–∞–≤–ї—П–µ—В—Б—П –њ–Њ–і–Ї—А–∞—Б–Ї–∞ –≥–ї–Є–Є –Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є). –§–Є–Ї—Б–∞—Ж–Є—О –Є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Г—О –њ–Њ–і–≥–Њ—В–Њ–≤–Ї—Г –Љ–∞—В–µ—А–Є–∞–ї–∞ –њ—А–Њ–≤–Њ–і—П—В –њ–Њ –Љ–µ—В–Њ–і—Г –С–Є–ї—М—И–Њ–≤—Б–Ї–Њ–≥–Њ. –Ч–∞–Љ–Њ—А–Њ–ґ–µ–љ–љ—Л–µ —Б—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ 1 вАФ 2 —З –Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –љ–µ—А–∞–Ј–≤–µ–і–µ–љ–љ—Л–є –њ–Є—А–Є–і–Є–љ –љ–∞ 24вАФ 48 —З. –Ч–∞—В–µ–Љ —Б—А–µ–Ј—Л —В—Й–∞—В–µ–ї—М–љ–Њ –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –Њ—В –њ–Є—А–Є–і–Є–љ–∞, –њ—А–Њ–Љ—Л–≤–∞—П –Є—Е –≤ —З–∞—Б—В–Њ —Б–Љ–µ–љ—П–µ–Љ–Њ–є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ –љ–µ –Є—Б—З–µ–Ј–љ–µ—В —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –Ј–∞–њ–∞—Е –њ–Є—А–Є–і–Є–љ–∞. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 2 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 24 —З –Є –і–∞–ї–µ–µ –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –њ–Њ –Љ–µ—В–Њ–і—Г –С–Є–ї—М—И–Њ–≤—Б–Ї–Њ–≥–Њ.
–Ґ–Њ—В–∞–ї—М–љ–∞—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П
–Ш–Љ–њ—А–µ–≥–љ–∞—Ж–Є—О —Ж–µ–ї–Њ–≥–Њ –Ї—Г—Б–Њ—З–Ї–∞ –њ—А–Њ–≤–Њ–і—П—В —Б –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –Њ–±—А–∞–±–Њ—В–Ї–Њ–є –њ–Є—А–Є–і–Є–љ–Њ–Љ –Є–ї–Є –±–µ–Ј –љ–µ–µ. –Т –њ–Њ—Б–ї–µ–і–љ–µ–Љ —Б–ї—Г—З–∞–µ –Ї—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є —А–∞–Ј–Љ–µ—А–Њ–Љ –љ–µ –±–Њ–ї–µ–µ 1 —Б–Љ3 —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ –Є –±–µ–Ј –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 2 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 1 вАФ 8 –і–љ–µ–є (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–µ–ї–Є—З–Є–љ—Л). –Ч–∞—В–µ–Љ –њ–µ—А–µ–Ї–ї–∞–і—Л–≤–∞—О—В –љ–∞ 0,5 вАФ 6 —З –≤ —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞, –±—Л—Б—В—А–Њ –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 20 % —А–∞—Б—В–≤–Њ—А —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –љ–∞ 12 вАФ24 —З. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї –Ї–∞–Ї –Љ–Њ–ґ–љ–Њ –±—Л—Б—В—А–µ–µ –Ј–∞–ї–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ.
–С–Њ–ї–µ–µ –љ–∞–і–µ–ґ–љ–Њ–є —П–≤–ї—П–µ—В—Б—П —В–Њ—В–∞–ї—М–љ–∞—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П —Б –њ–Є—А–Є–і–Є–љ–Њ–Љ –њ–Њ –С–Є–ї—И–Њ–≤—Б–Ї–Њ–Љ—Г.
1. –Ю—А–≥–∞–љ—Л, —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–µ –љ–µ –Љ–µ–љ–µ–µ 1 –љ–µ–і –≤ –љ–µ–є—В—А–∞–ї—М–љ–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ (–Њ—В 1:4 –і–Њ 1:9), —А–∞–Ј—А–µ–Ј–∞—О—В –љ–∞ –Ї—Г—Б–Њ—З–Ї–Є —В–Њ–ї—Й–Є–љ–Њ–є –љ–µ –±–Њ–ї–µ–µ 0,5 —Б–Љ –Є –љ–∞ 3 вАФ 4 –і–љ—П –њ–Њ–Љ–µ—Й–∞—О—В –≤ —З–Є—Б—В—Л–є –љ–µ—А–∞–Ј–≤–µ–і–µ–љ–љ—Л–є –њ–Є—А–Є–і–Є–љ –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ.
2. –Я—А–Њ–Љ—Л–≤–∞—О—В 12 вАФ 24 —З –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –Є —Б—В–Њ–ї—М–Ї–Њ –ґ–µ –≤ —З–∞—Б—В–Њ —Б–Љ–µ–љ—П–µ–Љ–Њ–є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
3. –Я—А–Њ–њ–Є—В—Л–≤–∞—О—В –≤ 3 % —А–∞—Б—В–≤–Њ—А–µ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –њ—А–Є 36 ¬∞–° 3 вАФ 5 –і–љ–µ–є.
4. –С—Л—Б—В—А–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
5. –Я–Њ–Љ–µ—Й–∞—О—В –љ–∞ 24 —З –≤ —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ (–≥–Њ—В–Њ–≤—П—В —В–∞–Ї –ґ–µ, –Ї–∞–Ї –і–ї—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є —Б—А–µ–Ј–Њ–≤, –љ–Њ –і–Њ–ї–Є–≤–∞—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –і–Њ 100 –Љ–ї).
6. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ —З–∞—Б—В–Њ —Б–Љ–µ–љ—П–µ–Љ–Њ–є –≤–Њ–і–µ (–њ–Њ –С–Є–ї—И–Њ–≤—Б–Ї–Њ–Љ—Г –і–Њ 1 —З –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —В–Њ–ї—Й–Є–љ—Л –±–ї–Њ–Ї–∞, –њ–Њ –С—Г–Ї–µ, 2 —З).
7. –Т–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –≤ –љ–µ–є—В—А–∞–ї—М–љ–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ (1:9) 10 вАФ 12 —З.
8. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –±—Л—Б—В—А–Њ –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–њ–Є—А—В—Л, –Ј–∞–ї–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ; –Ј–Њ–ї–Њ—З–µ–љ–Є–µ –Є —Д–Є–Ї—Б–∞—Ж–Є—О –њ—А–Њ–≤–Њ–і—П—В –љ–∞ —Б—А–µ–Ј–∞—Е.
–Я—А–Є —В–Њ—В–∞–ї—М–љ–Њ–є –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ–Є—А–Є–і–Є–љ–∞ –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Љ–∞—В–µ—А–Є–∞–ї, –љ–∞—Е–Њ–і–Є–≤—И–Є–є—Б—П –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –ї–µ—В. –Я—А–Є —Н—В–Њ–Љ –Љ–µ—В–Њ–і–µ –≥–ї–Є—П –Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–∞—П —В–Ї–∞–љ—М –Њ–±—Л—З–љ–Њ –Њ—В—Б—В—Г–њ–∞—О—В –љ–∞ –Ј–∞–і–љ–Є–є –њ–ї–∞–љ –Є–ї–Є –≤—Л–і–µ–ї—П—О—В—Б—П –±–ї–∞–≥–Њ–і–∞—А—П –Є–љ–Њ–Љ—Г —В–Њ–љ—Г –Њ–Ї—А–∞—Б–Ї–Є. –§–Є–±—А–Є–ї–ї—П—А–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤—Л—П–≤–ї—П—О—В—Б—П –Љ–µ–љ–µ–µ —З–µ—В–Ї–Њ, —З–µ–Љ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞, –Љ–Њ—В–Њ—А–љ—Л–µ –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л–µ –Ї–Њ–љ—Ж–µ–≤—Л–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–µ—А–≤–Њ–≤, –љ–∞–Њ–±–Њ—А–Њ—В, –≤–Є–і–љ—Л –Њ—В—З–µ—В–ї–Є–≤–Њ.
–Э–µ—А–µ–і–Ї–Њ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –њ—А–Њ—В–µ–Ї–∞–µ—В —Е–Њ—А–Њ—И–Њ –љ–µ –≤–Њ –≤—Б–µ–Љ –Ї—Г—Б–Њ—З–Ї–µ, –∞ –ї–Є—И—М –≤ –µ–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –Ј–Њ–љ–∞—Е. –С–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞–±–ї—О–і–∞—О—В—Б—П –≤ —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л—Е —В–Ї–∞–љ—П—Е, –Ї–Њ—В–Њ—А—Л–µ –ї–µ–≥—З–µ –њ—А–Њ–њ–Є—В—Л–≤–∞—О—В—Б—П.
–Ь. –С–Є–ї—М—И–Њ–≤—Б–Ї–Є–є —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —Б–µ—А–µ–±—А–∞ –љ–µ —Д–Њ—А–Љ–∞–ї–Є–љ, –∞ —Б–Љ–µ—Б—М, —Б–Њ—Б—В–Њ—П—Й—Г—О –Є–Ј 75 –Љ–ї 30 % —А–∞—Б—В–≤–Њ—А–∞ —Д—А—Г–Ї—В–Њ–Ј—Л, 75 –Љ–ї 10 % —А–∞—Б—В–≤–Њ—А–∞ —Б–µ–≥–љ–µ—В–Њ–≤–Њ–є —Б–Њ–ї–Є, 20 –Љ–ї 10 % —А–∞—Б—В–≤–Њ—А–∞ –Ї–∞—А–±–Њ–љ–∞—В–∞ –Ї–∞–ї–Є—П –Є 5 –Љ–ї —З–Є—Б—В–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞. –Ш–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –±–ї–Њ–Ї–Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ —Н—В—Г —Б–Љ–µ—Б—М –љ–∞ 24 —З –њ—А–Є 50 ¬∞–°. –Ч–∞—В–µ–Љ —Б–ї–µ–і—Г—О—В –њ—А–Њ–Љ—Л–≤–∞–љ–Є–µ –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞–љ–Є–µ –Є –Ј–∞–ї–Є–≤–Ї–∞.
–°–Љ–µ—Б—М –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Є–Љ–µ–љ–µ–љ–∞ –Є –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б—А–µ–Ј–Њ–≤. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ —Б—А–µ–Ј—Л –њ–Њ—Б–ї–µ –њ—А–Њ–њ–Є—В—Л–≤–∞–љ–Є—П –≤ —А–∞—Б—В–≤–Њ—А–µ –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ –±—Л—Б—В—А–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –Є –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ 1 вАФ 2 –Љ–Є–љ –≤ —Г–Ї–∞–Ј–∞–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А, –њ–Њ–і–Њ–≥—А–µ—В—Л–є –і–Њ 50 ¬∞–°. –Ч–∞—В–µ–Љ —Б–ї–µ–і—Г—О—В –њ—А–Њ–Љ—Л–≤–∞–љ–Є–µ, –Ј–Њ–ї–Њ—З–µ–љ–Є–µ –Є —В.–њ.
–° –њ–Њ–Љ–Њ—Й—М—О –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—Й–µ–є —Б–Љ–µ—Б–Є –њ–Њ –С–Є–ї—М—И–Њ–≤—Б–Ї–Њ–Љ—Г –Њ—Б–Њ–±–µ–љ–љ–Њ —Е–Њ—А–Њ—И–Њ –≤—Л—П–≤–ї—П—О—В—Б—П –њ–µ—А–Є—Ж–µ–ї–ї—О–ї—П—А–љ—Л–µ –Ї–Њ–љ—Ж–µ–≤—Л–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –¶–Э–°.
==========================================================
–Ь–µ—В–Њ–і –Р–і—Н—А–∞ –Є –Т–Є—В–≥–Є–ї–Є—О
(–і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї –Є —Б–Є–љ–∞–њ—Б–Њ–≤)
–У–Њ–ї–Њ–≤–љ–Њ–є –Љ–Њ–Ј–≥ –Ї–Њ—И–Ї–Є —Д–Є–Ї—Б–Є—А—Г—О—В –≤ –і–≤–∞–ґ–і—Л —Б–Љ–µ–љ—П–µ–Љ–Њ–Љ –∞—Ж–µ—В–Њ–љ–µ –њ–Њ 24 —З –≤ –Ї–∞–ґ–і–Њ–Љ. –Ч–∞–ї–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ –≤ —В–µ—З–µ–љ–Є–µ 18 вАФ 24 —З. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 15вАФ20 –Љ–Ї–Љ –і–µ–њ–∞—А–∞—Д–Є–љ–Є—А—Г—О—В, –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 100 % —Б–њ–Є—А—В–µ –Є –Њ–њ—Г—Б–Ї–∞—О—В –љ–∞ 6 —З –≤ 1 % —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞–Ї–∞ –љ–∞ –∞–±—Б–Њ–ї—О—В–љ–Њ–Љ —Б–њ–Є—А—В–µ. –Ч–∞—В–µ–Љ –њ–Њ–≥—А—Г–ґ–∞—О—В –љ–∞ 6 —З –≤ –њ–Є—А–Є–і–Є–љ. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 2 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –љ–∞ 12 —З –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 30 ¬∞–°, –Ј–∞—В–µ–Љ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 100 % —Б–њ–Є—А—В–µ. –Т–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В —Б–µ—А–µ–±—А–Њ –≤ —А–∞—Б—В–≤–Њ—А–µ –њ–Є—А–Њ–≥–∞–ї–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б —Д–Њ—А–Љ–∞–ї–Є–љ–Њ–Љ (95 –Љ–ї 95 % —Б–њ–Є—А—В–∞, 3 –≥ –њ–Є—А–Њ–≥–∞–ї–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є 8 –Љ–ї —Д–Њ—А–Љ–∞–ї–Є–љ–∞).
–Ф–∞–ї–µ–µ –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј –і–≤–∞–ґ–і—Л —Б–Љ–µ–љ—П–µ–Љ—Л–є —Б–њ–Є—А—В, –њ—А–Њ–Љ—Л–≤–∞—О—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–∞–Ј –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В 1 % —В—А–Є—Е–ї–Њ—А–Є–і–Њ–Љ –Ј–Њ–ї–Њ—В–∞ –і–Њ –Њ–±–µ—Б—Ж–≤–µ—З–Є–≤–∞–љ–Є—П. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 6 вАФ8 –њ–Њ—А—Ж–Є—П—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
–Ф–ї—П —Г—Б–Є–ї–µ–љ–Є—П –Њ–Ї—А–∞—Б–Ї–Є —Б—А–µ–Ј—Л –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В 3 вАФ 4 –Љ–Є–љ –≤ 1 % —А–∞—Б—В–≤–Њ—А–µ —Й–∞–≤–µ–ї–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л. –°–љ–Њ–≤–∞ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 6-8 –њ–Њ—А—Ж–Є—П—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–Њ–≥—А—Г–ґ–∞—О—В –љ–∞ 5вАФ10 –Љ–Є–љ –≤ 10 % —А–∞—Б—В–≤–Њ—А —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П. –Ф–∞–ї–µ–µ –њ—А–Њ–Љ—Л–≤–∞—О—В, –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В –≤ —Б–њ–Є—А—В–∞—Е, –њ—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–∞—Е –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В: —Е–Њ—А–Њ—И–Њ –≤—Л—А–∞–ґ–µ–љ—Л –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—Л —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞, –≤–Є–і–љ—Л –Ї–Њ–љ–µ—З–љ—Л–µ –Ї–Њ–ї–µ—З–Ї–Є –Є –Ї–Њ–ї–±–Њ—З–Ї–Є.
==========================================================
–Ь–µ—В–Њ–і—Л –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—П
–Ь–µ—В–Њ–і—Л –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л–µ S. Ramon y Cajal, –њ—А–Є–Љ–µ–љ—П—О—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ —Д–Њ—А–Љ–µ —В–Њ—В–∞–ї—М–љ–Њ–є –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є. –Я—А–Є–љ—Ж–Є–њ –Љ–µ—В–Њ–і–Њ–≤ –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —В–Њ–Љ, —З—В–Њ —Б–≤–µ–ґ–µ–≤–Ј—П—В—Л–µ –Ї—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є —Б—А–∞–Ј—Г –Є–ї–Є –њ–Њ—Б–ї–µ —Д–Є–Ї—Б–∞—Ж–Є–Є —Б–њ–Є—А—В–Њ–Љ –њ—А–Њ–њ–Є—В—Л–≤–∞—О—В —А–∞—Б—В–≤–Њ—А–Њ–Љ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, –∞ –Њ–±—А–∞–Ј–Њ–≤–∞–≤—И–Є–µ—Б—П –њ—А–Є —Н—В–Њ–Љ —Б–Њ–µ–і–Є–љ–µ–љ–Є—П —Б–µ—А–µ–±—А–∞ –≤–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –њ—А–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Њ–±—А–∞–±–Њ—В–Ї–µ –њ–Є—А–Њ–≥–∞–ї–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є –Є–ї–Є –≥–Є–і—А–Њ—Е–Є–љ–Њ–љ–Њ–Љ.
–Э–µ–і–Њ—Б—В–∞—В–Њ–Ї –Љ–µ—В–Њ–і–Њ–≤ —Б–Њ—Б—В–Њ–Є—В –≤ —В–Њ–Љ, —З—В–Њ –≤ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї—Г—Б–Њ—З–Ї–µ –њ—А–Є–≥–Њ–і–љ–Њ–є –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ–±—Л—З–љ–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –ї–Є—И—М —Б—А–µ–і–љ—П—П –Ј–Њ–љ–∞, —В–∞–Ї –Ї–∞–Ї —А–∞—Б—В–≤–Њ—А —Б–µ—А–µ–±—А–∞ –љ–µ –њ—А–Њ–љ–Є–Ї–∞–µ—В –≤ –≥–ї—Г–±–Њ–Ї–Є–µ —Б–ї–Њ–Є. –Э–∞—А—Г–ґ–љ–∞—П –Ј–Њ–љ–∞ –љ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–Є–ї—М–љ–Њ–≥–Њ –Ј–∞—З–µ—А–љ–µ–љ–Є—П. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —З–∞—Б—В–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Б–ґ–∞—В–Є–µ —В–Ї–∞–љ–Є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Њ–±—Й–∞—П —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ –Њ—З–µ–љ—М —Е–Њ—А–Њ—И–µ–є. –Т –љ–Њ–≤—Л—Е –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П—Е –Љ–µ—В–Њ–і–∞ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –љ–∞ —Б—А–µ–Ј–∞—Е —Н—В–Є –љ–µ–і–Њ—Б—В–∞—В–Ї–Є —Г—Б—В—А–∞–љ—П—О—В—Б—П.
–Т —А–∞—Б—В–≤–Њ—А–∞—Е —Б–µ—А–µ–±—А–∞ –њ—А–µ–њ–∞—А–∞—В—Л –і–Њ–ї–ґ–љ—Л –љ–∞—Е–Њ–і–Є—В—М—Б—П –≤—Б–µ –≤—А–µ–Љ—П –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б–≤–µ—В–∞ (–Ї–Њ—А–Є—З–љ–µ–≤—Л–µ —Б–Ї–ї—П–љ–Ї–Є —Б –њ—А–Є—И–ї–Є—Д–Њ–≤–∞–љ–љ—Л–Љ–Є –њ—А–Њ–±–Ї–∞–Љ–Є, –Њ–±–µ—А—В–Ї–Є –Є–Ј –Ї–∞—А—В–Њ–љ–∞ –Є —В.–њ.). –Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –љ–µ –і–Њ–ї–ґ–љ—Л –±—Л—В—М —В–Њ–ї—Й–µ 3 –Љ–Љ.
–Ь–µ—В–Њ–і I.
–Я—А–Є–≥–Њ–і–µ–љ –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Љ–µ–ї–Ї–Є—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –∞ —В–∞–Ї–ґ–µ —Н–Љ–±—А–Є–Њ–љ–Њ–≤ –Є –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Ї—А—Г–њ–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –њ–Є—А–∞–Љ–Є–і–љ—Л–µ –Ї–ї–µ—В–Ї–Є –±–Њ–ї—М—И–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –Ї–ї–µ—В–Ї–Є-–Ј–µ—А–љ–∞ –Љ–Њ–Ј–ґ–µ—З–Ї–∞.
1. –°–≤–µ–ґ–µ–≤–Ј—П—В—Л–µ –Ї—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 3 вАФ 5 –і–љ–µ–є –≤ 0,75 вАФ 3 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –њ—А–Є 35 ¬∞–° –і–Њ –њ–Њ—П–≤–ї–µ–љ–Є—П —В–∞–±–∞—З–љ–Њ-–Ї–Њ—А–Є—З–љ–µ–≤–Њ–є –Њ–Ї—А–∞—Б–Ї–Є –Ї—Г—Б–Њ—З–Ї–Њ–≤.
2. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є 1 –Љ–Є–љ.
3. –Т–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В 24 —З –≤ —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 1 вАФ 2 –≥ –њ–Є—А–Њ–≥–∞–ї–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–ї–Є –≥–Є–і—А–Њ—Е–Є–љ–Њ–љ–∞, 5 –Љ–ї –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
4. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ 5 –Љ–Є–љ.
5. –Ч–∞–ї–Є–≤–∞—О—В –≤ —Ж–µ–ї–ї–Њ–Є–і–Є–љ –Є–ї–Є –њ–∞—А–∞—Д–Є–љ.
–Ю–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—В—М —Б–ї–µ–і—Г–µ—В –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –±—Л—Б—В—А–Њ, –Њ–Ї–Њ–ї–Њ 5-6 —З.
–Ф–ї—П –Њ–±—А–∞–±–Њ—В–Ї–Є –Љ–∞—В–µ—А–Є–∞–ї–∞, –≤–Ј—П—В–Њ–≥–Њ —Г –љ–Њ–≤–Њ—А–Њ–ґ–і–µ–љ–љ—Л—Е –Є —Н–Љ–±—А–Є–Њ–љ–Њ–≤, –±–µ—А—Г—В 0,75 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, —Г –≤–Ј—А–Њ—Б–ї—Л—Е –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—ЕвАФ3 %, —Г –±–µ—Б–њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—ЕвАФ6 % —А–∞—Б—В–≤–Њ—А. –Э–∞ 2вАФ3 –Ї—Г—Б–Њ—З–Ї–∞ —А–∞—Б—Е–Њ–і—Г—О—В 80вАФ100 –Љ–ї —А–∞—Б—В–≤–Њ—А–∞.
–Ь–µ—В–Њ–і II.
–Я—А–Є–≥–Њ–і–µ–љ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Љ—П–Ї–Њ—В–љ—Л—Е –Є –±–µ–Ј–Љ—П–Ї–Њ—В–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ, –њ–µ—А–Є—Ж–µ–ї–ї—О–ї—П—А–љ—Л—Е —А–∞–Ј–≤–µ—В–≤–ї–µ–љ–Є–є, –±–Њ–ї—М—И–Є—Е –Є —Б—А–µ–і–љ–Є—Е –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –Њ—Б–Њ–±–µ–љ–љ–Њ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Љ–Њ–Ј–ґ–µ—З–Ї–∞, —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –Њ–Ї–Њ–љ—З–∞–љ–Є–є –Є —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е —Б—В–∞–і–Є–є.
1. –Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 96 % –Є–ї–Є 100 % —Б–њ–Є—А—В–µ 24 —З.
2. –†–∞–Ј—А–µ–Ј–∞—О—В –љ–∞ –Ї—Г—Б–Њ—З–Ї–Є —В–Њ–ї—Й–Є–љ–Њ–є 2,5вАФ3 –Љ–Љ, –Є–Љ–њ—А–µ–≥–љ–Є—А—Г—О—В 5вАФ7 –і–љ–µ–є –≤ 1вАФ1,5 % —А–∞—Б—В–≤–Њ—А–µ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –њ—А–Є 30вАФ35 ¬∞–°.
3. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є 1 –Љ–Є–љ.
4. –Т–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В 24 —З –≤ —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 1вАФ2 –≥ –њ–Є—А–Њ–≥–∞–ї–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є–ї–Є –≥–Є–і—А–Њ—Е–Є–љ–Њ–љ–∞, 5 –Љ–ї –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
5. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є 5 –Љ–Є–љ.
6. –Ч–∞–ї–Є–≤–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ –Є–ї–Є —Ж–µ–ї–ї–Њ–Є–і–Є–љ; –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—В—М —Б–ї–µ–і—Г–µ—В –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –±—Л—Б—В—А–µ–µ (–њ—А–Є–Љ–µ—А–љ–Њ 5-6 —З).
–Т —В–Њ–Љ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П —Б–ї–Є—И–Ї–Њ–Љ —Б–≤–µ—В–ї–∞—П, —Б—А–µ–Ј—Л 5 вАФ 10 –Љ–Є–љ –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –≤ —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 3 –≥ —В–Є–Њ—Ж–Є–∞–љ–∞—В–∞ –∞–Љ–Љ–Њ–љ–Є—П. 3 –≥ —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П, 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–∞–њ–µ–ї—М 1 % —А–∞—Б—В–≤–Њ—А–∞ —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞. –Х—Б–ї–Є –Ї —Б–њ–Є—А—В—Г, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–Љ—Г –і–ї—П —Д–Є–Ї—Б–∞—Ж–Є–Є, –і–Њ–±–∞–≤–Є—В—М –≤–µ—А–Њ–љ–∞–ї, —Е–ї–Њ—А–∞–ї–≥–Є–і—А–∞—В –Є —В.–њ. (–љ–∞ 50 –Љ–ї 1 –≥), —В–Њ –і–ї—П –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –≤ —А–∞—Б—В–≤–Њ—А–µ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –њ–Њ—В—А–µ–±—Г–µ—В—Б—П —В–Њ–ї—М–Ї–Њ 5 –і–љ–µ–є. –≠—В–Њ –і–µ–ї–∞–µ—В –Љ–µ—В–Њ–і –±–Њ–ї–µ–µ –љ–∞–і–µ–ґ–љ—Л–Љ, –Є –Њ–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Є–Љ–µ–љ–µ–љ –љ–∞ –Љ–∞—В–µ—А–Є–∞–ї–µ, –і–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П –ї–µ–ґ–∞–≤—И–µ–Љ –≤ —Б–њ–Є—А—В–µ.
–Ь–µ—В–Њ–і III.
–Ю—Б–Њ–±–µ–љ–љ–Њ –њ–Њ–Ї–∞–Ј–∞–љ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л—Е —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –≥–∞–љ–≥–ї–Є–µ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞, –Ї–Њ—И–Ї–Є, —Б–Њ–±–∞–Ї–Є, –Ї—А–Њ–ї–Є–Ї–∞.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В 24 —З –≤ —Б–Љ–µ—Б–Є 50 –Љ–ї 96 % –Є–ї–Є 100 % —Б–њ–Є—А—В–∞ –Є 1вАФ12 –Ї–∞–њ–µ–ї—М (–і–ї—П –±–Њ–ї—М—И–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ 1вАФ3 –Ї–∞–њ–ї–Є, –Љ–Њ–Ј¬≠–ґ–µ—З–Ї–∞вАФ4, —Б–њ–Є–љ–љ–Њ–≥–Њ –Є –њ—А–Њ–і–Њ–ї–≥–Њ–≤–∞—В–Њ–≥–Њ –Љ–Њ–Ј–≥–∞вАФ8вАФ12, –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –Њ–Ї–Њ–љ—З–∞–љ–Є–є вАФ 2 вАФ3) —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞ (–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–∞—П –Љ–∞—Б—Б–∞ 0,910). –Х—Б–ї–Є –∞–Љ–Љ–Є–∞–Ї–∞ –і–Њ–±–∞–≤–ї–µ–љ–Њ —Б–ї–Є—И–Ї–Њ–Љ –Љ–љ–Њ–≥–Њ, —В–Њ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –њ–Њ–ї—Г—З–∞–µ—В—Б—П –±–ї–µ–і–љ–∞—П. –°–ґ–∞—В–Є–µ –Љ–Њ–ґ–љ–Њ —Г–Љ–µ–љ—М—И–Є—В—М, –µ—Б–ї–Є –Њ–±—К–µ–Ї—В –≤–љ–∞—З–∞–ї–µ –њ–Њ–Љ–µ—Б—В–Є—В—М –љ–∞ 6 —З –≤ 70 % —Б–њ–Є—А—В, –Ј–∞—В–µ–Љ –љ–∞ 2вАФ4 —З –≤ 85 % —Б–њ–Є—А—В –Є –ї–Є—И—М –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ –њ–µ—А–µ–љ–µ—Б—В–Є –≤ –∞–Љ–Љ–Є–∞—З–љ—Л–є —Б–њ–Є—А—В. –Я–Њ—Б–ї–µ –Њ–±—Б—Г—И–Є–≤–∞–љ–Є—П —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є –Њ–±—А–∞–±–Њ—В–Ї—Г –њ—А–Њ–≤–Њ–і—П—В —В–∞–Ї –ґ–µ, –Ї–∞–Ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—В–Њ–і–∞ II.
–Ь–µ—В–Њ–і IV.
–Я—А–Є–≥–Њ–і–µ–љ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –±–µ–Ј–Љ—П–Ї–Њ—В–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –¶–Э–°, –њ–µ—А–Є—Ж–µ–ї–ї—О–ї—П—А–љ—Л—Е —А–∞–Ј–≤–µ—В–≤–ї–µ–љ–Є–є, –Љ–Њ—Е–Њ–≤–Є–і–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Љ–Њ–Ј–ґ–µ—З–Ї–∞.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Б–Љ–µ—Б–Є 15 –Љ–ї —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є 85 –Љ–ї –≤–Њ–і—Л; –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ 6 вАФ 12 —З; –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 24 —З –≤ 50 –Љ–ї 96 % —Б–њ–Є—А—В–∞, –Ї –Ї–Њ—В–Њ—А–Њ–Љ—Г –і–Њ–±–∞–≤–ї–µ–љ–Њ 5 –Ї–∞–њ–µ–ї—М —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞; –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є; –і–∞–ї–µ–µ –Њ–±—А–∞–±–Њ—В–Ї—Г –њ—А–Њ–≤–Њ–і—П—В —В–∞–Ї –ґ–µ, –Ї–∞–Ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—В–Њ–і–∞ II.
–Ь–µ—В–Њ–і V.
–•–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–∞—О—В –љ–∞ —Н–Љ–±—А–Є–Њ–љ–∞—Е, –∞ —Г –≤–Ј—А–Њ—Б–ї—Л—Е –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї, –љ–µ—А–≤–љ—Л—Е –Њ–Ї–Њ–љ—З–∞–љ–Є–є –Є –њ—А–Њ—Ж–µ—Б—Б–∞ —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –љ–µ—А–≤–Њ–≤ (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –њ–µ—А–≤—Л—Е —Б—В–∞–і–Є–є).
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В 24 —З –≤ 70 % –њ–Є—А–Є–і–Є–љ–µ –Є–ї–Є —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 40 —З–∞—Б—В–µ–є –њ–Є—А–Є–і–Є–љ–∞ –Є 30 —З–∞—Б—В–µ–є 95 % —Б–њ–Є—А—В–∞; –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –і–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –Ј–∞–њ–∞—Е–∞ 12вАФ24 —З; –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ 6-12 —З –≤ 95 % —Б–њ–Є—А—В; –і–∞–ї–µ–µ –Њ–±—А–∞–±–Њ—В–Ї—Г –≤–µ–і—Г—В —В–∞–Ї –ґ–µ, –Ї–∞–Ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—В–Њ–і–∞ II.
–Ь–µ—В–Њ–і VI.
–Я—А–Є–≥–Њ–і–µ–љ –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е –Ї–Њ–љ—Ж–µ–≤—Л—Е –њ–ї–∞—Б—В–Є–љ–Њ–Ї, –њ–µ—А–Є—Ж–µ–ї–ї—О–ї—П—А–љ—Л—Е —А–∞–Ј–≤–µ—В–≤–ї–µ–љ–Є–є, –Љ–Њ–Ј–ґ–µ—З–Ї–∞.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В 24 —З –≤ —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 5 –≥ —Е–ї–Њ—А–∞–ї–≥–Є–і—А–∞—В–∞, 25 –Љ–ї 100 % —Б–њ–Є—А—В–∞ –Є 75 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л; –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ 1 –Љ–Є–љ; –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 24 —З –≤ 50 –Љ–ї 100 % —Б–њ–Є—А—В–∞, –≤ –Ї–Њ—В–Њ—А—Л–є –і–Њ–±–∞–≤–ї–µ–љ–Њ 4 –Ї–∞–њ–ї–Є —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞; –њ—А–Њ–Љ—Л–≤–∞—О—В 12 вАФ 24 —З –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –Є 2 вАФ 5 —З –≤ —З–∞—Б—В–Њ —Б–Љ–µ–љ—П–µ–Љ–Њ–є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ; –і–∞–ї–µ–µ –Њ–±—А–∞–±–Њ—В–Ї—Г –≤–µ–і—Г—В —В–∞–Ї –ґ–µ, –Ї–∞–Ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Љ–µ—В–Њ–і–∞ II.
–Ш–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П –Ј–∞–Љ–Њ—А–Њ–ґ–µ–љ–љ—Л—Е —Б—А–µ–Ј–Њ–≤.
–Ь–µ—В–Њ–і –њ—А–Є–≥–Њ–і–µ–љ –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±–Њ–ї—М—И–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Љ–Њ–Ј–ґ–µ—З–Ї–∞, –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е –Ї–Њ–љ—Ж–µ–≤—Л—Е –њ–ї–∞—Б—В–Є–љ–Њ–Ї, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П.
1. –Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ (1:4) 3 –і–љ—П –Є–ї–Є –і–Њ–ї—М—И–µ.
2. –Ч–∞–Љ–Њ—А–Њ–ґ–µ–љ–љ—Л–µ —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 30-40 –Љ–Ї–Љ —Б–Њ–±–Є—А–∞—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ.
3. –Я–Њ—Б–ї–µ –±—Л—Б—В—А–Њ–≥–Њ (–љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–Є–љ—Г—В) –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –њ–Њ–Љ–µ—Й–∞—О—В –≤ —Б–Љ–µ—Б—М, —Б–Њ—Б—В–Њ—П—Й—Г—О –Є–Ј 12 –Љ–ї 2 % —А–∞—Б—В–≤–Њ—А–∞ –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞, 7-10 –Ї–∞–њ–µ–ї—М –њ–Є—А–Є–і–Є–љ–∞ –Є 5-6 –Љ–ї 97 % —Б–њ–Є—А—В–∞, –≤ –Ї–Њ—В–Њ—А–Њ–є —Б—А–µ–Ј—Л –Ј–∞ 4-6 —З –і–Њ–ї–ґ–љ—Л —Б—В–∞—В—М —Б–≤–µ—В–ї–Њ-–Ї–Њ—А–Є—З–љ–µ–≤—Л–Љ–Є; –µ—Б–ї–Є —Н—В–Њ–≥–Њ –љ–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В, —В–Њ —Б–ї–µ–і—Г–µ—В –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–Є–љ—Г—В –њ–Њ–і–Њ–≥—А–µ—В—М –љ–∞–і –њ–ї–∞–Љ–µ–љ–µ–Љ.
4. –Ю—В–і–µ–ї—М–љ—Л–µ —Б—А–µ–Ј—Л –љ–∞ 2вАФ4 —Б –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ 100 % —Б–њ–Є—А—В.
5. –Т–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В 1вАФ3 –Љ–Є–љ –≤ —Б–Љ–µ—Б–Є, –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А–Њ–є –≤—Е–Њ–і—П—В 0,3 –≥ –≥–Є–і—А–Њ—Е–Є–љ–Њ–љ–∞, 70 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, 20 –Љ–ї —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є 15 –Љ–ї –∞—Ж–µ—В–Њ–љ–∞.
6. –Ю—Б–љ–Њ–≤–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –≤–Њ–і–µ, –Ј–Њ–ї–Њ—В—П—В –Є —Д–Є–Ї—Б–Є—А—Г—О—В –Ї–∞–Ї –Њ–±—Л—З–љ–Њ.
7. –Я—А–Њ–Љ—Л–≤–∞—О—В, –Є–Ј–≤–ї–µ–Ї–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є.
8. –Я—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 100 % —Б–њ–Є—А—В, –≥–≤–Њ–Ј–і–Є—З–љ–Њ–µ –Љ–∞—Б–ї–Њ, –Ї—Б–Є–ї–Њ–ї, –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–Т —В–Њ–Љ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –љ–µ —Г–і–∞–µ—В—Б—П –≤—Л—П–≤–Є—В—М –Љ—П–Ї–Њ—В–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –±–µ–ї–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞, —В–Њ –њ–µ—А–µ–і —Б–µ—А–µ–±—А—П–љ–Њ–є –≤–∞–љ–љ–Њ–є –Ј–∞–Љ–Њ—А–Њ–ґ–µ–љ–љ—Л–µ —Б—А–µ–Ј—Л 2 —З –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –≤ —Б–Љ–µ—Б–Є, —Б–Њ—Б—В–Њ—П—Й–µ–є –Є–Ј 10 –Љ–ї 100 % —Б–њ–Є—А—В–∞, 10 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є 8-10 –Ї–∞–њ–µ–ї—М –∞–Љ–Љ–Є–∞–Ї–∞. –Ч–∞—В–µ–Љ –њ—А–Њ–Љ—Л–≤–∞—О—В, –њ–Њ–Љ–µ—Й–∞—О—В –≤ —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ —Б –њ–Є—А–Є–і–Є–љ–Њ–Љ –Є —В.–і.
==========================================================
–Ь–µ—В–Њ–і –†–∞–Љ–Њ–љ–∞вАФ–Ы–µ—А–Љ–Є—В—В–∞
(–≤—Л—П–≤–ї–µ–љ–Є–µ –і–µ–≥–µ–љ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–Є–љ–∞–њ—Б–Њ–≤)
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % –љ–µ–є—В—А–∞–ї—М–љ–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ –≤ —В–µ—З–µ–љ–Є–µ 1-2 –љ–µ–і –Є–ї–Є –і–Њ–ї—М—И–µ. –Ч–∞—В–µ–Љ –µ–≥–Њ –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ 1 —З –≤ 40 % —Д–Њ—А–Љ–∞–ї–Є–љ, 2 —З –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –Є 2 —З -–≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 15 вАФ 20 –Љ–Ї–Љ –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ. –Ш–Ј –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є—Е –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 20 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 50 вАФ 53 ¬∞–° (–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–µ–±—Л–≤–∞–љ–Є—П –≤ —Н—В–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ —Б—А–µ–Ј–Њ–≤ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ вАФ 50 –Љ–Є–љ, –њ—А–Њ–і–Њ–ї–≥–Њ–≤–∞—В–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –Ї–Њ—А—Л –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ вАФ 60 –Љ–Є–љ, –Љ–Њ–Ј–ґ–µ—З–Ї–∞ –Є —В–∞–ї–∞–Љ—Г—Б–∞ вАФ 80 –Љ–Є–љ). –Я–Њ—Б–ї–µ –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є —Б—А–µ–Ј—Л –і–Њ–ї–ґ–љ—Л –±—Л—В—М —В–∞–±–∞—З–љ–Њ–≥–Њ —Ж–≤–µ—В–∞.
1. –°—А–µ–Ј—Л –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –љ–∞ 5-10 –Љ–Є–љ –њ–µ—А–µ–љ–Њ—Б—П—В –≤ —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ (–≤ 20 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ –і–Њ–±–∞–≤–ї—П—В—М –њ–Њ –Ї–∞–њ–ї—П–Љ 25 % —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞–Ї–∞ –і–Њ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—П –Њ—Б–∞–і–Ї–∞ –≤ –Љ–µ—А–љ–Њ–Љ —Б—В–∞–Ї–∞–љ—З–Є–Ї–µ, –∞ –Ј–∞—В–µ–Љ –і–Њ–±–∞–≤–ї—П—О—В —Б—В–Њ–ї—М–Ї–Њ –ґ–µ —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞).
2. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
3. –Т–Њ—Б—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—О—В –≤ —Д–Њ—А–Љ–∞–ї–Є–љ–µ (1 —З–∞—Б—В—М —Д–Њ—А–Љ–∞–ї–Є–љ–∞, 2 —З–∞—Б—В–Є –≤–Њ–і–Њ–њ—А–Њ–≤–Њ–і–љ–Њ–є –≤–Њ–і—Л –Є 2 —З–∞—Б—В–Є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) 15 –Љ–Є–љ, —Б—А–µ–Ј—Л –і–Њ–ї–ґ–љ—Л —Б—В–∞—В—М –Ї–Њ—А–Є—З–љ–µ–≤–Њ-—З–µ—А–љ—Л–Љ–Є.
4. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 0,5 % —А–∞—Б—В–≤–Њ—А —В—А–Є—Е–ї–Њ—А–Є–і–∞, –Ј–Њ–ї–Њ—В–∞ –Є –і–µ—А–ґ–∞—В –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ —Б—А–µ–Ј—Л –љ–µ —Б—В–∞–љ—Г—В —Б–µ—А—Л–Љ–Є.
5. –Ч–∞–Ї—А–µ–њ–ї—П—О—В –≤ 3 % —А–∞—Б—В–≤–Њ—А–µ —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П 5 –Љ–Є–љ.
6. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ (2 вАФ 3 —Б–Љ–µ–љ—Л)
7. –Ю–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В –≤ 40 % –Є 96 % —Б–њ–Є—А—В–µ –њ–Њ 10 –Љ–Є–љ.
8. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ 10 % –Ї–∞—А–±–Њ–ї-–Ї—Б–Є–ї–Њ–ї–µ –Є 2 —Б–Љ–µ—Б—П—Е –Ї—Б–Є–ї–Њ–ї–∞ –њ–Њ 10 –Љ–Є–љ, –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
==========================================================
–Ь–µ—В–Њ–і–Є–Ї–∞ –С–Є–ї—М—И–Њ–≤—Б–Ї–Њ–≥–Њ
(–≤—Л—П–≤–ї–µ–љ–Є–µ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї,
–Њ—Б–µ–≤—Л—Е —Ж–Є–ї–Є–љ–і—А–Њ–≤ –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є —Б–µ–љ–Є–ї—М–љ—Л—Е –±–ї—П—И–µ–Ї)
–°–ї—Г–ґ–Є—В –љ–∞–Є–±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –Љ–µ—В–Њ–і–Є–Ї–Њ–є –і–ї—П –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ —Б–ї–∞–±–Њ—Г–Љ–Є—П.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ –љ–µ –Љ–µ–љ–µ–µ 2 –љ–µ–і. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 8вАФ10 –Љ–Ї–Љ –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ, —Е—А–∞–љ—П—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ, –њ–µ—А–µ–і –Њ–Ї—А–∞—Б–Ї–Њ–є –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
1. –Я–µ—А–µ–љ–Њ—Б—П—В —Б—А–µ–Ј—Л –љ–∞ 24 —З –≤ 2 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞.
2. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
3. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ –∞–Љ–Љ–Є–∞—З–љ–Њ–µ —Б–µ—А–µ–±—А–Њ –љ–∞ 25 вАФ 30 —Б.
4. –Ґ—Й–∞—В–µ–ї—М–љ–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
5. –Я–Њ–Љ–µ—Й–∞—О—В –≤ 20 % –љ–µ–є—В—А–∞–ї—М–љ—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ –љ–∞ 4 вАФ5 —Б –і–Њ –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є—П —В–µ–Љ–љ–Њ-–Ї–Њ—А–Є—З–љ–µ–≤–Њ–є –Њ–Ї—А–∞—Б–Ї–Є.
6. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
7. –Я–µ—А–µ–љ–Њ—Б—П—В 1вАФ3 —Б—А–µ–Ј–∞ –≤ 0,5 % —А–∞—Б—В–≤–Њ—А —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ (–Њ–љ–Є –і–Њ–ї–ґ–љ—Л –њ—А–Є–Њ–±—А–µ—Б—В–Є —Б–≤–µ—В–ї–Њ-—Б–µ—А—Л–є, –Љ—Л—И–Є–љ—Л–є, —Ж–≤–µ—В –±–µ–Ј –Ї–Њ—А–Є—З–љ–µ–≤—Л—Е –њ—П—В–µ–љ).
8. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г (–µ—Б–ї–Є –љ–∞ —Б—А–µ–Ј–∞—Е –њ–Њ—П–≤—П—В—Б—П –Ї–Њ—А–Є—З–љ–µ–≤—Л–µ –њ—П—В–љ–∞, —В–Њ –≤–љ–Њ–≤—М –њ–Њ–Љ–µ—Й–∞—О—В –≤ —А–∞—Б—В–≤–Њ—А —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ –і–Њ –Є—Е –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П).
9. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 5 % —А–∞—Б—В–≤–Њ—А —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П –љ–∞ 1 –Љ–Є–љ. –°—В–µ–Ї–ї—П–љ–љ—Г—О –њ–∞–ї–Њ—З–Ї—Г –њ–Њ—Б–ї–µ –њ–Њ–≥—А—Г–ґ–µ–љ–Є—П —Б–Њ —Б—А–µ–Ј–Њ–Љ –≤ —В–Є–Њ—Б—Г–ї—М—Д–∞—В –љ–∞—В—А–Є—П —Б–ї–µ–і—Г–µ—В —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л—В—М –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –њ—А–Њ—В–µ—А–µ—В—М —З–Є—Б—В–Њ–є —В–Ї–∞–љ—М—О. –Я–µ—А–µ–љ–Њ—Б–Є—В—М —Б—А–µ–Ј—Л –Є–Ј —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П –≤ —В—А–Є—Е–ї–Њ—А–Є–і –Ј–Њ–ї–Њ—В–∞ –љ–µ —Б–ї–µ–і—Г–µ—В, —В–∞–Ї –Ї–∞–Ї –њ–Њ—Б–ї–µ–і–љ–Є–є –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ —В–µ–Љ–љ–µ–µ—В –Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –љ–µ–њ—А–Є–≥–Њ–і–љ—Л–Љ –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П.
10. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –љ–∞–Ї–ї–µ–Є–≤–∞—О—В –љ–∞ —Б—В–µ–Ї–ї–Њ, —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ —Б–Љ–µ—Б—М—О –±–µ–ї–Ї–∞ —Б –≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ, –Ј–∞—В–µ–Љ —Б—В–∞–≤—П—В –љ–∞ —А–µ–±—А–Њ –і–ї—П –њ—А–Њ—Б—Г—И–Ї–Є –љ–∞ 8 вАФ 10 –Љ–Є–љ.
11. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Њ–і–љ–Њ–є –њ–Њ—А—Ж–Є–Є –Ї—Б–Є–ї–Њ–ї–∞ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ –њ–Њ–і –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ. –Х—Б–ї–Є –њ—А–µ–њ–∞—А–∞—В –њ—А–Њ—Б–≤–µ—В–ї–µ–љ –љ–µ –њ–Њ–ї–љ–Њ—Б—В—М—О, —В.–µ. –Є–Љ–µ—О—В—Б—П –Љ—Г—В–љ—Л–µ –њ—П—В–љ–∞, —В–Њ –µ–≥–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ–≥—А—Г–Ј–Є—В—М –љ–∞ 2 вАФ 3 —Б –≤ –∞—Ж–µ—В–Њ–љ, –∞ –Ј–∞—В–µ–Љ –≤–љ–Њ–≤—М –њ–Њ–Љ–µ—Б—В–Є—В—М –≤ –Ї—Б–Є–ї–Њ–ї. –≠—В—Г –њ—А–Њ—Ж–µ–і—Г—А—Г –њ–Њ–≤—В–Њ—А—П—О—В –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П —Б—А–µ–Ј–Њ–≤.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–≤–µ—В–ї–Њ–Љ —Д–Њ–љ–µ –Є–Љ–њ—А–µ–≥–љ–Є—А—Г—О—В—Б—П –Ї–Њ–љ—В—Г—А—Л –љ–µ–є—А–Њ–љ–Њ–≤, –Є—Е —П–і–µ—А; –≤ —В–µ–ї–∞—Е –љ–µ–є—А–Њ–љ–Њ–≤ –≤—Л—П–≤–ї—П—О—В—Б—П —В–Њ–љ–Ї–Є–µ –≤–Њ–ї–Њ–Ї–љ–∞ –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї –Є–ї–Є –Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—П. –Ь–µ–ґ–і—Г –Ї–ї–µ—В–Ї–∞–Љ–Є –≤–Є–і–љ–∞ —В–Њ–љ–Ї–∞—П —Б–µ—В—М –∞–Ї—Б–Њ–љ–Њ–≤ –Є –Є—Е –Ї–Њ–ї–ї–∞—В–µ—А–∞–ї–µ–є. –Р–Ї—Б–Њ—Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ —В–µ—А–Љ–Є–љ–∞–ї–Є –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —В–µ–ї –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤—Л—П–≤–ї—П—О—В –Є–Ј—А–µ–і–Ї–∞ –Є —З–∞—Б—В–Є—З–љ–Њ, –њ–Њ—Н—В–Њ–Љ—Г –Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –Є—Е –≥–Њ–≤–Њ—А–Є—В—М –љ–µ–ї—М–Ј—П. –Ш–љ–Њ–≥–і–∞ –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –≤–Њ–ї–Њ–Ї–љ–Є—Б—В—Л–µ –∞—Б—В—А–Њ—Ж–Є—В—Л.
–Я—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є —Д–Є–Ї—Б–∞—Ж–Є–Є –Љ–∞—В–µ—А–Є–∞–ї–∞ —Б –њ–Њ–Љ–Њ—Й—М—О —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –њ–Њ—Б—В–Њ—П–љ–љ–Њ –њ–Њ–ї—Г—З–∞—О—В —Е–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л. –Ч–∞—Б–Њ—А–µ–љ–Є–µ —Б—А–µ–Ј–Њ–≤ –Њ—Б–∞–і–Ї–∞–Љ–Є —Б–µ—А–µ–±—А–∞ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ–ї–Њ—Е–Њ –Њ–±—А–∞–±–Њ—В–∞–љ–љ–Њ–є –њ–Њ—Б—Г–і—Л –Є –љ–µ–і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —Б–µ—А–µ–±—А–∞. –Я—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–µ –≤ —А–∞—Б—В–≤–Њ—А–µ —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ —Б—В—А—Г–Ї—В—Г—А—Л –≤—Л–≥–ї—П–і—П—В –≥—А—Г–±–Њ –Є–Љ–њ—А–µ–≥–љ–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є —Б –Ї–Њ—А–Є—З–љ–µ–≤—Л–Љ –Њ—В—В–µ–љ–Ї–Њ–Љ, –≤ —Б—А–µ–Ј–µ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Ї–Њ—А–Є—З–љ–µ–≤—Л–µ –њ—П—В–љ–∞.
==========================================================
==========================================================
–Ь–Х–Ґ–Ю–Ф–Ђ –Ю–Ъ–†–Р–®–Ш–Т–Р–Э–Ш–ѓ –У–Ы–Ш–Ш
–Ь–µ—В–Њ–і–Є–Ї–∞ –°–љ–µ—Б–∞—А–µ–≤–∞
(–≤—Л—П–≤–ї–µ–љ–Є–µ –≤–Њ–ї–Њ–Ї–љ–Є—Б—В–Њ–є, –∞—Б—В—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –≥–ї–Є–Є –Є –≥–ї–Є–∞–ї—М–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ)
–Ь–µ—В–Њ–і–Є–Ї–∞ –≤—Л—Б–Њ–Ї–Њ–Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–∞, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –∞—Б—В—А–Њ—Ж–Є—В—Л –±–µ–ї–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –¶–Э–°, –≥–ї–Є–∞–ї—М–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞, –∞ –≤ –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е вАФ —Д–µ–љ–Њ–Љ–µ–љ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —В–Є–љ–Ї—В–Њ—А–Є–∞–ї—М–љ–Њ–є –∞—Ж–Є–і–Њ—Д–Є–ї–Є–Є (–¶–Ґ–Р) –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –±–µ—В–∞-–Ј–µ—А–љ–Є—Б—В–Њ—Б—В—М [–°–љ–µ—Б–∞—А–µ–≤ –Я.–Х., 1950]. –Я—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ –Љ–µ—В–Њ–і–Є–Ї–Є –°–љ–µ—Б–∞—А–µ–≤–∞ –њ–µ—А–µ–і –Љ–µ—В–Њ–і–Є–Ї–Њ–є –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—П –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –њ–Њ–ї—Г—З–µ–љ–Є–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Њ–Ї—А–∞—Б–Ї–Є –Њ—А–≥–∞–љ–µ–ї–ї –∞—Б—В—А–Њ—Ж–Є—В–Њ–≤ (—Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞, —П–і—А–Њ, –Њ—В—А–Њ—Б—В–Ї–Є). –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –≤—Л—П–≤–ї—П—О—В —Н—А–Є—В—А–Њ—Ж–Є—В—Л –≤ —Б–Њ—Б—Г–і–∞—Е –Є –і—А–µ–љ–∞–ґ–љ—Г—О —Б–љ–µ—Б–∞—А–µ–≤—Б–Ї—Г—О –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є—О.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ.
–°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 8вАФ 10 –Љ–Ї–Љ –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ.
1. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В —Б—А–µ–Ј—Л –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ –њ—А–Њ—Д–Є–ї—М—В—А–Њ–≤–∞–љ–љ—Л–є 1 % –≤–Њ–і–љ—Л–є —А–∞—Б—В–≤–Њ—А —Н—А–Є—В—А–Њ–Ј–Є–љ–∞ (1 –≥ —Н—А–Є—В—А–Њ–Ј–Є–љ–∞ –љ–∞ 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) –љ–∞ 20 вАФ 30 —Б (–≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Њ—Б–њ—А–Є–Є–Љ—З–Є–≤–Њ—Б—В–Є –Ї—А–∞—Б–Є—В–µ–ї—П).
2. –°—А–µ–Ј—Л —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 –Є –±–Њ–ї–µ–µ —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –і–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П –Њ—В—Е–Њ–ґ–і–µ–љ–Є—П –Ї—А–∞—Б–Ї–Є.
3. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 0,5 % —А–∞—Б—В–≤–Њ—А —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 35 вАФ40 —Б.
4. –С—Л—Б—В—А–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ —Б–Љ–µ—Б—М—О –±–µ–ї–Ї–∞ –Є –≥–ї–Є—Ж–µ—А–Є–љ–∞, —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ—В–Є—А–∞—О—В –Љ—П–≥–Ї–Њ–є —В–Ї–∞–љ—М—О —Б—В–µ–Ї–ї–Њ –≤–Њ–Ї—А—Г–≥ —Б—А–µ–Ј–∞, –њ—А–Њ–Љ–Њ–Ї–∞—О—В —Б–ї–Њ–ґ–µ–љ–љ–Њ–є –≤ 4 —А–∞–Ј–∞ —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є, –∞ –Ј–∞—В–µ–Љ —Б–Љ–Њ—З–µ–љ–љ–Њ–є –Љ–µ—В–Є–ї—Е–ї–Њ—А–Њ—Д–Њ—А–Љ–Њ–Љ (1 —З–∞—Б—В—М –Љ–µ—В–Є–ї–Њ–≤–Њ–≥–Њ —Б–њ–Є—А—В–∞ + 2 —З–∞—Б—В–Є —Е–ї–Њ—А–Њ—Д–Њ—А–Љ–∞).
5. –°—В–µ–Ї–ї–∞ —Б–Њ —Б—А–µ–Ј–∞–Љ–Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ —А–∞—Б—В–≤–Њ—А –Ь–∞—ПвАФ–У—А—О–љ–≤–∞–ї—М–і–∞ –љ–∞ 3 вАФ 5 —Б.
6. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –≤–Њ–і–Њ–њ—А–Њ–≤–Њ–і–љ–Њ–є –≤–Њ–і–µ –≤ —В–µ—З–µ–љ–Є–µ 3 вАФ 5 —Б –і–Њ —Г–і–∞–ї–µ–љ–Є—П –Є–Ј–ї–Є—И–Ї–∞ –Ї—А–∞—Б–Є—В–µ–ї—П, –њ—А–Њ—В–Є—А–∞—О—В —Б—В–µ–Ї–ї–Њ —В–Ї–∞–љ—М—О –Є –њ—А–Њ–Љ–Њ–Ї–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є.
7. –Ю–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В –≤ –∞—Ж–µ—В–Њ–љ–µ, –њ—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ –њ–Њ–і –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ.
–Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П 0,5 % —А–∞—Б—В–≤–Њ—А–∞ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 200 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –±–µ—А—Г—В 1 –≥ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –≤–Ј–±–∞–ї—В—Л–≤–∞—О—В. –Т –њ–Њ–ї—Г—З–µ–љ–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –Є–Љ–µ–µ—В—Б—П –Њ—Б–∞–і–Њ–Ї. –†–∞—Б—В–≤–Њ—А –њ–Њ–Љ–µ—Й–∞—О—В –љ–∞ 2 вАФ 3 —З –≤ —В–µ—А–Љ–Њ—Б—В–∞—В –њ—А–Є 37 вАФ 40 ¬∞–°, –њ–Њ–Ї–∞ –Њ—Б–∞–і–Њ–Ї –љ–µ —А–∞—Б—В–≤–Њ—А–Є—В—Б—П (—А–∞—Б—В–≤–Њ—А –і–Њ–ї–ґ–µ–љ –±—Л—В—М –∞–±—Б–Њ–ї—О—В–љ–Њ –њ—А–Њ–Ј—А–∞—З–љ—Л–Љ).
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ –љ–µ–ґ–љ–Њ-–≥–Њ–ї—Г–±–Њ–≤–∞—В–Њ-—Б–Є–љ–µ–≤–∞—В–Њ–Љ —Д–Њ–љ–µ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П —В–∞–Ї–Њ–≥–Њ –ґ–µ –Њ—В—В–µ–љ–Ї–∞ –∞—Б—В—А–Њ—Ж–Є—В—Л (—П–і—А–Њ, —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞, –Њ—В—А–Њ—Б—В–Ї–Є). –Т—Б–ї–µ–і—Б—В–≤–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –∞—Б—В—А–Њ—Ж–Є—В–∞—А–љ–∞—П –Ї–ї–µ—В–Ї–∞ –Љ–Њ–ґ–µ—В –љ–∞—Б—В–Њ–ї—М–Ї–Њ –Є–Ј–Љ–µ–љ–Є—В—М—Б—П, —З—В–Њ –њ–∞—В–Њ–Љ–Њ—А—Д–Њ–Ј –≤ –≤–Є–і–µ –∞–Љ–µ–±–Њ–Є–і–љ–Њ–≥–Њ –∞—Б—В—А–Њ—Ж–Є—В–∞ –±—Л–≤–∞–µ—В –љ–µ –≤—Б–µ–≥–і–∞ —П—Б–µ–љ. –ѓ–і—А–∞ –і—А–µ–љ–∞–ґ–љ–Њ–є –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Є –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ —В–∞–Ї–ґ–µ –Є–Љ–µ—О—В —Б–≤–µ—В–ї–Њ-—Б–Є–љ–µ–≤–∞—В—Г—О –Њ–Ї—А–∞—Б–Ї—Г, –Є–љ–Њ–≥–і–∞ —Б —А–Њ–Ј–Њ–≤–∞—В—Л–Љ –Њ—В—В–µ–љ–Ї–Њ–Љ (–Љ–µ—В–∞—Е—А–Њ–Љ–∞–Ј–Є—П). –§–µ–љ–Њ–Љ–µ–љ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —В–Є–љ–Ї—В–Њ—А–Є–∞–ї—М–љ–Њ–є –∞—Ж–Є–і–Њ—Д–Є–ї–Є–Є –њ—А–Є–љ–∞–і–ї–µ–ґ–Є—В –Ї –≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ —А–µ–∞–Ї—Ж–Є—П–Љ, –њ—А–Є —Н—В–Њ–Љ —Ж–µ–љ—В—А–∞–ї—М–љ–∞—П —З–∞—Б—В—М –Ї–ї–µ—В–Ї–Є вАФ —П–і—А–Њ –Є –њ—А–Є–ї–µ–ґ–∞—Й–∞—П —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞,вАФ —Б—В–∞–љ–Њ–≤–Є—В—Б—П —А–Њ–Ј–Њ–≤–Њ–є: –Њ—В —П—А–Ї–Њ¬≠–≥–Њ —Ж–≤–µ—В–∞ –і–Њ –µ–і–≤–∞ –Ј–∞–Љ–µ—В–љ–Њ–≥–Њ —А–Њ–Ј–Њ–≤–∞—В–Њ–≥–Њ –Њ—В—В–µ–љ–Ї–∞. –≠—А–Є—В—А–Њ—Ж–Є—В—Л –≤ —Б–Њ—Б—Г–і–∞—Е —А–Њ–Ј–Њ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞.
–°–ї–µ–і—Г–µ—В –Є–Љ–µ—В—М –≤ –≤–Є–і—Г, —З—В–Њ —Д–Њ—Б—Д–Њ—А–љ–Њ-–Љ–Њ–ї–Є–±–і–µ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ –Є –Љ–µ—В–Є–ї—Е–ї–Њ—А–Њ—Д–Њ—А–Љ –Љ–Њ–≥—Г—В –њ–µ—А–µ–ґ–µ—З—М —В–Ї–∞–љ—М (–њ–Њ—П–≤–ї—П–µ—В—Б—П –і—Л—А—З–∞—В–Њ—Б—В—М), –Є–Ј–ї–Є—И–µ–Ї —Н—А–Є—В—А–Њ–Ј–Є–љ–∞ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ–Њ—П–≤–ї–µ–љ–Є–µ —А–Њ–Ј–Њ–≤—Л—Е –њ—П—В–µ–љ, –њ—А–Є –Є–Ј–ї–Є—И–Ї–µ —А–∞—Б—В–≤–Њ—А–∞ –Ь–∞—П вАФ –У—А—О–љ–≤–∞–ї—М–і–∞ –Є —З—А–µ–Ј–Љ–µ—А–љ–Њ–є —В–Њ–ї—Й–Є–љ–µ —Б—А–µ–Ј–Њ–≤ (–±–Њ–ї–µ–µ 8вАФ10 –Љ–Ї–Љ) —Б—А–µ–Ј —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≥—А—Г–±—Л–Љ –Є —В–Њ–љ–Ї–∞—П —Б—В—А—Г–Ї—В—Г—А–∞ –∞—Б—В—А–Њ—Ж–Є—В–Њ–≤ –њ–ї–Њ—Е–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г–µ—В—Б—П.
==========================================================
–Ь–µ—В–Њ–і–Є–Ї–∞ –†–∞–Љ–Њ–љ-–Є-–Ъ–∞—Е–∞–ї—П
(–≤—Л—П–≤–ї–µ–љ–Є–µ –≤–Њ–ї–Њ–Ї–љ–Є—Б—В–Њ–є –Є –∞—Б—В—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –≥–ї–Є–Є)
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 8 вАФ 10 –Љ–Ї–Љ –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ, —Е—А–∞–љ—П—В –≤ —Б–≤–µ–ґ–µ–Љ 10 % –Ї–Є—Б–ї–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ.
1. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–µ—А–µ–љ–Њ—Б—П—В –љ–∞ 2 —Б—Г—В –≤ —Б–≤–µ–ґ–Є–є –±—А–Њ–Љ–Є—Б—В—Л–є —Д–Є–Ї—Б–∞—В–Њ—А (14 –Љ–ї –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞, 2 –≥ –±—А–Њ–Љ–Є–і–∞ –∞–Љ–Љ–Њ–љ–Є—П –Є 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л).
2. –Ґ—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–µ—А–µ–љ–Њ—Б—П—В –≤ —А–∞—Б—В–≤–Њ—А —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ —Б —Б—Г–ї–µ–Љ–Њ–є (8 –Љ–ї 5 % –њ—А–Њ–Ј—А–∞—З–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ —Б—Г–ї–µ–Љ—Л, 10 –Љ–ї 1 % —А–∞—Б—В–≤–Њ—А–∞ —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ –Є 60 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) –љ–∞ 1 —Б—Г—В –≤ —В–µ–Љ–љ–Њ–µ –Љ–µ—Б—В–Њ.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 5 % —А–∞—Б—В–≤–Њ—А —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П –љ–∞ 1 –Љ–Є–љ.
4. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г, –Ј–∞—В–µ–Љ –љ–∞–Ї–ї–µ–Є–≤–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ —Б–Љ–µ—Б—М—О –±–µ–ї–Ї–∞ —Б –≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ, –њ–Њ–і—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ –≤—Л—Б—Л—Е–∞–љ–Є—П.
5. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ –њ–Њ–і –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ.
–†–µ–Ј—Г–ї—М—В–∞—В: –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –љ–∞ —Б–Є—А–µ–љ–µ–≤–Њ–Љ —Д–Њ–љ–µ (—А–∞–Ј–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є) —З–µ—В–Ї–Њ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П —З–µ—А–љ–Њ–≤–∞—В–Њ-—Д–Є–Њ–ї–µ—В–Њ–≤—Л–µ —Д–Є–±—А–Њ–Ј–љ—Л–µ –∞—Б—В—А–Њ—Ж–Є—В—Л, –∞ –≤ —Б–µ—А–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ вАФ –±–Њ–ї–µ–µ —Б–≤–µ—В–ї—Л–µ.
==========================================================
–Ь–µ—В–Њ–і–Є–Ї–∞ –Ь–Є–є–∞–≥–∞–≤—Л –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Р–ї–µ–Ї—Б–∞–љ–і—А–Њ–≤—Б–Ї–Њ–є
(–≤—Л—П–≤–ї–µ–љ–Є–µ –Љ–µ–Ј–µ–љ—Е–Є–Љ–љ–Њ–є –≥–ї–Є–Є)
–Ь–µ—В–Њ–і–Є–Ї—Г –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї –Љ–Є–Ї—А–Њ–≥–ї–Є–Є, –њ–µ—А–Є—Ж–Є—В–Њ–≤ (–≥–µ–Љ–∞—В–Њ–≥–µ–љ–љ—Л—Е –≥–Є—Б—В–Є–Њ—Ж–Є—В–Њ–≤), –∞ —В–∞–Ї–ґ–µ –Ї–ї–µ—В–Њ–Ї –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Є (–њ–ї–Њ—В–љ—Л—Е –Є –і—А–µ–љ–∞–ґ–љ—Л—Е). –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞—О—В –Ј–µ—А–љ–Є—Б—В—Л–µ —И–∞—А—Л –Є –і–µ–ї—М—В–∞-–Ј–µ—А–љ–Є—Б—В–Њ—Б—В—М; –≤ –Љ—П–≥–Ї–Њ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –Њ–Ї—А–∞—И–Є–≤–∞—О—В—Б—П –њ–Є–≥–Љ–µ–љ—В–љ—Л–µ –Ї–ї–µ—В–Ї–Є (—Е—А–Њ–Љ–∞—В–Њ—Д–Њ—А—Л), –Љ–Њ–≥—Г—В –≤—Л—П–≤–ї—П—В—М—Б—П —Д–Є–±—А–Њ–Ј–љ—Л–µ –∞—Б—В—А–Њ—Ж–Є—В—Л.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–µ –љ–µ –Љ–µ–љ–µ–µ 12 –і–љ–µ–є, –Ј–∞—В–µ–Љ –њ—А–Њ–Љ—Л–≤–∞—О—В –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–Њ–є –≤ —В–µ—З–µ–љ–Є–µ 2 —Б—Г—В –Є –Ј–∞–ї–Є–≤–∞—О—В –≤ –ґ–µ–ї–∞—В–Є–љ. –Т—Л—А–µ–Ј–∞–љ–љ—Л–µ –Є–Ј –ґ–µ–ї–∞—В–Є–љ–∞ –Ї—Г—Б–Њ—З–Ї–Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 10 % –Ї–Є—Б–ї—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ –љ–∞ 1 —Б—Г—В (–≤ –љ–µ–Љ –Є—Е –Љ–Њ–ґ–љ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ —Е—А–∞–љ–Є—В—М). –Я–µ—А–µ–і —А–µ–Ј–Ї–Њ–є –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ –ґ–µ–ї–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л—В—М –Ї—Г—Б–Њ—З–Ї–Є –≤ –њ—А–Њ—В–Њ—З–љ–Њ–є –≤–Њ–і–µ –Њ–Ї–Њ–ї–Њ 1 вАФ 2 —З (–Љ–∞—В–µ—А–Є–∞–ї –ї—Г—З—И–µ —А–µ–ґ–µ—В—Б—П).
–Ґ–Њ–ї—Й–Є–љ–∞ —Б—А–µ–Ј–Њ–≤ 15-20 –Љ–Ї–Љ.
–°—А–µ–Ј—Л —Е—А–∞–љ—П—В –≤ 10 % –Ї–Є—Б–ї–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ.
1. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 10 % –Ї–Є—Б–ї—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ –љ–∞ 20 –Љ–Є–љ (–Љ–Њ–ґ–љ–Њ –і–Њ 3 —З).
2. –Я–µ—А–µ–љ–Њ—Б—П—В –±–µ–Ј –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П –≤ —Й–µ–ї–Њ—З–љ–Њ–є —А–∞—Б—В–≤–Њ—А (1 –Ї–∞–њ–ї—П –≥–Є–і—А–Њ–Њ–Ї–Є—Б–Є –љ–∞—В—А–Є—П –љ–∞ 10 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) –љ–∞ 40 вАФ60 —Б.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
4. –Ш–Љ–њ—А–µ–≥–љ–Є—А—Г—О—В –≤ —А–∞—Б—В–≤–Њ—А–µ –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ 1 вАФ2 –Љ–Є–љ.
5. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ –≥–Њ—А—П—З–Є–є 10 % –Ї–Є—Б–ї—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–і–Њ–≥—А–µ–≤–∞—О—В –њ–Њ–і –≤—Л—В—П–ґ–Ї–Њ–є –љ–∞ —Б–њ–Є—А—В–Њ–≤–Ї–µ. –Т —Б–ї—Г—З–∞–µ –њ–Њ–Љ—Г—В–љ–µ–љ–Є—П —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –µ–≥–Њ —Б–ї–µ–і—Г–µ—В –Ј–∞–Љ–µ–љ–Є—В—М. –Т –≥–Њ—А—П—З–µ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ —Б—А–µ–Ј—Л –њ—А–Є–Њ–±—А–µ—В–∞—О—В –Ј–Њ–ї–Њ—В–Є—Б—В—Л–є —Ж–≤–µ—В.
6. –Я–Њ–Љ–µ—Й–∞—О—В –≤ —Е–Њ–ї–Њ–і–љ—Л–є 10 % –Ї–Є—Б–ї—Л–є —Д–Њ—А–Љ–∞–ї–Є–љ (–≤ –љ–µ–Љ –Є—Е –Љ–Њ–ґ–љ–Њ –Њ—Б—В–∞–≤–Є—В—М –і–Њ —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –і–љ—П).
7. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 вАФ 3 —Б–Љ–µ–љ–∞—Е –≤–Њ–і–Њ–њ—А–Њ–≤–Њ–і–љ–Њ–є –≤–Њ–і—Л, –љ–∞–Ї–ї–µ–Є–≤–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ, —Б–Љ–∞–Ј–∞–љ–љ–Њ–µ —Б–Љ–µ—Б—М—О –±–µ–ї–Ї–∞ —Б –≥–ї–Є—Ж–µ—А–Є–љ–Њ–Љ –Є –і–∞—О—В –њ—А–Њ—Б–Њ—Е–љ—Г—В—М –љ–∞ –≤–Њ–Ј–і—Г—Е–µ.
8. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ (–µ—Б–ї–Є –љ–∞ –њ—А–µ–њ–∞—А–∞—В–µ –≤–Є–і–љ—Л –Љ—Г—В–љ—Л–µ –њ—П—В–љ–∞, —В–Њ –µ–≥–Њ –Њ–њ—Г—Б–Ї–∞—О—В –љ–∞ 2 вАФ 3 —Б –≤ –∞—Ж–µ—В–Њ–љ –Є –≤–љ–Њ–≤—М –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –Ї—Б–Є–ї–Њ–ї –і–Њ –њ—А–Њ—Б–≤–µ—В–ї–µ–љ–Є—П), –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ –њ–Њ–і –њ–Њ–Ї—А–Њ–≤–љ–Њ–µ —Б—В–µ–Ї–ї–Њ.
–Т —Б–ї—Г—З–∞–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–Є–Ї—А–Њ–≥–ї–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Є, –ґ–µ–ї–∞—В–Є–љ–Њ–≤—Л–µ —Б—А–µ–Ј—Л —Б–ї–µ–і—Г–µ—В –њ–µ—А–µ–љ–µ—Б—В–Є –Є–Ј —Д–Њ—А–Љ–∞–ї–Є–љ–∞, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Є—Е —Е—А–∞–љ—П—В, –≤ —Б–Љ–µ—Б—М –Ф—Г–±—А–∞–љ—Б–Ї–Њ–≥–Њ (—Б—А–µ–Ј—Л –њ–µ—А–µ–і —Н—В–Є–Љ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 2вАФ3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) –љ–∞ —Б—А–Њ–Ї –Њ—В 2вАФ3 —Б—Г—В –і–Њ 2вАФ3 –љ–µ–і, –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –Љ–µ–љ—П—П —Б–Љ–µ—Б—М —З–µ—А–µ–Ј 2вАФ3 –і–љ—П.
–Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —Б–Љ–µ—Б–Є –Ф—Г–±—А–∞–љ—Б–Ї–Њ–≥–Њ –≤ 100 –Љ–ї –љ–∞–≥—А–µ—В–Њ–є –і–Њ –Ї–Є–њ–µ–љ–Є—П –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ –≤—Б—Л–њ–∞—О—В 6 –≥ –≥–Є–і—А–Њ–Ї–∞—А–±–Њ–љ–∞—В–∞ –љ–∞—В—А–Є—П, –µ—Й–µ —А–∞–Ј –і–Њ–≤–Њ–і—П—В –і–Њ –Ї–Є–њ–µ–љ–Є—П, –Њ—Е–ї–∞–ґ–і–∞—О—В, —Д–Є–ї—М—В—А—Г—О—В. –Т –њ–Њ–ї—Г—З–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –і–Њ–±–∞–≤–ї—П—О—В 6 –Љ–ї –љ–µ—А–∞–Ј–≤–µ–і–µ–љ–љ–Њ–≥–Њ –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –Є 6 –Ї–∞–њ–µ–ї—М 25 % –∞–Љ–Љ–Є–∞–Ї–∞.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–≤–µ—В–ї–Њ-—П–љ—В–∞—А–љ–Њ–Љ —Д–Њ–љ–µ –≤–Є–і–љ—Л –≤–µ—В–≤–Є—Б—В—Л–µ –Ї–ї–µ—В–Ї–Є –Љ–Є–Ї—А–Њ–≥–ї–Є–Є, –њ–µ—А–Є—Ж–Є—В—Л, –њ–ї–Њ—В–љ—Л–µ –Є –і—А–µ–љ–∞–ґ–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Є, –Є–Љ–µ—О—Й–Є–µ —Ж–≤–µ—В –Њ—В —Б–≤–µ—В–ї–Њ-–Ї–Њ—А–Є—З–љ–µ–≤–Њ–≥–Њ –і–Њ —В–µ–Љ–љ–Њ-–Ї–Њ—А–Є—З–љ–µ–≤–Њ–≥–Њ. –Ф—А–µ–љ–∞–ґ–љ—Л–µ –Ї–ї–µ—В–Ї–Є –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ —В–Ї–∞–љ–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —Б–≤–µ—В–ї–Њ-–Ї–Њ—А–Є—З–љ–µ–≤—Л–µ, —З–∞—Б—В–Њ —Б–≤–µ—В–ї–Њ-–ґ–µ–ї—В—Л–µ. –•—А–Њ–Љ–∞—В–Њ—Д–Њ—А—Л –≤ –Љ—П–≥–Ї–Њ–є –Љ–Њ–Ј–≥–Њ–≤–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ, –Є–Ј—А–µ–і–Ї–∞ –≤ —Б–Њ—Б—Г–і–∞—Е –≤–µ—Й–µ—Б—В–≤–∞ –Љ–Њ–Ј–≥–∞ вАФ —З–µ—А–љ–Њ–≥–Њ —Ж–≤–µ—В–∞. –Ш–љ–Њ–≥–і–∞ –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –Ї–Њ—А—Л –Є –њ–Њ–і–Ї–Њ—А–Ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П—Е –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –≤—Л—П–≤–ї—П—О—В –≤–Њ–ї–Њ–Ї–љ–Є—Б—В—Л–µ –∞—Б—В—А–Њ—Ж–Є—В—Л —Б–≤–µ—В–ї–Њ-–Ї–Њ—А–Є—З–љ–µ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞. –°—В–∞—А—З–µ—Б–Ї–Є–µ –±–ї—П—И–Ї–Є –Є–Љ–µ—О—В —Ж–≤–µ—В –Њ—В —Б–≤–µ—В–ї–Њ- –і–Њ —В–µ–Љ–љ–Њ-–Ї–Њ—А–Є—З–љ–µ–≤–Њ–≥–Њ.
==========================================================
–Ь–µ—В–Њ–і –•–Њ—А–љ–µ—Ж–∞ (–≤—Л—П–≤–ї–µ–љ–Є–µ —Д–Є–±—А–Њ–Ј–љ—Л—Е –∞—Б—В—А–Њ—Ж–Є—В–Њ–≤)
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ 10 % –Ї–Є—Б–ї–Њ–Љ —Д–Њ—А–Љ–∞–ї–Є–љ–µ, —Б—А–µ–Ј—Л –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ. –•–Њ—А–Њ—И–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Г–і–∞–µ—В—Б—П –њ–Њ–ї—Г—З–Є—В—М —В–∞–Ї–ґ–µ –љ–∞ –Љ–∞—В–µ—А–Є–∞–ї–µ, –Ј–∞–Ї–ї—О—З–µ–љ–љ–Њ–Љ –≤ –њ–∞—А–∞—Д–Є–љ.
1. –°—А–µ–Ј—Л –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ—Г—О –≤–Њ–і—Г, –љ–∞ 100 –Љ–ї –Ї–Њ—В–Њ—А–Њ–є –і–Њ–±–∞–≤–ї–µ–љ–Њ 15 –Ї–∞–њ–µ–ї—М —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞ (–љ–µ–і–Њ–ї–≥–Њ).
2. –Я–Њ–Љ–µ—Й–∞—О—В –≤ 5 % —А–∞—Б—В–≤–Њ—А –±—А–Њ–Љ–Є—Б—В–Њ-–≤–Њ–і–Њ—А–Њ–і–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –љ–∞ 1 —З –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ 37 ¬∞–°.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 3 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –∞ –Ј–∞—В–µ–Љ –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –Ї –Ї–Њ—В–Њ—А–Њ–є –і–Њ–±–∞–≤–ї–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–∞–њ–µ–ї—М —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л.
4. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ 15вАФ24 —З –≤ —А–∞—Б—В–≤–Њ—А, —Б–Њ—Б—В–Њ—П—Й–Є–є –Є–Ј 1 –≥ —В—А–Є—Е–ї–Њ—А–Є–і–∞ –Ј–Њ–ї–Њ—В–∞ –≤ 75 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л +25 –Љ–ї 2 % —Б—Г–ї–µ–Љ—Л+18 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л + 15 –Ї–∞–њ–µ–ї—М —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –њ—А–µ–њ–∞—А–∞—В—Л –њ—А–Є–Њ–±—А–µ—В–∞—О—В —В–µ–Љ–љ–Њ-–Ї–Њ—А–Є—З–љ–µ–≤—Г—О –Є–ї–Є –Ї—А–∞—Б–љ–Њ-–Ї–Њ—А–Є—З–љ–µ–≤—Г—О –Њ–Ї—А–∞—Б–Ї—Г.
5. –Я–Њ–Љ–µ—Й–∞—О—В –≤ 5 % —А–∞—Б—В–≤–Њ—А —Й–∞–≤–µ–ї–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–і–Њ –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є—П –Є–Љ–Є —Б–µ—А–Њ–є –Њ–Ї—А–∞—Б–Ї–Є).
6. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ, –њ–µ—А–µ–љ–Њ—Б—П—В –≤ 5 % —А–∞—Б—В–≤–Њ—А —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П —Б –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є –Ї–∞–њ–ї—П–Љ–Є —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞; –±—Л—Б—В—А–Њ –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –Є –Ј–∞–Ї–ї—О—З–∞—О—В.
–†–µ–Ј—Г–ї—М—В–∞—В: –љ–∞ —Б–Є—А–µ–љ–µ–≤–Њ–Љ —Д–Њ–љ–µ –≤—Л—П–≤–ї—П—О—В—Б—П —В–µ–Љ–љ–Њ-—Б–Є–љ–Є–µ —Д–Є–±—А–Њ–Ј–љ—Л–µ –∞—Б—В—А–Њ—Ж–Є—В—Л —Б –Њ—В—А–Њ—Б—В–Ї–∞–Љ–Є, –≤–Є–і–љ—Л –Ї–∞–њ–Є–ї–ї—П—А—Л –Є –Ї—А–∞—Б–љ—Л–µ —Н—А–Є—В—А–Њ—Ж–Є—В—Л –≤ –Є—Е –њ—А–Њ—Б–≤–µ—В–µ.
–Т–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П: –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б—В–∞—А–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –±—А–Њ–Љ–Є—Б—В–Њ-–≤–Њ–і–Њ—А–Њ–і–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –њ–µ—А–µ–і–µ—А–ґ–Ї–µ –≤ –љ–µ–є –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–њ–∞–і–∞—О—В –∞—А—В–µ—Д–∞–Ї—В–љ—Л–µ —Б–Є–љ–Є–µ –≥–ї—Л–±–Ї–Є –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л.
==========================================================
==========================================================
–Ъ–Ю–Ь–С–Ш–Э–Ш–†–Ю–Т–Р–Э–Э–Ђ–Х –Ь–Х–Ґ–Ю–Ф–Ђ –Ю–Ъ–†–Р–®–Ш–Т–Р–Э–Ш–ѓ
–£—Б–Ї–Њ—А–µ–љ–љ—Л–є –Љ–µ—В–Њ–і –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Љ–Є–µ–ї–Є–љ–Њ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ–Њ –Т–Є–Ї—В–Њ—А–Њ–≤—Г
–Ф–µ–њ–∞—А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б—А–µ–Ј—Л –Њ–Ї—А–∞—И–Є–≤–∞—О—В –≤ —В–µ—З–µ–љ–Є–µ 1 вАФ2 —З –≤ 0,01 % –Ї–Є—Б–ї–Њ–Љ —Б–њ–Є—А—В–Њ–≤–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –ї—О–Ї—Б–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ –њ—А–Њ—З–љ–Њ–≥–Њ, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ 0,1 % —А–∞—Б—В–≤–Њ—А–µ —В–µ—В—А–∞–±–Њ—А–∞—В–∞ –љ–∞—В—А–Є—П (–±—Г—А—Л) –Є –і–Њ–Ї—А–∞—И–Є–≤–∞—О—В –Ї—А–µ–Ј–Є–ї–Њ–≤—Л–Љ —Д–Є–Њ–ї–µ—В–Њ–≤—Л–Љ –њ—А–Њ—З–љ—Л–Љ –њ–Њ –Э–Є—Б—Б–ї—О.
–†–∞—Б—В–≤–Њ—А—Л –Ї—А–∞—Б–Є—В–µ–ї–µ–є –Є –Є—Е –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ.
–†–∞—Б—В–≤–Њ—А I: 1 –≥ –ї—О–Ї—Б–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ –њ—А–Њ—З–љ–Њ–≥–Њ, 5 –Љ–ї –ї–µ–і—П–љ–Њ–є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –і–Њ 100 –Љ–ї 96 % —Б–њ–Є—А—В–∞. –Ф–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П —А–∞–±–Њ—З–µ–≥–Њ 0,01 % —А–∞—Б—В–≤–Њ—А–∞
1 –Љ–ї –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –Ї—А–∞—Б–Є—В–µ–ї—П —Б–Љ–µ—И–Є–≤–∞—О—В —Б–Њ 100 –Љ–ї 96 % —Б–њ–Є—А—В–∞. –†–∞–±–Њ—З–Є–є —А–∞—Б—В–≤–Њ—А –Ї—А–∞—Б–Є—В–µ–ї—П –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ–Њ–≤—В–Њ—А–љ–Њ.
–†–∞—Б—В–≤–Њ—А II: 250 вАФ 500 –Љ–≥ –Ї—А–µ–Ј–Є–ї–Њ–≤–Њ–≥–Њ —Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –њ—А–Њ—З–љ–Њ–≥–Њ, 130 –Љ–≥ –∞—Ж–µ—В–∞—В–∞ –љ–∞—В—А–Є—П, 1,2 –Љ–ї –ї–µ–і—П–љ–Њ–є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Ч–∞–±—Г—Д–µ—А–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –Ї—А–µ–Ј–Є–ї–Њ–≤–Њ–≥–Њ —Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –њ—А–Њ—З–љ–Њ–≥–Њ –і–ї—П –њ–Њ–і–Ї—А–∞—И–Є–≤–∞–љ–Є—П –њ–Њ –Э–Є—Б—Б–ї—О –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –љ–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ.
–Ь–µ—В–Њ–і–Є–Ї–∞ –Њ–Ї—А–∞—Б–Ї–Є
1. –Э–∞–Ї–ї–µ–µ–љ–љ—Л–µ –љ–∞ —Б—В–µ–Ї–ї–∞ –њ–∞—А–∞—Д–Є–љ–Њ–≤—Л–µ —Б—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 10 вАФ 20 –Љ–Ї–Љ –і–µ–њ–∞—А–∞—Д–Є–љ–Є—А—Г—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ –Є –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 100 % –Є 96 % —Б–њ–Є—А—В–∞—Е.
2. –Ю–Ї—А–∞—И–Є–≤–∞—О—В –≤ 0,01 % —Б–њ–Є—А—В–Њ–≤–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –ї—О–Ї—Б–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ –њ—А–Њ—З–љ–Њ–≥–Њ 1 вАФ 2 —З –њ—А–Є 56 вАФ 60 ¬∞–°.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В —Б—А–µ–Ј—Л –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ –≤ 96 % –Є 70 % —Б–њ–Є—А—В–∞—Е –Є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
4. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ 0,1 % —А–∞—Б—В–≤–Њ—А–µ —В–µ—В—А–∞–±–Њ—А–∞—В–∞ –љ–∞—В—А–Є—П, –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г—П –њ—А–Њ—Ж–µ—Б—Б –њ–Њ–і –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Њ–Љ (–Ї—А–∞—Б–Є—В–µ–ї—М –њ–Њ—Б—В–Њ—П–љ–љ–Њ —Г–і–∞–ї—П–µ—В—Б—П –Є–Ј —Б—А–µ–Ј–∞, –∞ –Љ–Є–µ–ї–Є–љ–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ —Б–Њ—Е—А–∞–љ—П—О—В —П—А–Ї—Г—О —Б–Є–љ–µ-–Ј–µ–ї–µ–љ—Г—О –Њ–Ї—А–∞—Б–Ї—Г).
5. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ 5 % —А–∞—Б—В–≤–Њ—А–µ —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л.
6. –Ю–Ї—А–∞—И–Є–≤–∞—О—В –Ї—А–µ–Ј–Є–ї–Њ–≤—Л–Љ —Д–Є–Њ–ї–µ—В–Њ–≤—Л–Љ –њ—А–Њ—З–љ—Л–Љ –≤ —В–µ—З–µ–љ–Є–µ 2 вАФ 5 –Љ–Є–љ.
7. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
8. –Ю–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В –≤ —Б–њ–Є—А—В–∞—Е –≤–Њ—Б—Е–Њ–і—П—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є (70 %, 96 %, 100 %), –њ—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В: –Љ–Є–µ–ї–Є–љ —П—А–Ї–Њ-—Б–Є–љ–µ–≥–Њ —Ж–≤–µ—В–∞; –≤–µ—Й–µ—Б—В–≤–Њ –Э–Є—Б—Б–ї—П, —П–і—А–∞ –љ–µ–є—А–Њ–љ–Њ–≤, –≥–ї–Є–Њ—Ж–Є—В–Њ–≤, –Ї–ї–µ—В–Њ–Ї —Б–Њ—Б—Г–і–Њ–≤ –Є –Њ–±–Њ–ї–Њ—З–µ–Ї –Љ–Њ–Ј–≥–∞ —Д–Є–Њ–ї–µ—В–Њ–≤—Л–µ.
==========================================================
–Ь–µ—В–Њ–і –Є–Ј–±–Є—А–∞—В–µ–ї—М–љ–Њ–є –Є–Љ–њ—А–µ–≥–љ–∞—Ж–Є–Є –і–µ–≥–µ–љ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є –Њ–Ї–Њ–љ—З–∞–љ–Є–є
–§–Є–Ї—Б–∞—Ж–Є—О –Љ–Њ–Ј–≥–∞ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–Њ–≤–Њ–і—П—В –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Є–ґ–Є–Ј–љ–µ–љ–љ–Њ–є –њ–µ—А—Д—Г–Ј–Є–Є 10 % —А–∞—Б—В–≤–Њ—А–Њ–Љ –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞ –љ–∞ –Є–Ј–Њ—В–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ —Е–ї–Њ—А–Є–і–∞ –љ–∞—В—А–Є—П —З–µ—А–µ–Ј –ї–µ–≤—Л–є –ґ–µ–ї—Г–і–Њ—З–µ–Ї —Б–µ—А–і—Ж–∞. –Я–Њ—Б–ї–µ –њ–µ—А—Д—Г–Ј–Є–Є –Љ–Њ–Ј–≥ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Д–Є–Ї—Б–Є—А—Г—О—В –≤ —В–µ—З–µ–љ–Є–µ 10вАФ14 –і–љ–µ–є –≤ 10 % —А–∞—Б—В–≤–Њ—А–µ –љ–µ–є—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–Њ—А–Љ–∞–ї–Є–љ–∞, –∞ –Ј–∞ 1 вАФ 2 –і–љ—П –њ–µ—А–µ–і —А–µ–Ј–Ї–Њ–є –њ–Њ–Љ–µ—Й–∞—О—В –≤ 30 % —А–∞—Б—В–≤–Њ—А —Б–∞—Е–∞—А–Њ–Ј—Л, —З—В–Њ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ —В–Ї–∞–љ–Є –њ—А–Є –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞–љ–Є–Є. –Т —А–∞—Б—В–≤–Њ—А–µ —Д–Њ—А–Љ–∞–ї–Є–љ-—Б–∞—Е–∞—А–Њ–Ј—Л –Љ–Њ–Ј–≥ –Љ–Њ–ґ–µ—В —Е—А–∞–љ–Є—В—М—Б—П –і–Њ–ї–≥–Њ.
–°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 25 вАФ 40 –Љ–Ї–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ, —Б–Њ–±–Є—А–∞—О—В –≤ 10 % —А–∞—Б—В–≤–Њ—А —Д–Њ—А–Љ–∞–ї–Є–љ–∞, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –Є —Е—А–∞–љ—П—В –і–Њ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Њ–±—А–∞–±–Њ—В–Ї–Є.
–†–∞—Б—В–≤–Њ—А—Л –Є –Є—Е –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є–µ.
–Р. –Ъ–Є—Б–ї—Л–є —А–∞—Б—В–≤–Њ—А —Б–Њ–ї–Є –њ—П—В–Є–≤–∞–ї–µ–љ—В–љ–Њ–≥–Њ –≤–∞–љ–∞–і–Є—П: –љ–∞–≤–µ—Б–Ї—Г –≤ 1,2 –≥ –Љ–µ—В–∞–≤–∞–љ–∞–і–∞—В–∞ –∞–Љ–Љ–Њ–љ–Є—П (–∞–Љ–Љ–Њ–љ–Є–є –≤–∞–љ–∞–і–Є–µ–≤–Њ–Ї–Є—Б–ї—Л–є) —А–∞—Б—В–≤–Њ—А—П—О—В –≤ 150 вАФ 200 –Љ–ї –≥–Њ—А—П—З–µ–є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л, –њ–Њ—Б–ї–µ –Њ—Е–ї–∞–ґ–і–µ–љ–Є—П —А–∞—Б—В–≤–Њ—А–∞ –Ї –љ–µ–Љ—Г –і–Њ–±–∞–≤–ї—П—О—В 5 –Љ–ї –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б–µ—А–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –і–Њ–≤–Њ–і—П—В –µ–≥–Њ –Њ–±—К–µ–Љ –і–Њ 1000 –Љ–ї. –£–і–Њ–±–љ–Њ –≥–Њ—В–Њ–≤–Є—В—М —В–∞–Ї–ґ–µ –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А: 12 –≥ –Љ–µ—В–∞–≤–∞–љ–∞–і–∞—В–∞ –∞–Љ–Љ–Њ–љ–Є—П —А–∞—Б—В–≤–Њ—А—П—О—В –≤ 500 –Љ–ї –≥–Њ—А—П—З–µ–є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Ъ –њ–Њ–ї—Г—З–µ–љ–љ–Њ–Љ—Г —А–∞—Б—В–≤–Њ—А—Г –њ–Њ—Б–ї–µ –Њ—Е–ї–∞–ґ–і–µ–љ–Є—П –љ–µ–±–Њ–ї—М—И–Є–Љ–Є –њ–Њ—А—Ж–Є—П–Љ–Є –і–Њ–±–∞–≤–ї—П—О—В 50 –Љ–ї –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б–µ—А–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –і–Њ–≤–Њ–і—П—В –µ–≥–Њ –Њ–±—К–µ–Љ –і–Њ 1000 –Љ–ї. –Х—Б–ї–Є –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є —Б–µ—А–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤—Л–њ–∞–і–∞–µ—В –±—Г—А—Л–є –Њ—Б–∞–і–Њ–Ї –њ—П—В–Є–Њ–Ї–Є—Б–Є –≤–∞–љ–∞–і–Є—П, —В–Њ –µ–≥–Њ —А–∞—Б—В–≤–Њ—А—П—О—В –њ—А–Є –љ–∞–≥—А–µ–≤–∞–љ–Є–Є. –Я–µ—А–µ–і –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ї 1 —З–∞—Б—В–Є –Ї–Њ–љ—Ж–µ–љ—В—А–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –і–Њ–±–∞–≤–ї—П—О—В 9 —З–∞—Б—В–µ–є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л. –Ъ–Є—Б–ї—Л–є —А–∞—Б—В–≤–Њ—А –Љ–µ—В–∞–≤–∞–љ–∞–і–∞—В–∞ –∞–Љ–Љ–Њ–љ–Є—П –Љ–Њ–ґ–µ—В —Е—А–∞–љ–Є—В—М—Б—П –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є.
–С. –†–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ 3 %.
–Т. –Р–Љ–Љ–Є–∞—З–љ–Њ-–љ–∞—В—А–Є–µ–≤—Л–є —А–∞—Б—В–≤–Њ—А: –≤ 100 –Љ–ї 25 % –≤–Њ–і–љ–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –∞–Љ–Љ–Є–∞–Ї–∞ —А–∞—Б—В–≤–Њ—А—П—О—В 1,25вАФ1,5 –≥ –≥–Є–і—А–Њ–Ї—Б–Є–і–∞ –љ–∞—В—А–Є—П. –†–∞—Б—В–≤–Њ—А —Е—А–∞–љ—П—В –≤ –њ–ї–Њ—В–љ–Њ –Ј–∞–Ї—А—Л—В–Њ–є —Б–Ї–ї—П–љ–Ї–µ —Б –њ–Њ–ї–Є—Н—В–Є–ї–µ–љ–Њ–≤–Њ–є –њ—А–Њ–±–Ї–Њ–є.
–У. –†–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ (–≥–Њ—В–Њ–≤—П—В –њ–µ—А–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ): –Ї 50 –Љ–ї 3 % –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞ –і–Њ–±–∞–≤–ї—П—О—В 6 –Љ–ї –∞–Љ–Љ–Є–∞—З–љ–Њ-–љ–∞—В—А–Є–µ–≤–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞.
–Ф. –†–µ–і—Г—Ж–Є—А—Г—О—Й–Є–є —А–∞—Б—В–≤–Њ—А: 27 –Љ–ї 10 % —Д–Њ—А–Љ–∞–ї–Є–љ–∞, 87 –Љ–ї 1 % –ї–Є–Љ–Њ–љ–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, 90 –Љ–ї 96 % —Б–њ–Є—А—В–∞, –і–Њ 1000 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
–Х. –°–Љ–µ—Б—М —А–∞–≤–љ—Л—Е –Њ–±—К–µ–Љ–Њ–≤ 1 % —А–∞—Б—В–≤–Њ—А–∞ —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П –Є 1 % —А–∞—Б—В–≤–Њ—А–∞ —Б—Г–ї—М—Д–Є—В–∞ –љ–∞—В—А–Є—П.
–Ш–Љ–њ—А–µ–≥–љ–∞—Ж–Є—П —Б—А–µ–Ј–Њ–≤
1. –°—А–µ–Ј—Л –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ —В–µ—З–µ–љ–Є–µ 5 –Љ–Є–љ –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
2. –Я–Њ–Љ–µ—Й–∞—О—В –≤ –Ї–Є—Б–ї—Л–є —А–∞—Б—В–≤–Њ—А –Љ–µ—В–∞–≤–∞–љ–∞–і–∞—В–∞ –∞–Љ–Љ–Њ–љ–Є—П –љ–∞ 10вАФ 15 –Љ–Є–љ.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л 5 –Љ–Є–љ.
4. –Я–µ—А–µ–љ–Њ—Б—П—В –љ–∞ 25 вАФ 30 –Љ–Є–љ –≤ 3 % —А–∞—Б—В–≤–Њ—А –љ–Є—В—А–∞—В–∞ —Б–µ—А–µ–±—А–∞ (—Б—А–µ–Ј—Л –њ—А–Є–Њ–±—А–µ—В–∞—О—В —Б–≤–µ—В–ї–Њ-–Ї–Њ—А–Є—З–љ–µ–≤—Л–є —Ж–≤–µ—В). –Ф–∞–ї–µ–µ –Ї–∞–ґ–і—Л–є —Б—А–µ–Ј –Њ–±—А–∞–±–∞—В—Л–≤–∞—О—В –Њ—В–і–µ–ї—М–љ–Њ.
5. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ (5вАФ 10 —Б–Љ–µ–љ).
6. –Я–Њ–Љ–µ—Й–∞—О—В –љ–∞ 1 вАФ 2 –Љ–Є–љ –≤ —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ —Б–µ—А–µ–±—А–∞.
7. –С–µ–Ј –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј 2 —Б–Љ–µ–љ—Л —А–µ–і—Г—Ж–Є—А—Г—О—Й–µ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ (1-—П —Б–Љ–µ–љ–∞ вАФ 1 –Љ–Є–љ, 2-—П —Б–Љ–µ–љ–∞ вАФ 2 вАФ 3 –Љ–Є–љ).
8. –Я—А–Њ–Љ—Л–≤–∞—О—В 1 вАФ 2 –Љ–Є–љ –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
9. –Я–Њ–Љ–µ—Й–∞—О—В –љ–∞ 1 вАФ 2 –Љ–Є–љ –≤ —Б–Љ–µ—Б—М —А–∞–≤–љ—Л—Е –Њ–±—К–µ–Љ–Њ–≤ 1 % —А–∞—Б—В–≤–Њ—А–Њ–≤ —В–Є–Њ—Б—Г–ї—М—Д–∞—В–∞ –љ–∞—В—А–Є—П –Є —Б—Г–ї—М—Д–Є—В–∞ –љ–∞—В—А–Є—П.
10. –Ґ—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ 2 —Б–Љ–µ–љ–∞—Е –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –≤ —В–µ—З–µ–љ–Є–µ 10вАФ15 –Љ–Є–љ.
11. –Я—А–Њ–Љ—Л—В—Л–µ —Б—А–µ–Ј—Л –љ–∞–Ї–ї–µ–Є–≤–∞—О—В –љ–∞ –њ—А–µ–і–Љ–µ—В–љ—Л–µ —Б—В–µ–Ї–ї–∞ —Б–њ–Є—А—В–Њ–≤—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –ґ–µ–ї–∞—В–Є–љ–∞ –Є —Е—А–Њ–Љ–Њ–≤—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤ (–≤ 200 –Љ–ї 0,5 % —А–∞—Б—В–≤–Њ—А–∞ –ґ–µ–ї–∞—В–Є–љ–∞ —А–∞—Б—В–≤–Њ—А—П—О—В 100 –Љ–≥ —Е—А–Њ–Љ–Њ–≤—Л—Е –Ї–≤–∞—Б—Ж–Њ–≤; —З–Є—Б—В—Л–µ –њ—А–µ–і–Љ–µ—В–љ—Л–µ —Б—В–µ–Ї–ї–∞ –њ–Њ–≥—А—Г–ґ–∞—О—В –≤ —Н—В–Њ—В —А–∞—Б—В–≤–Њ—А, –≤—Л–љ–Є–Љ–∞—О—В –Є —Б—Г—И–∞—В –≤ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–Љ –њ–Њ–ї–Њ–ґ–µ–љ–Є–Є). –Э–∞–Ї–ї–µ–µ–љ–љ—Л–µ –Є —Е–Њ—А–Њ—И–Њ –њ—А–Њ—Б—Г—И–µ–љ–љ—Л–µ —Б—А–µ–Ј—Л –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—В —Б–њ–Є—А—В–Њ–Љ, –њ—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–Я—А–Є–Љ–µ—З–∞–љ–Є—П. 1. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–±—А–∞–±–Њ—В–Ї–Є —Б—А–µ–Ј–Њ–≤, –Њ–њ–Є—Б–∞–љ–љ–Њ–є –≤ –њ—Г–љ–Ї—В–∞—Е 2, 4, 6, –Њ–њ—А–µ–і–µ–ї—П—О—В –Њ–њ—Л—В–љ—Л–Љ –њ—Г—В–µ–Љ –і–ї—П –Ї–∞–ґ–і–Њ–є —Б–µ—А–Є–Є —Б—А–µ–Ј–Њ–≤.
2. –Ъ–∞—З–µ—Б—В–≤–Њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–ї—Г—З—И–∞–µ—В—Б—П, –µ—Б–ї–Є —Б—А–µ–Ј—Л, –љ–∞–Ї–ї–µ–µ–љ–љ—Л–µ –љ–∞ –њ—А–µ–і–Љ–µ—В–љ—Л–µ —Б—В–µ–Ї–ї–∞, –і–Њ–Ї—А–∞—Б–Є—В—М —А–∞—Б—В–≤–Њ—А–∞–Љ–Є –Ї—А–µ–Ј–Є–ї–Њ–≤–Њ–≥–Њ —Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –њ—А–Њ—З–љ–Њ–≥–Њ –Є–ї–Є —В–Њ–ї—Г–Є–і–Є–љ–Њ–≤–Њ–≥–Њ —Б–Є–љ–µ–≥–Њ.
–†–µ–Ј—Г–ї—М—В–∞—В: —Д–Њ–љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б–≤–µ—В–ї–Њ-–ґ–µ–ї—В—Л–є, —А–µ–ґ–µ –Ї–Њ—А–Є—З–љ–µ–≤—Л–є; –і–µ–≥–µ–љ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ вАФ —З–µ—А–љ—Л–µ; –≤ –Љ–µ—Б—В–∞—Е –Њ–Ї–Њ–љ—З–∞–љ–Є—П –і–µ–≥–µ–љ–µ—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –≤—Л—П–≤–ї—П—О—В —В–µ–ї–∞ –љ–µ—А–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —П–і—А–∞ –љ–µ–є—А–Њ–≥–ї–Є–Є, –Є–Љ–µ—О—Й–Є–µ —А–∞–Ј–ї–Є—З–љ—Л–µ –Њ—В—В–µ–љ–Ї–Є —Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ —Ж–≤–µ—В–∞.
==========================================================
–Ь–µ—В–Њ–і–Є–Ї–∞ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л—П–≤–ї–µ–љ–Є—П –љ–µ–є—А–Њ–љ–Њ–≤ –Є –≥–ї–Є–Є –љ–∞ –њ–∞—А–∞—Д–Є–љ–Њ–≤—Л—Е —Б—А–µ–Ј–∞—Е
–У–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Љ–µ—В–Њ–і—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –±–µ–ї–Ї–Њ–≤—Л—Е –≤–µ—Й–µ—Б—В–≤, –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М —В–Є–њ—Л –≥–ї–Є–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–±—Л—З–љ–Њ —Г –≥–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —А–∞–Ј–ї–Є—З–Є–Љ—Л —В–Њ–ї—М–Ї–Њ —Б—В—А—Г–Ї—В—Г¬≠—А—Л —П–і—А–∞. –°—В–∞–≤—П –Ј–∞–і–∞—З—Г —А–∞–Ј—А–∞–±–Њ—В–∞—В—М –Љ–µ—В–Њ–і –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ¬≠–≥–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –љ–µ–є—А–Њ–љ–Њ–≤ –Є –≥–ї–Є–∞–ї—М–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤ –љ–∞ –≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–њ–∞—А–∞—В–∞—Е, –∞–≤—В–Њ—А—Л –њ–Њ–њ—Л—В–∞–ї–Є—Б—М –Њ–±—К–µ–і–Є–љ–Є—В—М –Љ–µ—В–Њ–і –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–є –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–є, –љ–µ–є—А–Њ—Б–Њ–Љ, —В–µ–ї–µ—Ж –Э–Є—Б—Б–ї—П –Є –∞—Б—В—А–Њ—Ж–Є—В–∞—А–љ–Њ–є –≥–ї–Є–Є, –Є –≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–є –Љ–µ—В–Њ–і –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ–±—Й–µ–≥–Њ –±–µ–ї–Ї–∞ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–Љ–Є–і–Њ —З–µ—А–љ–Њ–≥–Њ 10–С. –Ь–µ—В–Њ–і –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ —А–∞–Ј–ї–Є—З–љ–Њ–Љ —Б—А–Њ–і—Б—В–≤–µ –Њ—А–≥–∞–љ–Њ–Є–і–Њ–≤ –Ї–ї–µ—В–Ї–Є –Ї –Ї—А–∞—Б–Є—В–µ–ї—П–Љ: –≤ –љ–µ–є—А–Њ–љ–∞—Е –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–Є –Є –љ–µ–є—А–Њ—Б–Њ–Љ—Л –Њ–Ї—А–∞—И–Є–≤–∞—О—В—Б—П –≤ —П—А–Ї–Њ-–Ї—А–∞—Б–љ—Л–є —Ж–≤–µ—В, –≤–µ—Й–µ—Б—В–≤–Њ –Э–Є—Б—Б–ї—П вАФ –≤ –Ј–µ–ї–µ–љ—Л–є, –∞ —В–µ–ї–∞ –∞–Љ–µ–±–Њ–≤–Є–і–љ—Л—Е –Ї–ї–µ—В–Њ–Ї вАФ –≤ –Ј–µ–ї–µ–љ–Њ–≤–∞—В—Л–є, –≥–ї–Є–∞–ї—М–љ—Л–µ –Є —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ—В–Ї–∞–љ–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ вАФ –≤ –Ї—А–∞—Б–љ—Л–є. –Ь–µ—В–Њ–і —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–Љ–Є–і–Њ —З–µ—А–љ–Њ–≥–Њ 10–С –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–±–љ–∞—А—Г–ґ–Є—В—М –Њ–±—Й–Є–є –Є —Б—Г–Љ–Љ–∞—А–љ—Л–є –±–µ–ї–Њ–Ї –≤ —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ –њ–Њ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—О –µ–≥–Њ —Б–Ї–Њ–њ–ї–µ–љ–Є–є –≤ –Ј–µ–ї–µ–љ—Л–є —Ж–≤–µ—В. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ —Б–ї–µ–і—Г—О—Й–∞—П —Б—Е–µ–Љ–∞.
–Ъ—Г—Б–Њ—З–Ї–Є —В–Ї–∞–љ–Є –Љ–Њ–Ј–≥–∞ –њ–Њ—Б–ї–µ —Д–Є–Ї—Б–∞—Ж–Є–Є –≤ –ґ–Є–і–Ї–Њ—Б—В–Є –Ъ–∞—А–љ—Г–∞ –њ—А–Њ–≤–Њ–і—П—В –њ–Њ –Њ–±–µ–Ј–≤–Њ–ґ–Є–≤–∞—О—Й–Є–Љ —Б—А–µ–і–∞–Љ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –њ–∞—А–∞—Д–Є–љ. –°—А–µ–Ј—Л —В–Њ–ї—Й–Є–љ–Њ–є 5вАФ10 –Љ–Ї–Љ –њ—А–Є–Ї–ї–µ–Є–≤–∞—О—В –±–µ–ї–Ї–Њ–Љ –љ–∞ –њ—А–µ–і–Љ–µ—В–љ—Л–µ —Б—В–µ–Ї–ї–∞.
1. –°—А–µ–Ј—Л –і–µ–њ–∞—А–∞—Д–Є–љ–Є—А—Г—О—В –Є —З–µ—А–µ–Ј —Б–њ–Є—А—В—Л –љ–Є—Б—Е–Њ–і—П—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –і–Њ–≤–Њ–і—П—В –і–Њ –≤–Њ–і—Л.
2. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ 0,03 % —А–∞—Б—В–≤–Њ—А –∞–Љ–Є–і–Њ —З–µ—А–љ–Њ–≥–Њ 10–С –љ–∞ –∞—Ж–µ—В–∞—В–љ–Њ–Љ –±—Г—Д–µ—А–µ (—А–Э 5,32) –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ –љ–∞ 20 –Љ–Є–љ.
3. –Я—А–Њ–Љ—Л–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
4. –Ш–љ–Ї—Г–±–Є—А—Г—О—В –≤ –љ–∞—Б—Л—Й–µ–љ–љ–Њ–Љ –≤–Њ–і–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –Ї–Є—Б–ї–Њ–≥–Њ —Д—Г–Ї—Б–Є–љ–∞ –њ—А–Є 56 ¬∞–° 30 –Љ–Є–љ.
5. –Я–Њ—Б–ї–µ –Њ—Е–ї–∞–ґ–і–µ–љ–Є—П –і–Њ –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –Њ–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ.
6. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ –њ–Є–Ї—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ (15 –Љ–ї –љ–∞—Б—Л—Й–µ–љ–љ–Њ–≥–Њ —Б–њ–Є—А—В–Њ–≤–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А–∞ –њ–Є–Ї—А–Є–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є 30 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л) 15 —Б.
7. –Ю–њ–Њ–ї–∞—Б–Ї–Є–≤–∞—О—В –≤ –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–µ –Є –Њ–±—Б—Г—И–Є–≤–∞—О—В —Д–Є–ї—М—В—А–Њ–≤–∞–ї—М–љ–Њ–є –±—Г–Љ–∞–≥–Њ–є.
8. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ 100 % —Б–њ–Є—А—В–µ –Њ–Ї–Њ–ї–Њ 2,5 —Б.
9. –Я—А–Њ—Б–≤–µ—В–ї—П—О—В –≤ –Ї—Б–Є–ї–Њ–ї–µ –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В: –Њ—В—З–µ—В–ї–Є–≤–Њ –≤—Л—П–≤–ї—П—О—В—Б—П –±–µ–ї–Ї–Є –≤ —В–µ–ї–∞—Е –Є –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є—П—Е –љ–µ–є—А–Њ–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤ —П–і—А–∞—Е –≥–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –Я–Њ—Б–ї–µ–і–љ–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Њ–Ї—А–∞—Б–Ї–Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–Є–љ–∞–і–ї–µ–ґ–љ–Њ—Б—В–Є –Ї —В–Њ–Љ—Г –Є–ї–Є –Є–љ–Њ–Љ—Г —В–Є–њ—Г –≥–ї–Є–Є: –Ї–∞—А–Є–Њ–њ–ї–∞–Ј–Љ–∞ –Є —Е—А–Њ–Љ–∞—В–Є–љ–Њ–≤—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л —П–і–µ—А –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ–≥–ї–Є–Њ—Ж–Є—В–Њ–≤ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ-–Ї—А–∞—Б–љ–Њ–≥–Њ —Ж–≤–µ—В–∞, –∞ —Г –∞—Б—В—А–Њ—Ж–Є—В–Њ–≤ –≤ –Ї—А–∞—Б–љ—Л–є —Ж–≤–µ—В –Њ–Ї—А–∞—И–µ–љ—Л —П–і—А—Л—И–Ї–Њ –Є –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ј–µ—А–µ–љ —Е—А–Њ–Љ–∞—В–Є–љ–∞.
==========================================================
–Ь–µ—В–Њ–і –У–µ—А–ї–∞—Е–∞
–Ф–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –≥—А—Г–±—Л—Е –Њ—В—А–Њ—Б—В–Ї–Њ–≤ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –±–Њ–ї–µ–µ –Ї—А—Г–њ–љ—Л—Е —В—П–ґ–µ–є –≤–Њ–ї–Њ–Ї–Њ–љ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Љ–µ—В–Њ–і –У–µ—А–ї–∞—Е–∞. –Я—А–Є —Н—В–Њ–Љ –≤–∞–ґ–љ–Њ, —З—В–Њ–±—Л –њ—А–µ–њ–∞—А–∞—В—Л –і–Њ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Ї–∞—А–Љ–Є–љ–Њ–Љ –љ–µ —Б–Њ–њ—А–Є–Ї–∞—Б–∞–ї–Є—Б—М —Б–Њ —Б–њ–Є—А—В–Њ–Љ.
–Ь–∞—В–µ—А–Є–∞–ї —Д–Є–Ї—Б–Є—А—Г—О—В –≤ –ґ–Є–і–Ї–Њ—Б—В–Є –Ь—О–ї–ї–µ—А–∞ –Є–ї–Є 3 вАФ 5 % —А–∞—Б—В–≤–Њ—А–µ –±–Є—Е—А–Њ–Љ–∞—В–∞ –Ї–∞–ї–Є—П. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М —Д–Є–Ї—Б–∞—Ж–Є–Є –Љ–Њ–Ј–≥–∞ –њ—В–Є—Ж –Є –ї—П–≥—Г—И–µ–Ї —Б–Њ—Б—В–∞–≤–ї—П–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–і–µ–ї—М, –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Є —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ вАФ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ—Б—П—Ж–µ–≤ –Є –і–∞–ґ–µ –ї–µ—В. –°—А–µ–Ј—Л –њ–Њ–ї—Г—З–∞—О—В –љ–∞ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞—О—Й–µ–Љ –Љ–Є–Ї—А–Њ—В–Њ–Љ–µ –Є –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —З–∞—Б–Њ–≤ –њ—А–Њ–Љ—Л–≤–∞—О—В –≤ –≤–Њ–і–µ. –Ю–Ї—А–∞—И–Є–≤–∞—О—В –≤ —А–∞–Ј–±–∞–≤–ї–µ–љ–љ–Њ–Љ —А–∞—Б—В–≤–Њ—А–µ –∞–Љ–Љ–Є–∞—З–љ–Њ–≥–Њ –Ї–∞—А–Љ–Є–љ–∞ 24 вАФ 48 —З. –Ю—З–µ–љ—М –≤–∞–ґ–љ–Њ –њ—А–∞–≤–Є–ї—М–љ–Њ –њ—А–Є–≥–Њ—В–Њ–≤–Є—В—М —А–∞—Б—В–≤–Њ—А: —А–∞—Б—В–Є—А–∞—О—В 1 –≥ –Ї–∞—А–Љ–Є–љ–∞, –њ—А–Є–ї–Є–≤–∞—О—В 100 –Љ–ї –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л –Є –і–Њ–±–∞–≤–ї—П—О—В –њ–Њ –Ї–∞–њ–ї—П–Љ 26 % —А–∞—Б—В–≤–Њ—А –∞–Љ–Љ–Є–∞–Ї–∞ (–љ–∞—И–∞—В—Л—А–љ—Л–є —Б–њ–Є—А—В) –≤ —В–∞–Ї–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ, —З—В–Њ–±—Л –Ї—А–∞—Б–Є—В–µ–ї—М –њ–Њ–ї–љ–Њ—Б—В—М—О —А–∞—Б—В–≤–Њ—А–Є–ї—Б—П. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —А–∞—Б—В–≤–Њ—А –і–Њ–ї–ґ–µ–љ —Б–Њ–Ј—А–µ—В—М –≤ –Њ—В–Ї—А—Л—В–Њ–Љ —Б–Њ—Б—Г–і–µ –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—П –Ј–∞–њ–∞—Е–∞ –∞–Љ–Љ–Є–∞–Ї–∞. –Ъ —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—О –≥–Њ–і–љ—Л –ї–Є—И—М —А–∞—Б—В–≤–Њ—А—Л, —Б—В–Њ—П–≤—И–Є–µ –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є. –Я–µ—А–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Њ—Б–љ–Њ–≤–љ–Њ–є —А–∞—Б—В–≤–Њ—А —А–∞–Ј–±–∞–≤–ї—П—О—В –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –љ–∞—Б—В–Њ–ї—М–Ї–Њ, —З—В–Њ–±—Л –і–ї—П –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П —Б—А–µ–Ј–Њ–≤ –њ–Њ—В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М 24 вАФ 48 —З. –†–∞—Б—В–≤–Њ—А –Ї–∞—А–Љ–Є–љ–∞ –Љ–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ–Њ–≤—В–Њ—А–љ–Њ (—Б–Њ –≤—А–µ–Љ–µ–љ–µ–Љ –Њ–љ –і–∞–ґ–µ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –ї—Г—З—И–µ). –°—А–µ–Ј—Л –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –≤ —Б–ї–∞–±–Њ –њ–Њ–і–Ї–Є—Б–ї–µ–љ–љ–Њ–є —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В–Њ–є –≤–Њ–і–µ 1 вАФ 2 —З; –њ—А–Њ–Љ—Л–≤–∞—О—В, –њ—А–Њ–≤–Њ–і—П—В —З–µ—А–µ–Ј —Б–њ–Є—А—В—Л –≤–Њ–Ј—А–∞—Б—В–∞—О—Й–µ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є, –Ї—Б–Є–ї–Њ–ї –Є –Ј–∞–Ї–ї—О—З–∞—О—В –≤ –±–∞–ї—М–Ј–∞–Љ.
–†–µ–Ј—Г–ї—М—В–∞—В: –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л–µ –Ї–ї–µ—В–Ї–Є —Б –Њ—В—А–Њ—Б—В–Ї–∞–Љ–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ-–Ї—А–∞—Б–љ—Л–µ; –Њ—Б–µ–≤—Л–µ —Ж–Є–ї–Є–љ–і—А—Л –љ–µ—А–≤–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є —П–і—А–∞ –Ї–ї–µ—В–Њ–Ї –Ї—А–∞—Б–љ—Л–µ; –≤–Њ–ї–Њ–Ї–љ–∞ –≥–ї–Є–Є —А–Њ–Ј–Њ–≤—Л–µ; –Љ—П–Ї–Њ—В–љ—Л–µ –Њ–±–Њ–ї–Њ—З–Ї–Є –Њ—Б—В–∞—О—В—Б—П –љ–µ–Њ–Ї—А–∞—И–µ–љ–љ—Л–Љ–Є. –Х—Б–ї–Є —Б—А–µ–Ј –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ –Њ–Ї—А–∞—Б–Є—В—М –≥–µ–Љ–∞—В–Њ–Ї—Б–Є–ї–Є–љ–Њ–Љ, —В–Њ —П–і—А–∞ –Њ–Ї—А–∞—И–Є–≤–∞—О—В—Б—П –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ –≤ —Б–Є–љ–Є–є —Ж–≤–µ—В.
| 

















