–Ъ–£–Ы–ђ–Ґ–Ш–Т–Ш–†–Ю–Т–Р–Э–Ш–Х –Ъ–Ы–Х–Ґ–Ю–Ъ –Ш –Ґ–Ъ–Р–Э–Х–Щ
–Ъ–ї–µ—В–Њ—З–љ—Л–µ –Ї—Г–ї—М—В—Г—А—Л –љ–∞—Е–Њ–і—П—В –≤—Б–µ –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —А–∞–Ј–љ—Л—Е –Њ–±–ї–∞—Б—В—П—Е –±–Є–Њ–ї–Њ–≥–Є–Є –Є –Љ–µ–і–Є—Ж–Є–љ—Л. –Ш—Е –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –њ—А–Є —А–µ—И–µ–љ–Є–Є —В–∞–Ї–Є—Е –Њ–±—Й–µ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ–±–ї–µ–Љ, –Ї–∞–Ї –≤—Л—П—Б–љ–µ–љ–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Ї–ї–µ—В–Њ–Ї —Б–Њ —Б—А–µ–і–Њ–є, –∞–і–∞–њ—В–∞—Ж–Є–Є, —Б—В–∞—А–µ–љ–Є—П, –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В–Є, –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –Є –і—А. –Т–∞–ґ–љ—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –Ї–ї–µ—В–Њ—З–љ—Л–µ –Ї—Г–ї—М—В—Г—А—Л –≤ –±–Є–Њ—В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –њ—А–Є –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ –≤–∞–Ї—Ж–Є–љ –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –≤–µ—Й–µ—Б—В–≤. –Ъ—Г–ї—М—В—Г—А—Л –Ї–ї–µ—В–Њ–Ї –њ—А–Є–Љ–µ–љ—П—О—В –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –Є –ї–µ—З–µ–љ–Є—П –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –≤ –Ї–∞—З–µ—Б—В–≤–µ —В–µ—Б—В-–Њ–±—К–µ–Ї—В–Њ–≤ –њ—А–Є –Є—Б–њ—Л—В–∞–љ–Є–Є –љ–Њ–≤—Л—Е —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –≤–µ—Й–µ—Б—В–≤.
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤–љ–µ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –±–Њ–ї–µ–Ј–љ–µ–є —П–≤–ї—П–µ—В—Б—П –ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ –Љ–µ—В–Њ–і–∞ –±–Є–Њ–њ—Б–Є–Є, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Є–Ј—К—П—В–Є–є –Є–Ј, –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —Д—А–∞–≥–Љ–µ–љ—В —В–Ї–∞–љ–Є –њ–Њ–і–≤–µ—А–≥–∞—О—В –љ–µ–Љ–µ–і–ї–µ–љ–љ–Њ–Љ—Г (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г) –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О. –Ю–і–љ–∞–Ї–Њ –±–ї–∞–≥–Њ–і–∞—А—П –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—О –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —А–∞—Б—И–Є—А—П—О—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –±–µ—Б–њ—А–µ–і–µ–ї—М–љ–Њ, —В–∞–Ї –Ї–∞–Ї –Є–Љ–µ–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Њ—Ж–µ–љ–Ї–Є –љ–µ —В–Њ–ї—М–Ї–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, –љ–Њ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –њ–Њ–≤–µ–і–µ–љ–Є–Є –Ї–ї–µ—В–Њ–Ї, –Є—Е —А–µ–∞–Ї—Ж–Є–є –љ–∞ —А–∞–Ј–ї–Є—З–љ—Л–µ –∞–≥–µ–љ—В—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П. –Т–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є–µ –Ї—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –≤ —А—П–і—Г –њ–Њ–Ї–Њ–ї–µ–љ–Є–є –Ї–∞–Ї–Њ–≥–Њ-–ї–Є–±–Њ –і–µ—Д–µ–Ї—В–∞ –Є–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П, —Б–≤–Њ–є—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–ї–µ—В–Ї–∞–Љ in vivo, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ–є –њ—А–Є—А–Њ–і–µ —Н—В–Њ–≥–Њ –і–µ—Д–µ–Ї—В–∞ –Є–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Ш–Љ–µ–љ–љ–Њ –±–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤—Г –Ї—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л–µ –Ї–ї–µ—В–Ї–Є —П–≤–ї—П—О—В—Б—П —Ж–µ–љ–љ—Л–Љ –Њ–±—К–µ–Ї—В–Њ–Љ, —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –≥–µ–љ–µ—В–Є–Ї–Є. –Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –≤–Њ–Ј—А–Њ—Б –Є–љ—В–µ—А–µ—Б –Ї —А–∞–±–Њ—В–µ —Б –Ї—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї, –њ–Њ–ї—Г—З–∞–µ–Љ—Л—Е –Љ–µ—В–Њ–і–∞–Љ–Є –≥–Є–±—А–Є–і–Њ–Љ–љ–Њ–є —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є.
–Ю—А–≥–∞–љ–Є–Ј–∞—Ж–Є—П –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Ї—Г–ї—М—В—Г—А—Л —В–Ї–∞–љ–Є
–Ґ–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ —Б—А–µ–і—Б—В–≤–∞, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–µ –і–ї—П –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є –Ї—Г–ї—М—В—Г—А—Л –Ї–ї–µ—В–Њ–Ї –Є —В–Ї–∞–љ–µ–є, –і–Њ–ї–ґ–љ—Л –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Г—О —Б–Є—Б—В–µ–Љ—Г. –Я—А–Є –њ–Њ–і–±–Њ—А–µ –Њ–±–Њ—А—Г–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї–µ–Ј–љ–Њ —Б–Њ—Б—В–∞–≤–ї—П—В—М —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –љ–Њ–Љ–µ–љ–Ї–ї–∞—В—Г—А–љ—Л–µ –њ–µ—А–µ—З–љ–Є. –Я—А–Є —Н—В–Њ–Љ –≤—Б–µ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–µ —Б—А–µ–і—Б—В–≤–∞ –≥—А—Г–њ–њ–Є—А—Г—О—В –њ–Њ –Є—Е –Љ–µ—Б—В—Г –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —А–∞–±–Њ—В —Б –Ї–ї–µ—В–Њ—З–љ—Л–Љ–Є –Ї—Г–ї—М—В—Г—А–∞–Љ–Є:
1) –њ—А–Є–±–Њ—А—Л –Є —Г—Б—В—А–Њ–є—Б—В–≤–∞, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–µ —А–∞–±–Њ—В—Г —Б –Ї–ї–µ—В–Њ—З–љ—Л–Љ–Є –Ї—Г–ї—М—В—Г—А–∞–Љ–Є;
2) –њ—А–Є–±–Њ—А—Л –Є —Г—Б—В—А–Њ–є—Б—В–≤–∞ –і–ї—П –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї;
3) –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ—Л;
4) —Г—Б—В—А–Њ–є—Б—В–≤–∞ –і–ї—П –Ї—А–Є–Њ–Ї–Њ–љ—Б–µ—А–≤–∞—Ж–Є–Є –Є —Е—А–∞–љ–µ–љ–Є—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А.
–Я—А–Є–±–Њ—А—Л
–Ф–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П —Б–≤–µ—А—Е—З–Є—Б—В–Њ–є –Є –Њ–±—Й–µ–ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –≤–Њ–і—Л, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–є –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і, –Љ—Л—В—М—П –њ–Њ—Б—Г–і—Л, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є –і–ї—П –≤—Л—А–∞—Й–Є–≤–∞–љ–Є—П –Ї—Г–ї—М—В—Г—А —В–Ї–∞–љ–µ–є –Є –і—А—Г–≥–Є—Е —Ж–µ–ї–µ–є, –њ—А–Є–Љ–µ–љ—П—О—В —Г—Б—В–∞–љ–Њ–≤–Ї–Є –Ю–Т-1, OB-2, OB-3. –£—Б—В–∞–љ–Њ–≤–Ї–∞ –Ю–Т-1 –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ —Б–Њ–µ–і–Є–љ–µ–љ–љ—Л–µ —Г—Б—В–∞–љ–Њ–≤–Ї–Є –Ю–Т-2 –Є –Ю–Т-3.
–Т –њ—А–∞–Ї—В–Є–Ї–µ —А–∞–±–Њ—В —Б –Ї–ї–µ—В–Њ—З–љ—Л–Љ–Є –Ї—Г–ї—М—В—Г—А–∞–Љ–Є —З–∞—Б—В–Њ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –≤ –Љ–∞—Б—Б–Њ–≤–Њ–Љ –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–Є, –Њ—В–±–Њ—А–µ –њ—А–Њ–± –Є–ї–Є —А–∞–Ј–≤–µ–і–µ–љ–Є–Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –ґ–Є–і–Ї–Њ—Б—В–µ–є. –Т–µ–ї–Є—З–Є–љ–∞ –µ–і–Є–љ–Є—З–љ–Њ–є –і–Њ–Ј—Л –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В 1 –Љ–Ї–ї –і–Њ 10 –Љ–ї. –Ц–µ—Б—В–Ї–Є–µ —В—А–µ–±–Њ–≤–∞–љ–Є—П –њ—А–µ–і—К—П–≤–ї—П—О—В —В–∞–Ї–ґ–µ –Ї —В–Њ—З–љ–Њ—Б—В–Є –Є –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ–Њ—Б—В–Є —А–∞–Ј–Њ–≤–Њ–є –і–Њ–Ј—Л. –Ч–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ–±–ї–µ–≥—З–∞–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Н—В–Њ–є —В–µ—Е–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Є–ї–Є –њ–Њ–ї—Г–∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Г—Б—В—А–Њ–є—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ –≤ —А–∞–Ј–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–∞—Е –љ–∞–Ј—Л–≤–∞—О—В –і–Њ–Ј–∞—В–Њ—А–∞–Љ–Є-–і–Є–ї—О—В–Њ—А–∞–Љ–Є, –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ–Є–њ–µ—В–Ї–∞–Љ–Є –Є —В.–њ. –°–Љ–µ–љ–љ—Л–µ –љ–∞–Ї–Њ–љ–µ—З–љ–Є–Ї–Є –Љ–Њ–ґ–љ–Њ –њ–Њ–і–≤–µ—А–≥–љ—Г—В—М –њ–∞—А–Њ–≤–Њ–є —Б—В–µ—А–Є–ї–Є–Ј–∞—Ж–Є–Є –Є –њ–Њ–≤—В–Њ—А–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М.
–Ч–∞ —А—Г–±–µ–ґ–Њ–Љ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П—О—В —Г—Б—В—А–Њ–є—Б—В–≤–∞, –Њ—В–љ–Њ—Б—П—Й–Є–µ—Б—П –Ї –Љ–∞–ї–Њ–є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є —В–µ—Е–љ–Є–Ї–µ, –љ–µ —П–≤–ї—П—О—Й–Є–µ—Б—П –њ–Њ —Б–≤–Њ–µ–є —Б—Г—В–Є –і–Њ–Ј–∞—В–Њ—А–∞–Љ–Є, –љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Њ–±–ї–µ–≥—З–∞—О—Й–Є–µ —Н—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б –Є –і–µ–ї–∞—О—Й–Є–µ –µ–≥–Њ –±–Њ–ї–µ–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –і–ї—П –Њ–њ–µ—А–∞—В–Њ—А–∞. –†–µ—З—М –Є–і—С—В –Њ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е –њ—А–Є–±–Њ—А–∞—Е ¬ЂPiped-Aid¬ї; –Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ—Л –і–ї—П –Њ—В–±–Њ—А–∞ –њ—А–Њ–± –Є –≤—Л–і–∞—З–Є –і–Њ–Ј—Л –њ—А–Є —А–∞–±–Њ—В–µ —Б –њ–∞—Б—В–µ—А–Њ–≤—Б–Ї–Є–Љ–Є –њ–Є–њ–µ—В–Ї–∞–Љ–Є –Є –ї—О–±—Л–Љ–Є –≥—А–∞–і—Г–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ–Є–њ–µ—В–Ї–∞–Љ–Є –µ–Љ–Ї–Њ—Б—В—М—О –і–Њ 75 –Љ–ї. –Я–Є–њ–µ—В–Ї—Г –≤—Б—В–∞–≤–ї—П—О—В –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–є –і–µ—А–ґ–∞—В–µ–ї—М, —Б–Њ–µ–і–Є–љ–µ–љ–љ—Л–є —Б –Љ–∞–ї–Њ–≥–∞–±–∞—А–Є—В–љ—Л–Љ –≤–∞–Ї—Г—Г–Љ–љ—Л–Љ –љ–∞—Б–Њ—Б–Њ–Љ. –Ю—В–±–Њ—А –њ—А–Њ–± –Є –і–Њ–Ј–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і—П—В –њ—Г—В–µ–Љ —Б–Њ–Ј–і–∞–љ–Є—П –≤–∞–Ї—Г—Г–Љ–∞ –Є–ї–Є –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ –њ–Є–њ–µ—В–Ї–µ. –Ю–њ–µ—А–∞—В–Њ—А —Г–њ—А–∞–≤–ї—П–µ—В —А–∞–±–Њ—В–Њ–є –њ—А–Є–±–Њ—А–∞ —Б –њ–Њ–Љ–Њ—Й—М—О –Ї–љ–Њ–њ–Њ–Ї, —А–∞–Ј–Љ–µ—Й–µ–љ–љ—Л—Е –љ–∞ –і–µ—А–ґ–∞—В–µ–ї–µ. –°–Ї–Њ—А–Њ—Б—В—М –љ–∞–±–Њ—А–∞ –Є –≤—Л–і–∞—З–Є –і–Њ–Ј—Л —А–µ–≥—Г–ї–Є—А—Г—О—В —Б –њ–Њ–Љ–Њ—Й—М—О —Г—Б—В–∞–љ–Њ–≤–Ї–Є –њ—А–Њ–Є–Ј–≤–Њ–і–Є—В–µ–ї—М–љ–Њ—Б—В–Є –љ–∞coca –Є–ї–Є —Б–Є–ї–Њ–є –љ–∞–ґ–∞—В–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Ї–љ–Њ–њ–Њ–Ї —Г–њ—А–∞–≤–ї–µ–љ–Є—П. –Т –і–∞–љ–љ—Л—Е –њ—А–Є–±–Њ—А–∞—Е –њ—А–µ–і—Г—Б–Љ–Њ—В—А–µ–љ–∞ –Ј–∞—Й–Є—В–∞ –Њ—В –њ–Њ–њ–∞–і–∞–љ–Є—П –і–Њ–Ј–Є—А—Г–µ–Љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –≤ –њ—А–Є–±–Њ—А, –∞ —В–∞–Ї–ґ–µ –Є–Љ–µ—О—В—Б—П –≤–Њ–Ј–і—Г—И–љ—Л–µ —Д–Є–ї—М—В—А—Л, –Є—Б–Ї–ї—О—З–∞—О—Й–Є–µ –Ј–∞–≥—А—П–Ј–љ–µ–љ–Є–µ –і–Њ–Ј–Є—А—Г–µ–Љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –њ—А–Є –≤—Л–і–∞—З–µ –і–Њ–Ј—Л.
–£—Б—В—А–Њ–є—Б—В–≤–∞ –і–ї—П –њ—А–Є–≥–Њ—В–Њ–≤–ї–µ–љ–Є—П –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і
–Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е —В—А–µ–±–Њ–≤–∞–љ–Є–є –Ї –ґ–Є–і–Ї–Є–Љ –њ–Є—В–∞—В–µ–ї—М–љ—Л–Љ —Б—А–µ–і–∞–Љ –і–ї—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А —П–≤–ї—П–µ—В—Б—П –Є—Е —Б—В–µ—А–Є–ї—М–љ–Њ—Б—В—М, –і–Њ—Б—В–Є–≥–∞–µ–Љ–∞—П, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Б –њ–Њ–Љ–Њ—Й—М—О —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є —Б—В–µ—А–Є–ї–Є–Ј—Г—О—Й–µ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є, –Њ—Б–≤–Њ–±–Њ–ґ–і–∞—О—Й–µ–є –њ–Є—В–∞—В–µ–ї—М–љ—Л–µ —Б—А–µ–і—Л –Њ—В –њ—А–Є–Љ–µ—Б–µ–є, –±–∞–Ї—В–µ—А–Є–є –Є –Ї–Њ–ї–ї–Њ–Є–і–Њ–≤. –†–∞–Ј–ї–Є—З–∞—О—В –Љ–Є–Ї—А–Њ- –Є —Г–ї—М—В—А–∞—Д–Є–ї—М—В—А–∞—Ж–Є—О —Б—А–µ–і. –Я—А–Є –Љ–Є–Ї—А–Њ—Д–Є–ї—М—В—А–∞—Ж–Є–Є –Є–Ј –ґ–Є–і–Ї–Њ—Б—В–Є —Г–і–∞–ї—П—О—В —З–∞—Б—В–Є—Ж—Л –њ—А–Є–Љ–µ—Б–µ–є –Є –±–∞–Ї—В–µ—А–Є–Є —А–∞–Ј–Љ–µ—А–Њ–Љ –Њ—В 0,25 –і–Њ 10 –Љ–Ї–Љ. –£–ї—М—В—А–∞—Д–Є–ї—М—В—А–∞—Ж–Є—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–≤–ї–µ—З—М –Є–Ј —А–∞—Б—В–≤–Њ—А–∞ –Њ—З–µ–љ—М –Љ–µ–ї–Ї–Є–µ —З–∞—Б—В–Є—Ж—Л –Є. –Ї–Њ–ї–ї–Њ–Є–і—Л, –∞ —В–∞–Ї–ґ–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л —А–∞—Б—В–≤–Њ—А–µ–љ–љ—Л—Е –≤–µ—Й–µ—Б—В–≤ —Б –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –Љ–∞—Б—Б–Њ–є –Њ—В 1000 –і–Њ 1.000.000.
–Ь–µ–Љ–±—А–∞–љ–љ—Л–µ —Д–Є–ї—М—В—А—Л, –њ—А–Є–≥–Њ–і–љ—Л–µ –і–ї—П –Њ—З–Є—Б—В–Ї–Є –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і, –њ—А–Њ–Є–Ј–≤–Њ–і—П—В —А—П–і —Д–Є—А–Љ. –Э–∞–Є–±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –њ—А–∞–Ї—В–Є–Ї–µ –љ–∞—И–ї–Є –Љ–Є–ї–ї–Є–њ–Њ—А–Њ–≤—Л–µ —Д–Є–ї—М—В—А—Л. –†–∞–Ј–Љ–µ—А—Л –Љ–µ–Љ–±—А–∞–љ–љ—Л—Е —Д–Є–ї—М—В—А–Њ–≤ (13, 25, 47, 90, 142 –Є 293 –Љ–Љ) —Б—В–∞–ї–Є –≤ –Ї–∞–Ї–Њ–є-—В–Њ –Љ–µ—А–µ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ–Є. –Ф–ї—П —Д–Є–ї—М—В—А–∞—Ж–Є–Є —Б—А–µ–і–љ–Є—Е –њ–Њ –Њ–±—К–µ–Љ—Г –Ї–Њ–ї–Є—З–µ—Б—В–≤ –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і (25-50 –ї) –љ–∞–Є–±–Њ–ї–µ–µ —Г–і–Њ–±–љ—Л —Г—Б—В–∞–љ–Њ–≤–Ї–Є —Б –Љ–µ–Љ–±—А–∞–љ–љ—Л–Љ–Є —Д–Є–ї—М—В—А–∞–Љ–Є –і–Є–∞–Љ–µ—В—А–Њ–Љ 90 –Є 142 –Љ–Љ. –Т –Њ–±—Й–µ–Љ —Б–ї—Г—З–∞–µ —Г—Б—В–∞–љ–Њ–≤–Ї–∞ –і–ї—П —Б—В–µ—А–Є–ї–Є–Ј—Г—О—Й–µ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є —Б–Њ—Б—В–Њ–Є—В –Є–Ј —Б–Є—Б—В–µ–Љ—Л, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є –і–ї—П —Б–Њ–Ј–і–∞–љ–Є—П –Ш–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –љ–∞ —Д–Є–ї—М—В—А—Г–µ–Љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М, —Б—В–µ—А–Є–ї–Є–Ј—Г–µ–Љ–Њ–≥–Њ –і–µ—А–ґ–∞—В–µ–ї—П —Д–Є–ї—М—В—А–∞, —Д–Є–ї—М—В—А—Г—О—Й–µ–є –Љ–µ–Љ–±—А–∞–љ—Л, —В—А—Г–±–Њ–њ—А–Њ–≤–Њ–і–Њ–≤ –Є —Б–Њ—Б—Г–і–Њ–≤ –і–ї—П —А–∞–Ј–Љ–µ—Й–µ–љ–Є—П —Д–Є–ї—М—В—А—Г–µ–Љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є –Є —Д–Є–ї—М—В—А–∞—В–∞.
–Я—А–Є –њ–Њ–і–±–Њ—А–µ –Є —А–∞—Б—З–µ—В–µ —Д–Є–ї—М—В—А—Г—О—Й–µ–є —Б–Є—Б—В–µ–Љ—Л —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –Ј–∞–і–∞—З—Г (–≤–Є–і —Б—А–µ–і—Л, –њ–Њ–і–ї–µ–ґ–∞—Й–µ–є —Д–Є–ї—М—В—А–∞—Ж–Є–Є, –µ–µ —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞, –≤—П–Ј–Ї–Њ—Б—В—М, —Е–Є–Љ–Є—З–µ—Б–Ї–Є–є —Б–Њ—Б—В–∞–≤, —А–∞–Ј–Љ–µ—А —З–∞—Б—В–Є—Ж, –њ–Њ–і–ї–µ–ґ–∞—Й–Є—Е —Д–Є–ї—М—В—А–∞—Ж–Є–Є, —А–µ–ґ–Є–Љ —Д–Є–ї—М—В—А–∞—Ж–Є–Є - –љ–µ–њ—А–µ—А—Л–≤–љ—Л–є –Є–ї–Є –њ–Њ—А—Ж–Є–Њ–љ–љ—Л–є –Є —В.–њ.) –Є –њ–Њ–і–Њ–±—А–∞—В—М —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ –Љ–µ–Љ–±—А–∞–љ—Г –Є –і–µ—А–ґ–∞—В–µ–ї—М, –∞ —В–∞–Ї–ґ–µ –Њ–њ—А–µ–і–µ–ї–Є—В—М –≤–µ–ї–Є—З–Є–љ—Г –Є–Ј–±—Л—В–Њ—З–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ –і–ї—П —Д–Є–ї—М—В—А–∞—Ж–Є–Є.
–Я—А–Є–±–Њ—А—Л –Є —Г—Б—В—А–Њ–є—Б—В–≤–∞ –і–ї—П –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї
–°—В–µ—А–Є–ї—М–љ–Њ—Б—В—М –њ—А–Є —А–∞–±–Њ—В–µ —Б –Ї—Г–ї—М—В—Г—А–∞–Љ–Є –Ї–ї–µ—В–Њ–Ї –Њ–±—Л—З–љ–Њ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—Г—В–µ–Љ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–Љ –±–Њ–Ї—Б–Њ–≤–Њ–Љ –њ–Њ–Љ–µ—Й–µ–љ–Є–Є. –Ф–ї—П —Б–Њ–Ј–і–∞–љ–Є—П –±–Њ–Ї—Б–Њ–≤—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Ј–∞—В—А–∞—В—Л. –Р–ї—М—В–µ—А–љ–∞—В–Є–≤–Њ–є –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ —П–≤–ї—П–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е –ї–∞–Љ–Є–љ–∞—А-–±–Њ–Ї—Б–Њ–≤, –Є–ї–Є —Б—В–µ—А–Є–ї—М–љ—Л—Е —А–∞–±–Њ—З–Є—Е –Љ–µ—Б—В: –≤ –ї—О–±–Њ–Љ –њ–Њ–Љ–µ—Й–µ–љ–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–Њ–Ј–і–∞–љ –ї–Њ–Ї–∞–ї—М–љ—Л–є —Б—В–µ—А–Є–ї—М–љ—Л–є –Њ–±—К—С–Љ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П —А–∞–±–Њ—В—Л –Є —Б–Њ–Ј–і–∞—О—Й–Є–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Ј–∞—Й–Є—В—Г –њ–Њ–ї—М–Ј–Њ–≤–∞—В–µ–ї–µ–є. –Ґ–µ—Е–љ–Є—З–µ—Б–Ї–Є –Ј–∞–і–∞—З—Г —А–µ—И–∞—О—В –њ—Г—В—С–Љ –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ, –Њ–±–і—Г–≤–∞ –Љ–µ—Б—В–∞ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —А–∞–±–Њ—В (–љ–∞–њ—А–Є–Љ–µ—А, —Б—В–Њ–ї–∞) –ї–∞–Љ–Є–љ–∞—А–љ—Л–Љ –њ–Њ—В–Њ–Ї–Њ–Љ –≤–Њ–Ј–і—Г—Е–∞, –≤ 1 –і–Љ3 –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –љ–µ –±–Њ–ї–µ–µ 4 —З–∞—Б—В–Є—Ж –Ј–∞–≥—А—П–Ј–љ–Є—В–µ–ї–µ–є –≤–µ–ї–Є—З–Є–љ–Њ–є 0,3 вАФ 0,5 –Љ–Ї–Љ. –Ш–Ј–±—Л—В–Њ—З–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –≤–Њ–Ј–і—Г—Е–∞ 5 —А–∞–±–Њ—З–µ–Љ –Њ–±—К–µ–Љ–µ –Є —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Ї–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ—Л–µ –Љ–µ—А—Л –Є—Б–Ї–ї—О—З–∞—О—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–њ–∞–і–∞–љ–Є—П –≤–Њ–Ј–і—Г—Е–∞ –Є–Ј –њ–Њ–Љ–µ—Й–µ–љ–Є—П –≤ —В–Њ –Љ–µ—Б—В–Њ, –≥–і–µ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Љ–∞—В–µ—А–Є–∞–ї. –Ы–∞–Љ–Є–љ–∞—А-–±–Њ–Ї—Б —Б –≥–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М–љ—Л–Љ –њ–Њ—В–Њ–Ї–Њ–Љ –Њ–±–µ—Б–њ—Л–ї–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–і—Г—Е–∞ —В–Є–њ–∞ –£–Ю-–С–У, (—Г—Б—В–∞–љ–Њ–≤–Ї–∞ –Њ–±–µ—Б–њ—Л–ї–Є–≤–∞–љ–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Б –≥–Њ—А–Є–Ј–Њ–љ—В–∞–ї—М–љ—Л–Љ –њ–Њ—В–Њ–Ї–Њ–Љ) –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –Њ—З–Є—Б—В–Ї—Г –≤–Њ–Ј–і—Г—Е–∞, –њ–Њ–і–∞–≤–∞–µ–Љ–Њ–≥–Њ –≤ —А–∞–±–Њ—З—Г—О –Ј–Њ–љ—Г, –і–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П. –Ю—З–Є—Б—В–Ї—Г –њ—А–Њ–Є–Ј–≤–Њ–і—П—В —Б –њ–Њ–Љ–Њ—Й—М—О —Д–Є–ї—М—В—А–Њ–≤ –≥—А—Г–±–Њ–є –Є —В–Њ–љ–Ї–Њ–є –Њ—З–Є—Б—В–Ї–Є, –≤—Б—В—А–Њ–µ–љ–љ—Л—Е –≤ –њ—А–Є–±–Њ—А.
–Ы–∞–Љ–Є–љ–∞—А-–±–Њ–Ї—Б —В–Є–њ–∞ –С–Я-4-004 (¬Ђ–С–Њ–Ї—Б-–†¬ї), –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–є –і–ї—П —А–∞–±–Њ—В —Б –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –њ–∞—В–Њ–≥–µ–љ–љ—Л–Љ–Є –Ї—Г–ї—М—В—Г—А–∞–Љ–Є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–і–∞—З—Г –≤ —А–∞–±–Њ—З—Г—О –Ј–Њ–љ—Г –ї–∞–Љ–Є–љ–∞—А–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞ –≤–Њ–Ј–і—Г—Е–∞, –≤ 1 –і–Љ3 –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є—В—Б—П –љ–µ –±–Њ–ї–µ–µ 3 вАФ 4 —З–∞—Б—В–Є—Ж —А–∞–Ј–Љ–µ—А–Њ–Љ –±–Њ–ї–µ–µ 0,3 –Љ–Ї–Љ. –Т –њ—А–Є–±–Њ—А–µ –њ—А–µ–і—Г—Б–Љ–Њ—В—А–µ–љ–∞ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–∞—П —А–µ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—П –≤–Њ–Ј–і—Г—И–љ–Њ–≥–Њ –њ–Њ—В–Њ–Ї–∞, –Ј–∞–Ї–ї—О—З–∞—О—Й–∞—П—Б—П –≤ —В–Њ–Љ, —З—В–Њ –≤–Њ–Ј–і—Г—Е –Є–Ј —А–∞–±–Њ—З–µ–≥–Њ –Њ–±—К–µ–Љ–∞ –њ–Њ–њ–∞–і–∞–µ—В –љ–∞ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–є —Д–Є–ї—М—В—А —В–Њ–љ–Ї–Њ–є –Њ—З–Є—Б—В–Ї–Є, –Њ—В–Ї—Г–і–∞ —З–∞—Б—В—М –µ–≥–Њ –≤—Л—Е–Њ–і–Є—В –≤ –Њ–Ї—А—Г–ґ–∞—О—Й–µ–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–Њ, –∞ –Њ—Б—В–∞–ї—М–љ–Њ–є –њ–Њ—В–Њ–Ї –њ–Њ–≤—В–Њ—А–љ–Њ –њ—А–Њ—Е–Њ–і–Є—В —З–µ—А–µ–Ј —Д–Є–ї—М—В—А —В–Њ–љ–Ї–Њ–є –Њ—З–Є—Б—В–Ї–Є –Є –≤–љ–Њ–≤—М –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ —А–∞–±–Њ—З–Є–є –Њ–±—К–µ–Љ. –С–ї–∞–≥–Њ–і–∞—А—П —Н—В–Њ–Љ—Г –Є—Б–Ї–ї—О—З–∞–µ—В—Б—П –≤—Л–љ–Њ—Б –Њ–±—А–∞–±–∞—В—Л–≤–∞–µ–Љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –≤ –њ–Њ–Љ–µ—Й–µ–љ–Є–µ. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–њ–∞–і–∞–љ–Є—П –≤—Л—Е–Њ–і—П—Й–µ–≥–Њ –≤–Њ–Ј–і—Г—Е–∞ –љ–∞ –Њ–њ–µ—А–∞—В–Њ—А–∞ –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—О—В –њ—Г—В–µ–Љ —Б–Њ–Ј–і–∞–љ–Є—П –Ј–Њ–љ—Л –њ–Њ–і—Б–Њ—Б–∞ –љ–∞ –Њ—В–Ї—А—Л—В–Њ–є —Б—В–Њ—А–Њ–љ–µ —А–∞–±–Њ—З–µ–≥–Њ –Њ–±—К–µ–Љ–∞ –±–Њ–Ї—Б–∞. –Я–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л–µ –ї–∞–Љ–Є–љ–∞—А-–±–Њ–Ї—Б—Л –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ—Л –і–ї—П —А–∞–Ј–Љ–µ—Й–µ–љ–Є—П –≤ –ї—О–±—Л—Е –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ–Љ–µ—Й–µ–љ–Є—П—Е, –Є–Љ–µ—О—Й–Є—Е –њ—А–Є—В–Њ—З–љ—Г—О –≤–µ–љ—В–Є–ї—П—Ж–Є—О —Б –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–є –≥—А—Г–±–Њ–є –Њ—З–Є—Б—В–Ї–Њ–є –≤–Њ–Ј–і—Г—Е–∞.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ —В–µ—А–Љ–Њ—Б—В–∞—В—Л –і–ї—П –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї –і–Њ–ї–ґ–љ—Л –Њ—В–≤–µ—З–∞—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ: –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—В—М –≤—Л—Б–Њ–Ї—Г—О —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –Ј–∞–і–∞–љ–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, —Б–Њ–Ј–і–∞–≤–∞—В—М –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–є –≥—А–∞–і–Є–µ–љ—В —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–Њ –њ–Њ–ї–µ–Ј–љ–Њ–Љ—Г –Њ–±—К–µ–Љ—Г, –Є–Љ–µ—В—М —Б–Є—Б—В–µ–Љ—Г –±—Л—Б—В—А–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л –њ–Њ—Б–ї–µ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Њ—Е–ї–∞–ґ–і–µ–љ–Є—П. –Т–љ—Г—В—А–µ–љ–љ—П—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —В–µ—А–Љ–Њ—Б—В–∞—В–Њ–≤ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –Є–Ј–≥–Њ—В–Њ–≤–ї–µ–љ–∞ –Є–Ј –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –њ–∞—Б—Б–Є–≤–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–Њ–≤, —В.–µ. –љ–µ –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –ґ–Є–Ј–љ–µ–і–µ—П—В–µ–ї—М–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ–Ї –Є —Б—В–Њ–є–Ї–Є—Е –Ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і. –Ь–∞—В–µ—А–Є–∞–ї—Л, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –Є–Ј–≥–Њ—В–∞–≤–ї–Є–≤–∞—О—В –≤–љ—Г—В—А–µ–љ–љ–Є–µ –Є –љ–∞—А—Г–ґ–љ—Л–µ —З–∞—Б—В–Є —В–µ—А–Љ–Њ—Б—В–∞—В–∞, –Є –њ–Њ–Ї—А—Л—В–Є—П –і–Њ–ї–ґ–љ—Л –≤—Л–і–µ—А–ґ–Є–≤–∞—В—М –і–µ–Ї–Њ–љ—В–∞–Љ–Є–∞—Ж–Є—О –≤–Њ–і–љ—Л–Љ–Є —А–∞—Б—В–≤–Њ—А–∞–Љ–Є —Б–њ–Є—А—В–∞-—А–µ–Ї—В–Є—Д–Є–Ї–∞—В–∞ –Є —Б—В–µ—А–Є–ї–Є–Ј–∞—Ж–Є—О –£–§-–Є–Ј–ї—Г—З–µ–љ–Є–µ–Љ.
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Љ–Њ–і–µ–ї–Є —Н—В–Є—Е –њ—А–Є–±–Њ—А–Њ–≤ –Є–Љ–µ—О—В –њ–Њ–ї–µ–Ј–љ—Л–є –Њ–±—К–µ–Љ –Њ—В 20 –і–Њ 1400 –ї. –Я–Њ–ї–µ–Ј–љ—Л–є –Њ–±—К–µ–Љ –Њ–±—А–∞–Ј—Г–µ—В—Б—П –њ–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –њ–ї–∞—Б—В–Є–љ–∞–Љ–Є –Є–Ј –љ–µ—А–ґ–∞–≤–µ—О—Й–µ–є —Б—В–∞–ї–Є –Є–ї–Є –Љ–µ–і–Є (—Г –і–Њ—А–Њ–≥–Є—Е –Љ–Њ–і–µ–ї–µ–є). –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —В–µ—А–Љ–Њ—Б—В–∞—В—Л –Є–Љ–µ—О—В –љ–∞—А—Г–ґ–љ—Г—О –Є –≤–љ—Г—В—А–µ–љ–љ—О—О –і–≤–µ—А–Є. –Я–Њ—Б–ї–µ–і–љ—О—О –Є–Ј–≥–Њ—В–∞–≤–ї–Є–≤–∞—О—В –Є–Ј –њ—А–Њ–Ј—А–∞—З–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–±–ї—О–і–∞—В—М –Ј–∞ —Б–Њ–і–µ—А–ґ–Є–Љ—Л–Љ —В–µ—А–Љ–Њ—Б—В–∞—В–∞ –±–µ–Ј –љ–∞—А—Г—И–µ–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞: –Ь–љ–Њ–≥–Є–µ –Љ–Њ–і–µ–ї–Є –њ–Њ–і–Њ–±–љ—Л—Е –њ—А–Є–±–Њ—А–Њ–≤ –Є–Љ–µ—О—В —Б–µ–Ї—Ж–Є–Њ–љ–љ—Г—О –≤–љ—Г—В—А–µ–љ–љ—О—О –і–≤–µ—А—М, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й—Г—О –і–Њ—Б—В—Г–њ –≤ —В–µ—А–Љ–Њ—Б—В–∞—В —Б –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —В–µ–њ–ї–Њ–≤–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –≤ –њ–Њ–ї–µ–Ј–љ–Њ–Љ –Њ–±—К–µ–Љ–µ. –Ґ–µ–Љ–њ–µ—А–∞—В—Г—А—Г –≤ —А–∞–±–Њ—З–µ–є –Ї–∞–Љ–µ—А–µ —В–µ—А–Љ–Њ—Б—В–∞—В–Њ–≤ –Њ–±—Л—З–љ–Њ –Љ–Њ–ґ–љ–Њ –Ј–∞–і–∞–≤–∞—В—М –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В –њ—А–µ–≤—Л—И–∞—О—Й–µ–є –Ї–Њ–Љ–љ–∞—В–љ—Г—О –љ–∞ 5 ¬∞–° –і–Њ 80 ¬∞–°. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–і–µ–ї—П—Е —В–µ—А–Љ–Њ—Б—В–∞—В–Њ–≤ –Є–Љ–µ–µ—В—Б—П –≤—Б—В—А–Њ–µ–љ–љ–∞—П —Е–Њ–ї–Њ–і–Є–ї—М–љ–∞—П —Г—Б—В–∞–љ–Њ–≤–Ї–∞, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–∞—П –Ј–∞–і–∞–≤–∞—В—М —В–µ–Љ–њ–µ—А–∞—В—Г—А—Г –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В -10 –і–Њ 80 ¬∞–° –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М e—С –њ—А–Є –њ–Њ–Љ–µ—Й–µ–љ–Є–Є –≤ –њ–Њ–ї–µ–Ј–љ—Л–є –Њ–±—К–µ–Љ –њ—А–Є–±–Њ—А–Њ–≤, –≤—Л–і–µ–ї—П—О—Й–Є—Е –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–µ —В–µ–њ–ї–Њ, –љ–∞–њ—А–Є–Љ–µ—А —А–Њ–ї–ї–µ—А–љ—Л—Е —Г—Б—В–∞–љ–Њ–≤–Њ–Ї, –≤—Б—В—А—П—Е–Є–≤–∞—В–µ–ї–µ–є –Є —В.–њ.
–Т —Б–≤—П–Ј–Є —Б –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М—О –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ —А–Э –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є —Б—А–µ–і—Л –Є –µ–µ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Є—Б–њ–∞—А–µ–љ–Є—П –≤ –њ–µ—А–Є–Њ–і –Є–љ–Ї—Г–±–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї –±—Л–ї–Є —Б–Њ–Ј–і–∞–љ—Л —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –њ—А–Є–±–Њ—А—Л, –њ—А–µ–і–љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–µ –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є, вАФ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ —Г–≥–ї–µ–Ї–Є—Б–ї–Њ—В–љ—Л–µ –Є–љ–Ї—Г–±–∞—В–Њ—А—Л. –Я–Њ —Б–≤–Њ–µ–є –Ї–Њ–љ—Б—В—А—Г–Ї—Ж–Є–Є –Є –Њ—Б–љ–Њ–≤–љ—Л–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ –Њ–љ–Є –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—В –Њ–њ–Є—Б–∞–љ–љ—Л–Љ –≤—Л—И–µ —В–µ—А–Љ–Њ—Б—В–∞—В–∞–Љ. –Ю—Б–љ–Њ–≤–љ—Л–Љ –Њ—В–ї–Є—З–Є–µ–Љ —П–≤–ї—П–µ—В—Б—П –љ–∞–ї–Є—З–Є–µ —Б–Є—Б—В–µ–Љ —Б–Њ–Ј–і–∞–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞ –≥–∞–Ј–Њ–≤–Њ–є —Б—А–µ–і—Л –≤ –њ–Њ–ї–µ–Ј–љ–Њ–Љ –Њ–±—К–µ–Љ–µ –Є –≤—Л—Б–Њ–Ї–Њ–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є –≤–ї–∞–ґ–љ–Њ—Б—В–Є –≤ –љ–µ–Љ.
–Т –≥–∞–Ј–Њ–≤–Њ–є —Б—А–µ–і–µ –Ї–∞–Љ–µ—А —Г–≥–ї–µ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Є–љ–Ї—Г–±–∞—В–Њ—А–∞ –њ–Њ–≤—Л—И–µ–љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –Є —Г–≥–ї–µ–Ї–Є—Б–ї–Њ–≥–Њ –≥–∞–Ј–∞, –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —В–Њ–ї—М–Ї–Њ —Г–≥–ї–µ–Ї–Є—Б–ї–Њ–≥–Њ –≥–∞–Ј–∞; –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Ј–∞–і–∞—О—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—Б–ї–Њ–≤–Є–є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—В –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є —Б —В–Њ—З–љ–Њ—Б—В—М—О –і–Њ ¬±0,1 %. –°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Љ–Њ–і–µ–ї–Є —Н—В–Є—Е –њ—А–Є–±–Њ—А–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–≥—Г–ї–Є—А–Њ–≤–∞—В—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–Є—Б–ї–Њ—А–Њ–і–∞ –Є —Г–≥–ї–µ–Ї–Є—Б–ї–Њ–≥–Њ –≥–∞–Ј–∞ –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В 1 –і–Њ 95 –Њ–±.%.
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ—А–Є–љ—Г–і–Є—В–µ–ї—М–љ–Њ–µ –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є–µ –њ–Є—В–∞—В–µ–ї—М–љ—Л—Е —Б—А–µ–і —Б –њ–Њ–Љ–µ—Й–µ–љ–љ—Л–Љ–Є –≤ –љ–Є—Е –Ї—Г–ї—М—В—Г—А–∞–Љ–Є –Ї–ї–µ—В–Њ–Ї –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –ї—Г—З—И–Є–є –≥–∞–Ј–Њ–Њ–±–Љ–µ–љ –Є, —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П. –Т–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е —Н—В–Њ—В —Н—Д—Д–µ–Ї—В –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л, o–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –і–ї—П –і–∞–љ–љ–Њ–є –Ї—Г–ї—М—В—Г—А—Л. –Я—А–Є–±–Њ—А—Л, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є–µ —Н—В—Г –Њ–њ–µ—А–∞—Ж–Є—О, –љ–∞–Ј—Л–≤–∞—О—В—Б—П –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ–Є –≤—Б—В—А—П—Е–Є–≤–∞—В–µ–ї—П–Љ–Є. –Ъ–Њ–љ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ –Њ–љ–Є —Б–Њ—Б—В–Њ—П—В –Є–Ј –њ–ї–∞—В—Д–Њ—А–Љ—Л, –љ–∞ –Ї–Њ—В–Њ—А–Њ–є –Ї—А–µ–њ—П—В —Б–Њ—Б—Г–і—Л, –Ј–∞–њ–Њ–ї–љ–µ–љ–љ—Л–µ —Б—Г—Б–њ–µ–љ–Ј–Є–µ–є, –Є –њ—А–Є–≤–Њ–і–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–≥–Њ –≤—А–∞—Й–∞—В–µ–ї—М–љ–Њ–µ –Є–ї–Є –≤–Њ–Ј–≤—А–∞—В–љ–Њ-–њ–Њ—Б—В—Г–њ–∞—В–µ–ї—М–љ–Њ–µ –і–≤–Є–ґ–µ–љ–Є–µ –њ–ї–∞—В—Д–Њ—А–Љ—Л. –Т —Б–ї—Г—З–∞–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ–ї–∞—В—Д–Њ—А–Љ—Г –њ–Њ–Љ–µ—Й–∞—О—В –≤ –≤–Њ–Ј–і—Г—И–љ—Л–є —В–µ—А–Љ–Њ—Б—В–∞—В; –Є–ї–Є –≤–Њ–і—П–љ—Г—О –±–∞–љ—О. –≠—В–Є –њ—А–Є–±–Њ—А—Л –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —Б–ї–Њ–ґ–љ—Л–Љ –Є –і–Њ—А–Њ–≥–Є–Љ —В–µ—Е–љ–Є—З–µ—Б–Ї–Є–Љ —Г—Б—В—А–Њ–є—Б—В–≤–∞–Љ, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б–Њ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–Љ–Є —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ–Є –Ї –Є—Е —А–∞–±–Њ—В–µ, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П —Б—В—А–Њ–≥–Њ–µ –њ–ї–Њ—Б–Ї–Њ-–њ–∞—А–∞–ї–ї–µ–ї—М–љ–Њ–µ –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є–µ –њ–ї–∞—В—Д–Њ—А–Љ—Л –±–µ–Ј —В–Њ–ї—З–Ї–Њ–≤ –Є –≤–Є–±—А–∞—Ж–Є–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є –≤—А–∞—Й–∞—В–µ–ї—М–љ–Њ–Љ –і–≤–Є–ґ–µ–љ–Є–Є –і–Є–∞–Љ–µ—В—А —Н—В–Њ–≥–Њ –њ–µ—А–µ–Љ–µ—Й–µ–љ–Є—П –і–Њ–ї–ґ–µ–љ –±—Л—В—М –Њ–і–Є–љ–∞–Ї–Њ–≤ –≤ –ї—О–±–Њ–є —В–Њ—З–Ї–µ –њ–ї–∞—В—Д–Њ—А–Љ—Л. –Ч–∞–і–∞–љ–љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л –≤—Б—В—А—П—Е–Є–≤–∞–љ–Є—П (–њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є—П) –љ–∞–њ—А–Є–Љ–µ—А —А–∞–і–Є—Г—Б –≤—А–∞—Й–µ–љ–Є—П, –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ–Є. –Я–ї–∞—В—Д–Њ—А–Љ—Г –њ—А–Є–≤–Њ–і—П—В –≤ –і–≤–Є–ґ–µ–љ–Є–µ —Б –њ–Њ–Љ–Њ—Й—М—О —Н–ї–µ–Ї—В—А–Њ–і–≤–Є–≥–∞—В–µ–ї—П —З–µ—А–µ–Ј —Б–Є—Б—В–µ–Љ—Г –Ї–Є–љ–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–і–∞—З –Є–ї–Є –њ—Г—В–µ–Љ –њ—А–Є–ї–Њ–ґ–µ–љ–Є—П –Ї –њ–ї–∞—В—Д–Њ—А–Љ–µ –Љ–∞–≥–љ–Є—В–љ–Њ–≥–Њ, –њ–Њ–ї—П.
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Є–±–Њ—А–Њ–≤ —Н—В–Њ–≥–Њ –≤–Є–і–∞ –Є–Љ–µ–µ—В —Б–ї–µ–і—Г—О—Й–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є: —З–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–≤—А–∞—В–љ–Њ-–њ–Њ—Б—В—Г–њ–∞—В–µ–ї—М–љ—Л—Е –і–≤–Є–ґ–µ–љ–Є–є –њ–ї–∞—В—Д–Њ—А–Љ—Л 10 вАФ 300 –Ї–Њ–ї–µ–±–∞–љ–Є–є –≤ 1 –Љ–Є–љ, —З–∞—Б—В–Њ—В–∞ –≤—А–∞—Й–∞—В–µ–ї—М–љ—Л—Е –і–≤–Є–ґ–µ–љ–Є–є –њ–ї–∞—В—Д–Њ—А–Љ—Л 40 вАФ 400 –Њ–±/–Љ–Є–љ, —А–∞–і–Є—Г—Б –≤—А–∞—Й–µ–љ–Є—П 20 - 25 –Љ–Љ, —Е–Њ–і –≤–Њ–Ј–≤—А–∞—В–љ–Њ-–њ–Њ—Б—В—Г–њ–∞—В–µ–ї—М–љ–Њ–≥–Њ –і–≤–Є–ґ–µ–љ–Є—П 10вАФ40 –Љ–Љ, —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В—М –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П, –Ј–∞–і–∞–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –љ–µ –Љ–µ–љ–µ–µ ¬±1 % –Њ—В –Ј–∞–і–∞–љ–љ–Њ–є –≤–µ–ї–Є—З–Є–љ—Л. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Љ–Њ–і–µ–ї–µ–є –≤—Б—В—А—П—Е–Є–≤–∞—В–µ–ї–µ–є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є–µ –≤ –Њ–і–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ - –≤—А–∞—Й–∞—В–µ–ї—М–љ–Њ–Љ –Є–ї–Є –≤–Њ–Ј–≤—А–∞—В–љ–Њ-–њ–Њ—Б—В—Г–њ–∞—В–µ–ї—М–љ–Њ–Љ. –Э–∞–Є–±–Њ–ї–µ–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –Љ–Њ–і–µ–ї–Є —П–≤–ї—П—О—В—Б—П —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ—Л–Љ–Є, —В.–µ. –Љ–Њ–≥—Г—В —А–∞–±–Њ—В–∞—В—М –≤ –ї—О–±–Њ–Љ –Є–Ј –њ—А–Є–≤–µ–і–µ–љ–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є—П.
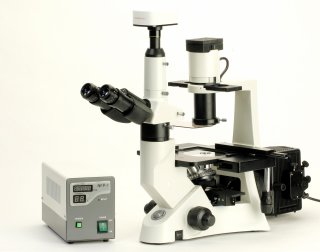
–Ь–Є–Ї—А–Њ—Б–Ї–Њ–њ—Л
–Ф–ї—П –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ —Б–Њ—Б—В–Њ—П–љ–Є–Є –Ї—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є—Б–њ–Њ–ї—М–Ј—Г—О—В —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–µ –Є–љ–≤–µ—А—В–Є—А–Њ–≤–∞–љ–љ—Л–µ –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ—Л. –Я—А–Є–љ—Ж–Є–њ –Є–љ–≤–µ—А—В–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В–Є (–њ–µ—А–µ–≤–µ—А–љ—Г—В–Њ—Б—В–Є) –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –Њ–±—К–µ–Ї—В –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ—Б–≤–µ—Й–∞–µ—В—Б—П —Б–≤–µ—А—Е—Г, –∞ –љ–∞–±–ї—О–і–µ–љ–Є–µ –≤–µ–і–µ—В—Б—П —З–µ—А–µ–Ј –Њ–±—К–µ–Ї—В–Є–≤—Л, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–µ –њ–Њ–і –Њ–±—К–µ–Ї—В–Њ–Љ. –≠—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–±–ї—О–і–∞—В—М –Ј–∞ –ґ–Є–≤—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –≤ –Ї—Г–ї—М—В—Г—А–µ, —В.–µ. –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –≤, —Б–Њ—Б—Г–і–∞—Е, –≥–і–µ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ—А–Њ—Ж–µ—Б—Б –Є—Е —А–Њ—Б—В–∞. –Т –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–∞—Е —Б –Њ–±—Л—З–љ–Њ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є —Б—Е–µ–Љ–Њ–є –Є—Б–Ї–ї—О—З–∞–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ–Њ–Љ–µ—Й–µ–љ–Є—П —В–∞–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤ –Љ–µ–ґ–і—Г —Б—В–Њ–ї–Є–Ї–Њ–Љ, –Є –Њ–±—К–µ–Ї—В–Є–≤–Њ–Љ –Є–Ј-–Ј–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є —Н—В–Њ–≥–Њ —А–∞—Б—Б—В–Њ—П–љ–Є—П.
–Я—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є–µ –Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Ї–ї–µ—В–Њ–Ї
–Я–µ—А–µ—З–µ–љ—М —В–Є–њ–Њ–≤ –Ї–ї–µ—В–Њ–Ї, –Ї–Њ—В–Њ—А—Л–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Љ–Њ–ґ–љ–Њ –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞—В—М, –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤–µ–ї–Є–Ї. –≠—В–Њ —Н–ї–µ–Љ–µ–љ—В—Л —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є (—Д–Є–±—А–Њ–±–ї–∞—Б—В—Л), —Б–Ї–µ–ї–µ—В–љ—Л–µ —В–Ї–∞–љ–Є (–Ї–Њ—Б—В—М, –Є —Е—А—П—Й–Є), —Б–Ї–µ–ї–µ—В–љ—Л–µ, —Б–µ—А–і–µ—З–љ–∞—П –Є –≥–ї–∞–і–Ї–Є–µ –Љ—Л—И—Ж—Л, —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ —В–Ї–∞–љ–Є (–њ–µ—З–µ–љ—М, –ї–µ–≥–Ї–Є–µ, –Љ–Њ–ї–Њ—З–љ–∞—П –ґ–µ–ї–µ–Ј–∞, –Ї–Њ–ґ–Є, –Љ–Њ—З–µ–≤–Њ–є –њ—Г–Ј—Л—А—М, –њ–Њ—З–Ї–Є), –Ї–ї–µ—В–Ї–Є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–≥–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Є –љ–µ–є—А–Њ–љ—Л, —Е–Њ—В—П –њ–Њ—Б–ї–µ–і–љ–Є–µ –ї–Є—И–µ–љ—Л —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є), —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є (–љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Є, –≥–Є–њ–Њ—Д–Є–Ј, –Ї–ї–µ—В–Ї–Є –Њ—Б—В—А–Њ–≤–Ї–Њ–≤ –Ы–∞–љ–≥–µ—А–≥–∞–љ—Б–∞), –Љ–µ–ї–∞–љ–Њ—Ж–Є—В—Л –Є —А–∞–Ј–ї–Є—З–љ—Л–µ —В–Є–њ—Л –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї.
–Ф–ї—П —В–Њ–≥–Њ —З—В–Њ–±—Л –Ї–ї–µ—В–Ї–Є –њ—А–Њ–ї–Є—Д–µ—А–Є—А–Њ–≤–∞–ї–Є, –Њ–љ–Є –і–Њ–ї–ґ–љ—Л –њ—А–Њ–Є—Б—Е–Њ–і–Є—В—М —Б–Ї–Њ—А–µ–µ –Њ—В –љ–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤, —З–µ–Љ –Њ—В –њ–Њ–ї–љ–Њ—Б—В—М—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А—Л—Е –Ї –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –≤ –љ–Њ—А–Љ–µ —Г—В—А–∞—З–Є–≤–∞–µ—В—Б—П.
–Ю–і–љ–∞–Ї–Њ –њ–Њ–њ—Г–ї—П—Ж–Є—П –љ–µ–Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М –≥–Њ–Љ–Њ–≥–µ–љ–љ–Њ–є –Є –Њ–±–ї–∞–і–∞—В—М —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Д–µ–љ–Њ—В–Є–њ–Њ–Љ. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –Ї—Г–ї—М—В—Г—А—Л, –љ–∞–њ—А–Є–Љ–µ—А –Ї–µ—А–∞—В–Є–љ–Њ—Ж–Є—В—Л —Н–њ–Є–і–µ—А–Љ–Є—Б–∞, —Б–Њ–і–µ—А–ґ–∞—В —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є, –Ї–ї–µ—В–Ї–Є-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Є –Є –Ї–µ—А–∞—В–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ —З–µ—И—Г–є—З–∞—В—Л–µ –Ї–ї–µ—В–Ї–Є. –Т —В–∞–Ї–Њ–є –Ї—Г–ї—М—В—Г—А–µ –њ—А–Њ–Є—Б—Е–Њ–і—П—В –њ–Њ—Б—В–Њ—П–љ–љ–Њ–µ –Њ–±–љ–Њ–≤–ї–µ–љ–Є–µ –Ј–∞ —Б—З–µ—В —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –Є —Б–Њ–Ј—А–µ–≤–∞–љ–Є–µ –Ї–ї–µ—В–Њ–Ї-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤, —В–µ—А–Љ–Є–љ–∞–ї—М–љ–∞—П –љ–µ–Њ–±—А–∞—В–Є–Љ–∞—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–∞, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–∞—П—Б—П ¬Ђ—Б–ї—Г—Й–Є–≤–∞–љ–Є–µ–Љ¬ї —З–µ—И—Г–є—З–∞—В—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Г—О —Б—А–µ–і—Г. –Ъ—Г–ї—М—В—Г—А—Л –і—А—Г–≥–Є—Е –Ї–ї–µ—В–Њ–Ї; –љ–∞–њ—А–Є–Љ–µ—А —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Њ–і–љ–Њ—А–Њ–і–љ—Г—О –њ–Њ–њ—Г–ї—П—Ж–Є—О –њ—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—Й–Є—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Є –љ–Є–Ј–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Љ–Њ–љ–Њ—Б–ї–Њ–є (–Њ–Ї–Њ–ї–Њ 104 –Ї–ї–µ—В–Њ–Ї –љ–∞ 1 —Б–Љ2) –Є —Б—В–Є–ї—М –ґ–µ –Њ–і–љ–Њ—А–Њ–і–љ—Г—О –њ–Њ–њ—Г–ї—П—Ж–Є—О –±–Њ–ї–µ–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е, –љ–µ–њ—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—Й–Є—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Љ–Њ–љ–Њ—Б–ї–Њ—П (105 –Ї–ї–µ—В–Њ–Ї –љ–∞ 1 —Б–Љ2). –≠—В–∞ –њ–Њ–њ—Г–ї—П—Ж–Є—П —Д–Є–±—А–Њ—Ж–Є—В–Њ–њ–Њ–і–Њ–±–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Љ–Њ–љ–Њ—Б–ї–Њ—П —Б–њ–Њ—Б–Њ–±–љ–∞ –Ї –≤–Њ–Ј–≤—А–∞—Й–µ–љ–Є—О –≤ –Ї–ї–µ—В–Њ—З–љ—Л–є —Ж–Є–Ї–ї –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —В—А–Є–њ—Б–Є–љ–Є–Ј–∞—Ж–Є–Є, —Б–љ–Є–ґ–∞—О—Й–µ–є –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ–Ї –≤ –Љ–Њ–љ–Њ—Б–ї–Њ–µ, –Є–ї–Є —Б–Њ—Б–Ї–∞–±–ї–Є–≤–∞–љ–Є—П —З–∞—Б—В–Є –Ї–ї–µ—В–Њ–Ї, –њ—А–Є–≤–Њ–і—П—Й–µ–≥–Њ –Ї –њ–Њ—П–≤–ї–µ–љ–Є—О —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ї—А–∞—П –Љ–Њ–љ–Њ—Б–ї–Њ—П. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–∞ –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї —А–µ–≥—Г–ї–Є—А—Г—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –њ–ї–Њ—В–љ–Њ—Б—В—М—О –Љ–Њ–љ–Њ—Б–ї–Њ—П, –љ–Њ –Є –њ–Є—В–∞—В–µ–ї—М–љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є —Б—А–µ–і—Л (—Б—Л–≤–Њ—А–Њ—В–Ї–∞, Ca2+), –≥–Њ—А–Љ–Њ–љ–∞–Љ–Є, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ–Љ —Б –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–Љ –Љ–∞—В—А–Є–Ї—Б–Њ–Љ.
–Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–∞
–Т–µ–і–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–љ–Є–є —В—А–µ–±—Г–µ—В –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–ї–µ—В–Њ–Ї, –њ–Њ—Н—В–Њ–Љ—Г –≤—Л–±–Њ—А —Г—Б–ї–Њ–≤–Є–є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–Є –љ–∞–њ—А–∞–≤–ї–µ–љ –љ–∞ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є —Б–Ї–Њ—А–Њ—Б—В–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є. –≠—В–Є —Г—Б–ї–Њ–≤–Є—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л –і–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Ї–ї–µ—В–Њ–Ї, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Є—Е —А–Њ—Б—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П –Є–ї–Є –њ–Њ–ї–љ–Њ—Б—В—М—О –њ–Њ–і–∞–≤–ї—П–µ—В—Б—П. –Ъ —Г—Б–ї–Њ–≤–Є—П–Љ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–Љ —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—О –Ї–ї–µ—В–Њ–Ї, –Њ—В–љ–Њ—Б—П—В—Б—П –Є—Е –љ–Є–Ј–Ї–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М, –љ–µ–≤—Л—Б–Њ–Ї–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П Ca2+, –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ —А–Њ—Б—В–Њ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ —Н–њ–Є–і–µ—А–Љ–Є—Б–∞, —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ –Є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞, —Б–Є–љ—В–µ–Ј–Є—А—Г–µ–Љ—Л–є —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞–Љ–Є. –Т—Л—Б–Њ–Ї–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ–Ї (–≤—Л—И–µ 105 –Ї–ї–µ—В–Њ–Ї –љ–∞ 1 —Б–Љ2) –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П Ca2+ (300вАФ1500 –Љ–Ї–Љ–Њ–ї—М); –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ –Є–љ–і—Г–Ї—В–Њ—А–Њ–≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є (–≥–Њ—А–Љ–Њ–љ—Л, –љ–∞–њ—А–Є–Љ–µ—А –≥–Є–і—А–Њ–Ї–Њ—А—В–Є–Ј–Њ–љ, —Д–∞–Ї—В–Њ—А —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –≥–ї–Є–Є, —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ –љ–µ—А–≤–Њ–≤, —А–µ—В–Є–љ–Њ–Є–і—Л; –Є –њ–Њ–ї—П—А–љ—Л–µ —А–∞—Б—В–≤–Њ—А–Є—В–µ–ї–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –і–Є–Љ–µ—В–Є–ї—Б—Г–ї—М—Д–Њ–Ї—Б–Є–і) —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—О –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –і–µ–ї–µ–љ–Є—П –Є –Є–љ–і—Г—Ж–Є—А—Г—О—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Єpo–≤–Ї—Г –Ї–ї–µ—В–Њ–Ї. –Э–Є–Ј–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–µ –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ—Ж–Є—В–Њ–≤, –љ–Њ –і–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –≤ –Њ—А–Њ–≥–Њ–≤–µ–≤–∞—О—Й–Є–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є. –С–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –Њ—Б–Њ–±–µ–љ–љ–Њ –і–ї—П —Н–њ–Є—В–µ–ї–Є—П, –Є–Љ–µ–µ—В —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –њ—А–∞–≤–Є–ї—М–љ–Њ–є –њ–Њ–ї—П—А–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї –Є –Є—Е —Д–Њ—А–Љ—Л. –Ъ–ї–µ—В–Ї–Є, —А–∞—Б—В—Г—Й–Є–µ –љ–∞ –≤–Ј–≤–µ—Б–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤–Њ–≥–Њ –≥–µ–ї—П, —Б–Љ—Л–≤–∞—О—В—Б—П –њ–Є—В–∞—В–µ–ї—М–љ–Њ–є —Б—А–µ–і–Њ–є —Б–Њ –≤—Б–µ—Е —Б—В–Њ—А–Њ–љ, –Є —Н—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—В—М –њ—А–∞–≤–Є–ї—М–љ—Г—О –њ–Њ–ї—П—А–љ–Њ—Б—В—М –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –њ—А–∞–≤–Є–ї—М–љ—Г—О —Д–Њ—А–Љ—Г –Ї–ї–µ—В–Њ–Ї –±–ї–∞–≥–Њ–і–∞—А—П —Б—Г–±—Б—В—А–∞—В—Г.
–Ю—А–≥–∞–љ–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞ –Ї–ї–µ—В–Њ–Ї
–Ш—Б—Е–Њ–і–љ–Њ —В–Ї–∞–љ–µ–≤—Л–Љ–Є –Ї—Г–ї—М—В—Г—А–∞–Љ–Є –љ–∞–Ј—Л–≤–∞–ї–Є —Н–Ї—Б–њ–ї–∞–љ—В–∞—В—Л —Ж–µ–ї—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ —В–Ї–∞–љ–µ–є, –њ–Њ–ї–∞–≥–∞—П, —З—В–Њ –≤ —Н—В–Є—Е —Д—А–∞–≥–Љ–µ–љ—В–∞—Е, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ —З–∞—Б—В–Є—З–љ–Њ, –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В—Б—П –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Ж–µ–ї–Њ—Б—В–љ–Њ—Б—В—М. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П ¬Ђ–Ї—Г–ї—М—В—Г—А–∞ —В–Ї–∞–љ–Є¬ї –њ—А–µ–≤—А–∞—В–Є–ї–∞—Б—М –і –Њ–±—Й–µ–µ –њ–Њ–љ—П—В–Є–µ, –≤–Ї–ї—О—З–∞—О—Й–µ–µ –≤ —Б–µ–±—П –Ї–∞–Ї –Њ—А–≥–∞–љ–љ—Г—О –Ї—Г–ї—М—В—Г—А—Г, –≤ –Ї–Њ—В–Њ—А–Њ–є –љ–µ–±–Њ–ї—М—И–Є–µ —Д—А–∞–≥–Љ–µ–љ—В—Л —В–Ї–∞–љ–Є –Є–ї–Є —Ж–µ–ї—Л–µ —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л–µ –Њ—А–≥–∞–љ—Л —Н–Ї—Б–њ–ї–∞–љ—В–Є—А—Г—О—В—Б—П —Б —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ —В–Ї–∞–љ–µ–≤–Њ–є –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є, —В–∞–Ї –Є –Ї—Г–ї—М—В—Г—А—Г –Ї–ї–µ—В–Њ–Ї, –≤ –Ї–Њ—В–Њ—А–Њ–є —В–Ї–∞–љ–Є –і–Є—Б–њ–µ—А–≥–Є—А—Г—О—В—Б—П –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є, —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ –Є–ї–Є –њ—Г—В–µ–Љ —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є –Љ–Є–≥—А–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї –Є–Ј —Н–Ї—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є, –Є –Ї–ї–µ—В–Ї–Є —А–∞–Ј–Љ–љ–Њ–ґ–∞—О—В—Б—П –≤ –≤–Є–і–µ —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Є–ї–Є –Љ–Њ–љ–Њ—Б–ї–Њ—П, –њ—А–Є–Ї—А–µ–њ–Є–≤—И–µ–≥–Њ—Б—П –Ї —Б—Г–±—Б—В—А–∞—В—Г –Ї–ї–µ—В–Њ–Ї.
–Я—А–Є –≤—Л–±–Њ—А–µ —В–Њ–≥–Њ –Є–ї–Є –Є–љ–Њ–≥–Њ —В–Є–њ–∞ –Ї—Г–ї—М—В—Г—А—Л —Б–ї–µ–і—Г–µ—В –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ —Б–ї–µ–і—Г—О—Й–µ–µ. –Ю—А–≥–∞–љ–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞ —Б–Њ—Е—А–∞–љ—П–µ—В –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П, –≤ —В–µ—З–µ–љ–Є–µ –і–Њ–ї–≥–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≤—А–µ–Љ–µ–љ–Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–µ—В –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї—Г—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г –Є –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї—М–љ–Њ–є —В—А–∞–≤–Љ—Л —Н–Ї—Б–њ–ї–∞–љ—В–∞—Ж–Є–Є –Є —А—П–і–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –љ–µ–Ї—А–Њ–Ј–Њ–≤ –Њ—Б—В–∞–µ—В—Б—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ –љ–µ—А–∞—Б—В—Г—Й–µ–Љ —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є –Є –і–∞–ґ–µ –љ–µ–і–µ–ї—М. –Ъ—Г–ї—М—В—Г—А—Л –Ї–ї–µ—В–Њ–Ї, –љ–∞–Њ–±–Њ—А–Њ—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –ї–Є—И–µ–љ—Л —Б—В—А—Г–Ї—В—Г—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є, —В–µ—А—П—О—В —Е–∞—А–∞–Ї—В–µ—А–љ—Г—О –≥–Є—Б—В–Є–Њ—В–Є–і–Є—З–µ—Б–Ї—Г—О. –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї—Г –Є —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–µ–є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –Є –Њ–±—Л—З–љ–Њ –љ–µ –і–Њ—Б—В–Є–≥–∞—О—В —А–∞–≤–љ–Њ–≤–µ—Б–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Г—Б–ї–Њ–≤–Є–є. –Ъ–ї–µ—В–Ї–Є –≤ –Ї—Г–ї—М—В—Г—А–∞—Е —А–∞–Ј–Љ–љ–Њ–ґ–∞—О—В—Б—П, —З—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–ї—Г—З–µ–љ–Є–µ –±–Њ–ї—М—И–Њ–є –Љ–∞—Б—Б—Л –Ї–ї–µ—В–Њ–Ї –Є –Є—Е —А–∞–Ј–і–µ–ї–µ–љ–Є–µ –љ–∞ –Є–і–µ–љ—В–Є—З–љ—Л–µ –њ–∞—А–∞–ї–ї–µ–ї–Є. –Ъ—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л–µ –Ї–ї–µ—В–Ї–Є –Љ–Њ–≥—Г—В, –±—Л—В—М –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–љ—Л, –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–∞—П –Ї–ї–µ—В–Њ—З–љ–∞—П –њ–Њ–њ—Г–ї—П—Ж–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–Њ—Е—А–∞–љ–µ–љ–∞ –њ—Г—В–µ–Љ –Ј–∞–Љ–Њ—А–∞–ґ–Є–≤–∞–љ–Є—П. –Ъ–ї–µ—В–Ї–Є –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А—Г—О—В –њ–Њ —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ, –њ—Г—В–µ–Љ –≤—Л—А–∞—Й–Є–≤–∞–љ–Є—П –≤ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–є —Б—А–µ–і–µ, —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—В–±–Њ—А–∞, –Ї–ї–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є –≥–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Є –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –ї–Є–љ–Є–Є –Ї–ї–µ—В–Њ–Ї.
–Ш—Б—В–Њ—З–љ–Є–Ї —В–Ї–∞–љ–Є
–Ъ—Г–ї—М—В—Г—А—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –Є–Ј —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л—Е —В–Ї–∞–љ–µ–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –ї—Г—З—И–µ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М—О –Є –±–Њ–ї–µ–µ –∞–Ї—В–Є–≤–љ—Л–Љ —А–Њ—Б—В–Њ–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Ї—Г–ї—М—В—Г—А–∞–Љ–Є –Є–Ј —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е ¬Ђ–≤–Ј—А–Њ—Б–ї—Л—Е¬ї —В–Ї–∞–љ–µ–є. –≠–Ґ–† –Њ—В—А–∞–ґ–∞–µ—В, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –љ–∞–ї–Є—З–Є–µ —А–µ–њ–ї–Є—Ж–Є—А—Г—О—Й–Є—Е—Б—П –Ї–ї–µ—В–Њ–Ї-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –Є–ї–Є —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ —Н–Љ–±—А–Є–Њ–љ–∞—Е. ¬Ђ–Т–Ј—А–Њ—Б–ї—Л–µ¬ї —В–Ї–∞–љ–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –њ–Њ–љ–Є–ґ–µ–љ–љ—Л–Љ –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ –њ—Г–ї–Њ–Љ –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –љ–µ–і–µ–ї—П—Й–Є—Е—Б—П —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —З–∞—Б—В–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б –±–Њ–ї–µ–µ —Б—В—А—Г–Ї—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л–Љ –Є —Б–ї–∞–±–Њ –і–µ–Ј–∞–≥—А–µ–≥–Є—А—Г—О—Й–Є–Љ –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–Љ –Љ–∞—В—А–Є–Ї—Б–Њ–Љ. –Я–Њ–ї—Г—З–µ–љ–Є–µ –њ–µ—А–≤–Є—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А –Ї–ї–µ—В–Њ–Ї ¬Ђ–≤–Ј—А–Њ—Б–ї—Л—Е¬ї —В–Ї–∞–љ–µ–є –Є –Є—Е —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є–µ —П–≤–ї—П—О—В—Б—П –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ–Њ–є –Ј–∞–і–∞—З–µ–є, –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ґ–Є–Ј–љ–Є —В–∞–Ї–Є—Е –Ї—Г–ї—М—В—Г—А, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ–≤–µ–ї–Є–Ї–∞.
–Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є–Љ–µ—А–Њ–≤ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –ї–Є–љ–Є–є —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Љ–Њ–ґ–љ–Њ –њ—А–Є–≤–µ—Б—В–Є —А–∞–Ј–ї–Є—З–љ—Л–µ –ї–Є–љ–Є–Є –Ч–Ґ–Ч (–Љ—Л—И–Є–љ—Л–µ —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л–µ —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л), –ї–Є–љ–Є—О MRC-5 –Є –Ф—А—Г–≥–Є–µ –ї–Є–љ–Є–Є —Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л—Е –ї–µ–≥–Њ—З–љ—Л—Е —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ъ–ї–µ—В–Ї–Є –Љ–µ–Ј–Њ–і–µ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–ґ–і–µ–љ–Є—П (—Д–Є–±—А–Њ–±–ї–∞—Б—В—Л, –Ї–ї–µ—В–Ї–Є —Н–љ–і–Њ—В–µ–ї–Є—П, –Љ–Є–Њ–±–ї–∞—Б—В—Л) –ї–µ–≥—З–µ –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞—В—М, —З–µ–Љ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –љ–µ–є—А–Њ–љ—Л –Є –Ї–ї–µ—В–Ї–Є —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е —В–Ї–∞–љ–µ–є.
–Э–Њ—А–Љ–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –і–∞—О—В –љ–∞—З–∞–ї–Њ –Ї—Г–ї—М—В—Г—А–∞–Љ —Б –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –ґ–Є–Ј–љ–Є, —В–Њ–≥–і–∞ –Ї–∞–Ї –Ї—Г–ї—М—В—Г—А—Л –Ї–ї–µ—В–Њ–Ї, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј –Њ–њ—Г—Е–Њ–ї–µ–є, —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Њ–ї–Є—Д–µ—А–Є—А–Њ–≤–∞—В—М –љ–µ–Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ –і–Њ–ї–≥–Њ. –Ш–Ј–≤–µ—Б—В–љ–Њ, –Њ–і–љ–∞–Ї–Њ, –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–Є–љ–Є–є –љ–µ–Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ –њ—А–Њ–ї–Є—Д–µ—А–Є—А—Г—О—Й–Є—Е –Ї–ї–µ—В–Њ–Ї (–Ї–ї–µ—В–Ї–Є –њ–Њ—З–Ї–Є —Б–Њ–±–∞–Ї–Є, —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л –Ч–Ґ–Ч), –Ї–Њ—В–Њ—А—Л–µ –љ–µ –њ—А–Є–≤–Є–≤–∞—О—В—Б—П –њ—А–Є –≤–≤–µ–і–µ–љ–Є–Є –ґ–Є–≤–Њ—В–љ—Л–Љ, —В.–µ. –љ–µ —П–≤–ї—П—О—В—Б—П –Њ–њ—Г—Е–Њ–ї–µ—А–Њ–і–љ—Л–Љ–Є. –Э–Њ—А–Љ–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є –Њ–±—Л—З–љ–Њ —А–∞—Б—В—Г—В –Ї–∞–Ї –љ–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б—В–≤–Њ–ї–Њ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –Є–ї–Є –Ї–ї–µ—В–Ї–Є-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Є, –Є –љ–∞—Б—В—Г–њ–ї–µ–љ–Є–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –≤ —В–∞–Ї–Њ–є –Ї—Г–ї—М—В—Г—А–µ —З–∞—Б—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–ї–љ—Л–Љ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ–Љ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –љ–Њ—А–Љ–∞–ї—М–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –љ–∞–њ—А–Є–Љ–µ—А —Д–Є–±—А–Њ–±–ї–∞—Б—В—Л –Є –Ї–ї–µ—В–Ї–Є —Н–љ–і–Њ—В–µ–ї–Є—П, —Б–њ–Њ—Б–Њ–±–љ—Л –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П, –Ј–∞—В–µ–Љ –і–µ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П, –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї—П—В—М –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Є –≤–љ–Њ–≤—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞—В—М—Б—П. –Ф—А—Г–≥–Є–µ, –љ–∞–њ—А–Є–Љ–µ—А –Ї–ї–µ—В–Ї–Є –Њ—А–Њ–≥–Њ–≤–µ–≤–∞—О—Й–µ–≥–Њ —Н–њ–Є—В–µ–ї–Є—П –Є –Љ–љ–Њ–≥–Є–µ –Ї—А–Њ–≤–µ—В–≤–Њ—А–љ—Л–µ –Ї–ї–µ—В–Ї–Є, –њ–Њ—Б–ї–µ –Є–љ–Є—Ж–Є–∞—Ж–Є–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –љ–µ —Б–њ–Њ—Б–Њ–±–љ—Л –Ї –≤–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–Є—О –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є.
–Т –Ї—Г–ї—М—В—Г—А–∞—Е –Ї–ї–µ—В–Њ–Ї, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј –Њ–њ—Г—Е–Њ–ї–µ–є, –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–∞, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ —З–∞—Б—В–Є—З–љ–∞—П, –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є. –Ю–њ—Г—Е–Њ–ї–µ–≤—Л–µ —В–Ї–∞–љ–Є —З–∞—Б—В–Њ –Љ–Њ–≥—Г—В –њ–∞—Б—Б–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ —Б–Є–љ–≥–µ–љ–љ—Л—Е —Е–Њ–Ј—П–µ–≤–∞—Е, –Є —Н—В–Њ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ—А–Њ—Б—В–Њ–µ –Є –і–µ—И–µ–≤–Њ–µ –њ–Њ–ї—Г—З–µ–љ–Є–µ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –Ї–ї–µ—В–Њ–Ї, —Е–Њ—В—П –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Љ–Њ–≥—Г—В –±—Л—В—М –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≥–Њ–Љ–Њ–≥–µ–љ–љ—Л. –Т —Б–ї—Г—З–∞–µ –Њ—В—Б—Г—В—Б—В–≤–Є—П –њ—А–Є—А–Њ–і–љ—Л—Е —Е–Њ–Ј—П–µ–≤ –Њ–њ—Г—Е–Њ–ї–Є –Љ–Њ–ґ–љ–Њ –њ–∞—Б—Б–Є—А–Њ–≤–∞—В—М –љ–∞ –±–µ—Б—В–Є–Љ—Г—Б–љ—Л—Е –Љ—Л—И–∞—Е. –Ь–љ–Њ–≥–Є–µ –і—А—Г–≥–Є–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ–Є –Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л —А–∞–Ј–ї–Є—З–Є—П–Љ –Љ–µ–ґ–і—Г –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ–Є –Є –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ–Є –ї–Є–љ–Є—П–Љ–Є –Ї–ї–µ—В–Њ–Ї; –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –≤–∞–ґ–љ–Њ—Б—В–Є –њ—А–Є–Њ–±—А–µ—В–µ–љ–Є—П ¬Ђ–±–µ—Б—Б–Љ–µ—А—В–Є—П¬ї –≤ –љ–µ–Њ–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї (Land H., 1983).
–°—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ.
–°–≤–µ–ґ–µ–≤—Л–і–µ–ї–µ–љ–љ—Л–µ –Ї—Г–ї—М—В—Г—А—Л –љ–Њ—Б—П—В –љ–∞–Ј–≤–∞–љ–Є–µ ¬Ђ–њ–µ—А–≤–Є—З–љ—Л–µ¬ї –і–Њ –љ–∞—З–∞–ї–∞ –њ–∞—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є —Б—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П. –Ъ–ї–µ—В–Ї–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Ї—Г–ї—М—В—Г—А—Л –Њ–±—Л—З–љ–Њ –≥–µ—В–µ—А–Њ–≥–µ–љ–љ—Л –Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –Љ–∞–ї—Л–Љ –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л–Љ –њ—Г–ї–Њ–Љ, –љ–Њ –≤ –љ–Є—Е –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ–ї–љ–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —В–Є–њ—Л –Ї–ї–µ—В–Њ–Ї —В–Њ–є —В–Ї–∞–љ–Є, –Њ—В–Ї—Г–і–∞ –Њ–љ–Є –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л, –∞ —В–∞–Ї–ґ–µ —З–µ—В–Ї–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П —А—П–і–∞ —Б–≤–Њ–є—Б—В–≤, –њ—А–Є—Б—Г—Й–Є—Е –і–∞–љ–љ–Њ–є —В–Ї–∞–љ–Є. –°—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Њ–і–ї–µ–љ–Є—П —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є—П –Ї—Г–ї—М—В—Г—А—Л (–≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ–ї—Г—З–∞—О—В –ї–Є–љ–Є–Є –Ї–ї–µ—В–Њ–Ї), –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Ї–ї–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї, –∞ —В–∞–Ї–ґ–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –±–Њ–ї–µ–µ –Њ–і–љ–Њ—А–Њ–і–љ—Л—Е –њ–Њ–њ—Г–ї—П—Ж–Є–є. –Я—А–Є —Н—В–Њ–Љ –≤–Њ –Љ–љ–Њ–≥–Є—Е —Б–ї—Г—З–∞—П—Е —Б—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ—В–µ—А–µ, —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Њ—З–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤.
–Ю—Б–љ–Њ–≤–љ—Л–Љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–Њ–Љ –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–љ–Є–є –Є–Ј –њ–µ—А–≤–Є—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А —П–≤–ї—П–µ—В—Б—П –љ–∞—А–∞–±–Њ—В–Ї–∞ –±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б—В–∞–±–Є–ї—М–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –њ—А–Є–≥–Њ–і–љ–Њ–≥–Њ –і–ї—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П.
–Т—Л–±–Њ—А —Б—А–µ–і—Л
–°—А–µ–і—Г, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —З–∞—Б—В–Њ –≤—Л–±–Є—А–∞—О—В —З–Є—Б—В–Њ —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є. –≠—В–Њ –љ–µ —Б—В–Њ–ї—М –≤–∞–ґ–љ–Њ –і–ї—П –њ–Њ—Б—В–Њ—П–љ–љ—Л—Е –ї–Є–љ–Є–є –Ї–ї–µ—В–Њ–Ї, –љ–Њ –њ—А–Є —А–∞–±–Њ—В–µ —Б–Њ —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є, —Б –њ–µ—А–≤–Є—З–љ—Л–Љ–Є –Ї—Г–ї—М—В—Г—А–∞–Љ–Є, –њ—А–Є –≤—Л—А–∞—Й–Є–≤–∞–љ–Є–Є –Ї–ї–µ—В–Њ–Ї –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –≤—Л–±–Њ—А —Б—А–µ–і—Л –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ.
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Л—Е —Б—А–µ–і –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Є–Љ–µ–µ—В –і–≤–∞ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞: —В–∞–Ї–Є–µ —Б—А–µ–і—Л –Љ–Њ–≥—Г—В –±—Л—В—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ —В–Є–њ–∞ –Ї–ї–µ—В–Њ–Ї, –∞ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Њ–±–ї–µ–≥—З–∞–µ—В –≤—Л–і–µ–ї–µ–љ–Є–µ –Є–Ј —Б—А–µ–і—Л —В—А–µ–±—Г–µ–Љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –≤ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є –њ—А–Њ—Й–µ –Є, –Ї–∞–Ї –љ–Є —Б—В—А–∞–љ–љ–Њ, —З–∞—Б—В–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В—Б—П –љ–µ –±–Њ–ї–µ–µ –і–Њ—А–Њ–≥–Є–Љ, —Е–Њ—В—П, –Ї–Њ–љ–µ—З–љ–Њ, —В—А—Г–і–љ–µ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П. –Ф–≤–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –њ—А–Є—З–Є–љ—Л –≤—Б–µ –µ—Й–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–µ—Б—Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л—Е —Б—А–µ–і:
1) –Њ—З–µ–љ—М –Љ–µ–і–ї–µ–љ–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –≤—Л–њ—Г—Б–Ї –Ї–Њ–Љ–Љ–µ—А—З–µ—Б–Ї–Є—Е –Є–љ–≥—А–µ–і–Є–µ–љ—В–Њ–≤ —В–∞–Ї–Є—Е —Б—А–µ–і (–љ–µ –Љ–љ–Њ–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є —Б–њ–Њ—Б–Њ–±–љ—Л –Є–Ј–≥–Њ—В–Њ–≤–ї—П—В—М —Б—А–µ–і—Л —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ–Є —Б–Є–ї–∞–Љ–Є),
2) –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –±–µ—Б—Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–є —Б—А–µ–і–µ –≤ –±–Њ–ї—М—И–µ–є —Б—В–µ–њ–µ–љ–Є –Ј–∞–≤–Є—Б—П—В –Њ—В —В–Є–њ–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –Ї–ї–µ—В–Њ–Ї.
–°—Л–≤–Њ—А–Њ—В–Ї–∞ –љ–Є–≤–µ–ї–Є—А—Г–µ—В –Љ–љ–Њ–≥–Є–µ –љ–µ–і–Њ—Б—В–∞—В–Ї–Є —Б—А–µ–і—Л, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –њ—А–Њ—П–≤–ї—П—В—М—Б—П –≤ –µ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ. –Я—А–Њ–±–ї–µ–Љ–∞ –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –Њ—Б–Њ–±–µ–љ–љ–Њ –Њ—Б—В—А–Њ–є –њ—А–Є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–Є –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї; –і–ї—П –Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–љ–Є–є, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –Є–Ј —А–∞–Ј–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є, –Љ–Њ–ґ–µ—В —В—А–µ–±–Њ–≤–∞—В—М—Б—П –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–є —Б—А–µ–і—Л.
–У–∞–Ј–Њ–≤–∞—П —Д–∞–Ј–∞
–°–Њ—Б—В–∞–≤ –≥–∞–Ј–Њ–≤–Њ–є —Д–∞–Ј—Л –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В—А–µ–Љ—П —Д–∞–Ї—В–Њ—А–∞–Љ–Є:
1) —В–Є–њ–Њ–Љ —Б—А–µ–і—Л;
2) –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Њ—В–Ї—А—Л—В—Л—Е (—З–∞—И–Ї–Є –Я–µ—В—А–Є, –Љ–љ–Њ–≥–Њ–ї—Г–љ–Њ—З–љ—Л–µ —З–∞—И–Ї–Є) –Є–ї–Є –Ј–∞–Ї—Г–њ–Њ—А–µ–љ–љ—Л—Е (—Д–ї–∞–Ї–Њ–љ—Л, –±—Г—В—Л–ї–Ї–Є) –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤;
3) —В—А–µ–±—Г–µ–Љ–Њ–є –±—Г—Д–µ—А–љ–Њ–є –µ–Љ–Ї–Њ—Б—В—М—О.
–Э–µ–Ї–Њ—В–Њ—А—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Љ–Њ–≥—Г—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М, –љ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б–Њ–±–ї—О–і–∞—В—М –Њ–і–љ–Њ –≥–ї–∞–≤–љ–Њ–µ –њ—А–∞–≤–Є–ї–Њ вАФ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –≥–Є–і—А–Њ–Ї–∞—А–±–Њ–љ–∞—В–∞ –Є –њ–∞—А—Ж–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ —Г–≥–ї–µ–Ї–Є—Б–ї–Њ–≥–Њ –≥–∞–Ј–∞ –і–Њ–ї–ґ–љ—Л –љ–∞—Е–Њ–і–Є—В—М—Б—П –≤ —А–∞–≤–љ–Њ–≤–µ—Б–Є–Є.
–°—Г–±—Б—В—А–∞—В
–Я—А–Є—А–Њ–і–∞ —Б—Г–±—Б—В—А–∞—В–∞ –Ј–∞–≤–Є—Б–Є—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Њ—В —В–Є–њ–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є —Е–∞—А–∞–Ї—В–µ—А–∞ –њ—А–Њ–≤–Њ–і–Є–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –Я–Њ—З—В–Є –њ–Њ–≤—Б–µ–Љ–µ—Б—В–љ–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї –њ–Њ–ї–Є—Б—В–Є—А–Њ–ї, –Њ–±—А–∞–±–Њ—В–∞–љ–љ—Л–є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —З—В–Њ–±—Л —Г–≤–µ–ї–Є—З–Є—В—М —Б–Љ–∞—З–Є–≤–∞–µ–Љ–Њ—Б—В—М –Є –њ—А–Є–і–∞—В—М –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–є –Ј–∞—А—П–і. –Т –Њ—Б–Њ–±—Л—Е —Б–ї—Г—З–∞—П—Е (–Ї—Г–ї—М—В—Г—А—Л –љ–µ–є—А–Њ–љ–Њ–≤, –Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Ї—Г–ї—М—В—Г—А—Л —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Њ–Ї) –њ–ї–∞—Б—В–Є–Ї–Њ–≤—Г—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –њ–Њ–Ї—А—Л–≤–∞—О—В –ґ–µ–ї–∞—В–Є–љ–Њ–Љ, –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–Љ –Є–ї–Є –њ–Њ–ї–Є–ї–Є–Ј–Є–љ–Њ–Љ –і–ї—П –њ—А–Є–і–∞–љ–Є—П –µ–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ј–∞—А—П–і–∞. –Ь–Њ–ґ–µ—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–∞ –Є —Б—В–µ–Ї–ї—П–љ–љ–∞—П –њ–Њ—Б—Г–і–∞, –љ–Њ –Њ–љ–∞ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М —В—Й–∞—В–µ–ї—М–љ–Њ –≤—Л–Љ—Л—В–∞ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –љ–µ—В–Њ–Ї—Б–Є—З–љ—Л—Е –і–µ—В–µ—А–≥–µ–љ—В–Њ–≤. –Ъ—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–µ —Б–Њ—Б—Г–і—Л —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —А–∞–Ј–Љ–µ—А—Г вАФ –Њ—В –Љ–љ–Њ–≥–Њ–ї—Г–љ–Њ—З–љ—Л—Е –њ–ї–∞—Б—В–Є–љ–Њ–Ї –Ґ–µ—А–∞—Б–Ї–Є (–њ–ї–Њ—Й–∞–і—М –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є вАФ 1 –Љ–Љ2, –Њ–±—К–µ–Љ —Б—А–µ–і—Л 5вАФ10 –Љ–Ї–ї) –Є –Љ–Є–Ї—А–Њ—В–Є—В—А–Њ–≤–∞–ї—М–љ—Л—Е –њ–ї–∞—Б—В–Є–љ–Њ–Ї (–њ—А–Є–Љ–µ—А–љ–Њ 30 –Љ–Љ3/100-200 –Љ–Ї–ї) –і–Њ –љ–∞–±–Њ—А–∞ —З–∞—И–µ–Ї –Є —Д–ї–∞–Ї–Њ–љ–Њ–≤ —Б –њ–ї–Њ—Й–∞–і—М—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –і–Њ 180 —Б–Љ2 –Є –≤—А–∞—Й–∞—О—Й–Є—Е—Б—П –±—Г—В—Л–ї–µ–є. –Ю–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є –њ—А–Є –≤—Л–±–Њ—А–µ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—Г–і—Л —П–≤–ї—П—О—В—Б—П —В—А–µ–±—Г–µ–Љ–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–ї–µ—В–Њ–Ї (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —В—А–∞–љ—Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї—Г–ї—М—В—Г—А 5*104 - 5*105 –Ї–ї–µ—В–Њ–Ї/—Б–Љ2). –І–∞—И–Ї–Є —Б 24 –ї—Г–љ–Ї–∞–Љ–Є —Г–і–Њ–±–љ—Л –њ—А–Є –±–Њ–ї—М—И–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ–∞—А–∞–ї–ї–µ–ї–µ–є –Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –Њ—В–±–Њ—А–µ –Њ–±—А–∞–Ј—Ж–Њ–≤, –љ–Њ –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Њ—В–±–Њ—А –Њ–±—А–∞–Ј—Ж–Њ–≤ –њ—А–Њ–≤–Њ–і—П—В –≤ —А–∞–Ј–љ–Њ–µ –≤—А–µ–Љ—П, –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–µ —Д–ї–∞–Ї–Њ–љ—Л –Є–ї–Є –±—Г—В—Л–ї–Є. –І–∞—И–Ї–Є –Я–µ—В—А–Є –і–µ—И–µ–≤–ї–µ —Д–ї–∞–Ї–Њ–љ–Њ–≤ –Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Г–і–Њ–±–љ—Л –і–ї—П –Є—Б—Б–ї–µ–і—Г—О—Й–µ–є –Њ–±—А–∞–±–Њ—В–Ї–Є –Ї–ї–µ—В–Њ–Ї, –љ–∞–њ—А–Є–Љ–µ—А –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Є–ї–Є —Н–Ї—Б—В—А–∞–Ї—Ж–Є–Є. –§–ї–∞–Ї–Њ–љ—Л –Љ–Њ–≥—Г—В –±—Л—В—М –≥–µ—А–Љ–µ—В–Є—З–љ–Њ –Ј–∞–Ї—А—Л—В—Л, –њ—А–Є —Н—В–Њ–Љ –љ–µ —В—А–µ–±—Г–µ—В—Б—П –Є–љ–Ї—Г–±–∞—В–Њ—А —Б –њ—А–Њ–і—Г–≤–Ї–Њ–є —Г–≥–ї–µ–Ї–Є—Б–ї—Л–Љ –≥–∞–Ј–Њ–Љ, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Д–ї–∞–Ї–Њ–љ–Њ–≤ —Б–љ–Є–ґ–∞–µ—В—Б—П –Њ–њ–∞—Б–љ–Њ—Б—В—М –Ј–∞—А–∞–ґ–µ–љ–Є—П –Ї—Г–ї—М—В—Г—А. –Т —Б–ї—Г—З–∞–µ —Б—Г—Б–њ–µ–љ–Ј–Є–Њ–љ–љ—Л—Е –Ї—Г–ї—М—В—Г—А –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —П–≤–ї—П–µ—В—Б—П –Њ–±—К–µ–Љ —Б–Њ—Б—Г–і–∞. –Я—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є –Њ–±—К–µ–Љ–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–∞—В—А—Г–і–љ–µ–љ–Њ –њ–µ—А–µ–Љ–µ—И–Є–≤–∞–љ–Є–µ –Є —Г—Е—Г–і—И–Є—В—М—Б—П –∞—Н—А–∞—Ж–Є—П –Ї—Г–ї—М—В—Г—А.
–Я–Њ–і–≥–Њ—В–Њ–≤–Ї–∞
–Т–Њ –Љ–љ–Њ–≥–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є—П—Е –і–ї—П –Ї—Г–ї—М—В—Г—А —В–Ї–∞–љ–µ–є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –њ–ї–∞—Б—В–Љ–∞—Б—Б–Њ–≤—Г—О –њ–Њ—Б—Г–і—Г –Њ–і–љ–Њ—А–∞–Ј–Њ–≤–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П. –≠—В–Є —Б–Њ—Б—Г–і—Л –Њ–њ—В–Є—З–µ—Б–Ї–Є –њ—А–Њ–Ј—А–∞—З–љ—Л –Є –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ—Л –і–ї—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–Є —В–Ї–∞–љ–µ–є –њ—Г—В–µ–Љ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –њ–ї–∞—Б—В–Є–Ї–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞—О—Й–µ–є –µ–≥–Њ —Б–Љ–∞—З–Є–≤–∞–µ–Љ–Њ—Б—В—М –Є –Њ–±–ї–µ–≥—З–∞—О—Й–µ–є –њ—А–Є–Ї—А–µ–њ–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–µ —Б–Њ—Б—Г–і—Л –≤—Л–њ—Г—Б–Ї–∞—О—В —Г–ґ–µ —Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ–Є. –Т —Ж–µ–ї–Њ–Љ –њ–ї–∞—Б—В–Љ–∞—Б—Б–Њ–≤—Г—О –њ–Њ—Б—Г–і—Г —Г–і–Њ–±–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –Є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –≤—Л—А–∞—Й–Є–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї, –Є –і–ї—П —А–µ—И–µ–љ–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Ј–∞–і–∞—З, –Њ–і–љ–∞–Ї–Њ –Њ–і–љ–Њ—А–∞–Ј–Њ–≤–∞—П –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–∞—П –њ–Њ—Б—Г–і–∞ –і–Њ—А–Њ–≥–∞—П.
–Ь—Л—В—М–µ —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—Г–і—Л
–Ф–ї—П –њ–∞—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ—Б—В–Њ—П–љ–љ—Л—Е –Є –Љ–љ–Њ–≥–Є—Е –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л—Е, –ї–Є–љ–Є–є –Ї–ї–µ—В–Њ–Ї –њ–Њ–і—Е–Њ–і–Є—В —Б—В–µ–Ї–ї—П–љ–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–∞—П –њ–Њ—Б—Г–і–∞, –µ—Б–ї–Є –µ—Б—В—М —Г—Б–ї–Њ–≤–Є—П –і–ї—П –Љ—Л—В—М—П –њ–Њ—Б—Г–і—Л –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Ї–Њ–љ—В—А–Њ–ї—П –µ–≥–Њ –Ї–∞—З–µ—Б—В–≤–∞. –Я–Њ—Б—Г–і—Г –љ—Г–ґ–љ–Њ –≤—Л–і–µ—А–ґ–∞—В—М –≤ —А–∞—Б—В–≤–Њ—А–µ –љ–µ—В–Њ–Ї—Б–Є—З–љ–Њ–≥–Њ –і–µ—В–µ—А–≥–µ–љ—В–∞, –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ –љ–Њ—З–Є –Є –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —В—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л—В—М –њ—А–Њ—В–Њ—З–љ–Њ–є, –∞ –Ј–∞—В–µ–Љ –і–µ–Є–Њ–љ–Є–Ј–Њ–≤–∞–љ–љ–Њ–є –Є–ї–Є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є.
–°—В–µ—А–Є–ї–Є–Ј–∞—Ж–Є—П —Б—В–µ–Ї–ї—П–љ–љ–Њ–є –њ–Њ—Б—Г–і—Л
–Я–ї–∞—Б—В–Є–Ї–Њ–≤–∞—П –њ–Њ—Б—Г–і–∞ –њ–Њ—Б—В—Г–њ–∞–µ—В —Б—В–µ—А–Є–ї—М–љ–Њ–є, –∞ —Б—В–µ–Ї–ї—П–љ–љ—Г—О –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Г—О –њ–Њ—Б—Г–і—Г –њ–µ—А–µ–і –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ—Б—В–µ—А–Є–ї–Є–Ј–Њ–≤–∞—В—М. –Т–Њ –Љ–љ–Њ–≥–Є—Е –ї–∞–±–Њ—А–∞—В–Њ—А–Є—П—Е –њ—А–Њ–≤–Њ–і—П—В –Љ–∞—Б—Б–Њ–≤—Г—О —Б—В–µ—А–Є–ї–Є–Ј–∞—Ж–Є—О –≤—Б–µ–є –њ–Њ—Б—Г–і—Л –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –µ–µ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –і–ї—П –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –Њ—И–Є–±–Њ–Ї –њ—А–Є –≤—Л–±–Њ—А–µ –њ–Њ—Б—Г–і—Л. –°—В–µ—А–Є–ї–Є–Ј–∞—Ж–Є—О –ї—Г—З—И–µ –њ—А–Њ–≤–Њ–і–Є—В—М –≤ —Б—Г—Е–Њ–ґ–∞—А–Њ–≤–Њ–Љ —Б—В–µ—А–Є–ї–Є–Ј–∞—В–Њ—А–µ (1600–° –≤ —В–µ—З–µ–љ–Є–µ 1 —З), –њ–Њ–Љ–µ—Й–∞—П –њ–Њ—Б—Г–і—Г –≤ –Ї–Њ–љ—В–µ–є–љ–µ—А—Л –Є–ї–Є –Ј–∞–≤–Њ—А–∞—З–Є–≤–∞—П –≤ —Д–Њ–ї—М–≥—Г. –Ч–∞–≤–Є–љ—З–Є–≤–∞—О—Й–Є–µ—Б—П –Ї—А—Л—И–Ї–Є —Б–Њ—Б—Г–і–Њ–≤ —Б—В–µ—А–Є–ї–Є–Ј—Г—О—В –Њ—В–і–µ–ї—М–љ–Њ. –Ъ–∞—З–µ—Б—В–≤–Њ –њ–Њ—Б—Г–і—Л, –њ—А–Њ—Ж–µ—Б—Б –µ—С –Љ—Л—В—М—П –Є –≤—Л–±–Њ—А –і–µ—В–µ—А–≥–µ–љ—В–∞ —Б–ї–µ–і—Г–µ—В –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М. –Ф–ї—П —Н—В–Њ–≥–Њ –њ—А–Њ–Љ—Л–≤–∞—О—В –њ–Њ—Б—Г–і—Г –Њ–±—Л—З–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ—Ж–µ–љ–Є–≤–∞—О—В —З–Є—Б—В–Њ—В—Г –≤–Є–Ј—Г–∞–ї—М–љ–Њ, –≤—Л—Б—Г—И–Є–≤–∞—О—В, —Б—В–µ—А–Є–ї–Є–Ј—Г—О—В –Є –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –і–ї—П –Ї–ї–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї –≤ –Љ–Њ–љ–Њ—Б–ї–Њ–µ, –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–Њ –њ—А–Є –љ–Є–Ј–Ї–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—Л–≤–Њ—А–Њ—В–Ї–Є (2 вАФ 5 %) –Є–ї–Є –≤ –µ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ.
–Я–µ—А–≤–Є—З–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞
–Я–µ—А–≤–Є—З–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞ –ї–Є—И–µ–љ–∞ –Љ–љ–Њ–≥–Є—Е –Ї–ї–µ—В–Њ–Ї, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є—Е –≤ –Є—Б—Е–Њ–і–љ–Њ–є —В–Ї–∞–љ–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ –≤—Б—С –Ї–ї–µ—В–Ї–Є —Б–њ–Њ—Б–Њ–±–љ—Л –њ—А–Є–Ї—А–µ–њ–Є—В—М—Б—П –Ї —Б—Г–±—Б—В—А–∞—В—Г –Є –≤—Л–ґ–Є—В—М –≤ —Г—Б–ї–Њ–≤–Є—П—Е in vitro. –Я—А–Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Ї—Г–ї—М—В–Є–≤–Є—А—Г–µ–Љ—Л—Е –Ї–ї–µ—В–Њ–Ї –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ –Њ–±–µ–і–љ–µ–љ–Є–µ –Ї—Г–ї—М—В—Г—А—Л –љ–µ–і–µ–ї—П—Й–Є–Љ–Є—Б—П –Є–ї–Є –Љ–µ–і–ї–µ–љ–љ–Њ –і–µ–ї—П—Й–Є–Љ–Є—Б—П –Ї–ї–µ—В–Ї–∞–Љ–Є, –њ–Њ—Н—В–Њ–Љ—Г –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –Њ—В–±–Њ—А —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —В–Є–њ–Њ–≤ –Ї–ї–µ—В–Њ–Ї –њ—Г—В–µ–Љ –Ї–ї–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П, —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Є–ї–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј–і–µ–ї–µ–љ–Є—П –Ї–ї–µ—В–Њ–Ї.
–Э–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –њ–Њ–ї—Г—З–µ–љ–Є—П –њ–µ—А–≤–Є—З–љ–Њ–є –Ї—Г–ї—М—В—Г—А—Л —Г–і–∞–ї—П—О—В —Д—А–∞–≥–Љ–µ–љ—В —В–Ї–∞–љ–Є –ґ–Є–≤–Њ—В–љ–Њ–≥–Њ –≤ —Б—В–µ—А–Є–ї—М–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е –Є –њ–Њ–і–≤–µ—А–≥–∞—О—В –µ–≥–Њ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–є –Є–ї–Є —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є –і–µ–Ј–∞–≥—А–µ–≥–∞—Ж–Є–Є. –Ґ–Ї–∞–љ—М –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Њ—Б—В–Њ –Є–Ј–Љ–µ–ї—М—З–µ–љ–∞ –і–Њ –Ї—Г—Б–Њ—З–Ї–Њ–≤ –Њ–±—К–µ–Љ–Њ–Љ –Њ–Ї–Њ–ї–Њ 1 –Љ–Љ3, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–Ї—А–µ–њ–ї—П—О—В—Б—П –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —З–∞—И–Ї–Є –±–ї–∞–≥–Њ–і–∞—А—П —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–є –∞–і–≥–µ–Ј–Є–≤–љ–Њ—Б—В–Є, –љ–∞–ї–Є—З–Є—О –љ–∞—Б–µ—З–µ–Ї –љ–∞ —З–∞—И–Ї–µ –Є–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О —Б–≥—Г—Б—В–Ї–∞ –њ–ї–∞–Ј–Љ—Л. –Т —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —А–Њ—Б—В –Ї–ї–µ—В–Њ–Ї –Є–Ј —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ –Є –Ї–ї–µ—В–Ї–Є, –Љ–Є–≥—А–Є—А—Г—О—Й–Є–µ –Є–Ј —Н–Ї—Б–њ–ї–∞–љ—В–∞—В–Њ–≤, –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –і–ї—П –њ–∞—Б—Б–Є—А–Њ–≤–∞–љ–Є—П. –§—А–∞–≥–Љ–µ–љ—В—Л —В–Ї–∞–љ–Є (—Н–Ї—Б–њ–ї–∞–љ—В–∞—В—Л –Љ–Њ–ґ–љ–Њ –њ–µ—А–µ–љ–Њ—Б–Є—В—М –≤ –љ–Њ–≤—Л–µ —З–∞—И–Ї–Є) –Є –Љ–Є–≥—А–Є—А—Г—О—Й–Є–µ –Ї–ї–µ—В–Ї–Є –Љ–Њ–ґ–љ–Њ —Г–і–∞–ї–Є—В—М –њ—Г—В–µ–Љ —В—А–Є–њ—Б–Є–љ–Є–Ј–∞—Ж–Є–Є, –∞, –Њ—Б—В–∞—О—Й–Є–є—Б—П —Н–Ї—Б–њ–ї–∞–љ—В–∞—В –Њ–±—А–∞–Ј—Г–µ—В –љ–Њ–≤—Л–µ –≤—Л—А–Њ—Б—В—Л. –Ґ—А–Є–њ—Б–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—А–µ—Б–µ–≤–∞—О—В –≤ –љ–Њ–≤—Л–µ —Б–Њ—Б—Г–і—Л, –Є –Њ–љ–Є —Б—В–∞–љ–Њ–≤—П—В—Б—П –≤—В–Њ—А–Є—З–љ–Њ–є –Ї—Г–ї—М—В—Г—А–Њ–є. –Я–Њ —Д–Њ—А–Љ–∞–ї—М–љ—Л–Љ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ —В–∞–Ї—Г—О –Ї—Г–ї—М—В—Г—А—Г –љ–∞–Ј—Л–≤–∞—О—В ¬Ђ–ї–Є–љ–Є–µ–є –Ї–ї–µ—В–Њ–Ї¬ї.
–Я–µ—А–≤–Є—З–љ—Л–µ –Ї—Г–ї—М—В—Г—А—Л –Љ–Њ–≥—Г—В –±—Л—В—М —В–∞–Ї–ґ–µ –њ–Њ–ї—Г—З–µ–љ—Л –њ—Г—В–µ–Љ –і–µ–Ј–∞–≥—А–µ–≥–∞—Ж–Є–Є —В–Ї–∞–љ–µ–є —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є, –љ–∞–њ—А–Є–Љ–µ—А —В—А–Є–њ—Б–Є–љ–Њ–Љ (0,25% –љ–µ–Њ—З–Є—Й–µ–љ–љ—Л–є –Є–ї–Є 0,01-0,05 % –Њ—З–Є—Й–µ–љ–љ—Л–є) –Є–ї–Є –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј–Њ–є (200-2000 –Х–Ф/–Љ–ї, –љ–µ–Њ—З–Є—Й–µ–љ–љ–∞—П). –Ъ–ї–µ—В–Ї–Є –Њ–±—А–∞–Ј—Г—О—Й–µ–є—Б—П –њ—А–Є —Н—В–Њ–Љ —Б—Г—Б–њ–µ–љ–Ј–Є–Є –Њ—Б–µ–і–∞—О—В, –њ—А–Є–Ї—А–µ–њ–ї—П—О—В—Б—П –Ї –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —Б—В–µ–Ї–ї–∞ –Є–ї–Є –њ–ї–∞—Б—В–Є–Ї–∞ –Є —А–∞—Б–њ–ї–∞—Б—В—Л–≤–∞—О—В—Б—П –љ–∞ –љ–µ–є. –Ґ–∞–Ї–Њ–є —Б–њ–Њ—Б–Њ–± –њ–Њ–ї—Г—З–µ–љ–Є—П –Ї—Г–ї—М—В—Г—А—Л –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є –≤—Л—Е–Њ–і –Ї–ї–µ—В–Њ–Ї, —Е–Њ—В—П –Њ–љ –Ї–∞–ґ–µ—В—Б—П –±–Њ–ї–µ–µ —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–Љ –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —В–Њ–ї—М–Ї–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –Ї–ї–µ—В–Ї–Є –њ–µ—А–µ–ґ–Є–≤–∞—О—В –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—О. –Э–∞ –њ—А–∞–Ї—В–Є–Ї–µ —Г—Б–њ–µ—И–љ–Њ–µ –њ–Њ–ї—Г—З–µ–љ–Є–µ –њ–µ—А–≤–Є—З–љ—Л—Е –Ї—Г–ї—М—В—Г—А –Є–Ј –Љ–љ–Њ–≥–Є—Е —В–Ї–∞–љ–µ–є, –Њ—Б–Њ–±–µ–љ–љ–Њ –Є–Ј —Н–њ–Є—В–µ–ї–Є—П, —Б–≤—П–Ј–∞–љ–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л, –њ—А–Є —Н—В–Њ–Љ —А–∞–Ј–Љ–µ—А —Н–Ї—Б–њ–ї–∞–љ—В–∞—В–∞ —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –і–Њ –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ –Ї–ї–∞—Б—В–µ—А–∞ –Ї–ї–µ—В–Њ–Ї, –Ї–Њ—В–Њ—А—Л–є –Ј–∞—В–µ–Љ –њ—А–Є–Ї—А–µ–њ–ї—П–µ—В—Б—П –Ї —Б—Г–±—Б—В—А–∞—В—Г –Є —А–∞–Ј—А–∞—Б—В–∞–µ—В—Б—П.
–°—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ
–Ь–Њ–љ–Њ—Б–ї–Њ–є–љ–∞—П –Ї—Г–ї—М—В—Г—А–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–µ—А–µ–љ–µ—Б–µ–љ–∞ –≤–Њ –≤—В–Њ—А–Њ–є –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–є —Б–Њ—Б—Г–і –њ–Њ—Б–ї–µ –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї –Љ–Њ–љ–Њ—Б–ї–Њ—П —В—А–Є–њ—Б–Є–љ–Њ–Љ –Є —А–∞–Ј–≤–µ–і–µ–љ–Є—П. –Т —Б–ї—Г—З–∞–µ —Б—Г–±–Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П —Б—Г—Б–њ–µ–љ–Ј–Є–Њ–љ–љ—Л—Е –Ї—Г–ї—М—В—Г—А –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —А–∞–Ј–≤–µ–і–µ–љ–Є—П. –Ф–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –Ї–ї–µ—В–Њ–Ї –Љ–Њ–љ–Њ—Б–ї–Њ–є–љ–Њ–є –Ї—Г–ї—М—В—Г—А—Л –ї—Г—З—И–µ –≤—Б–µ–≥–Њ –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П –њ—Г—В–µ–Љ –њ—А–Њ–Љ—Л–≤–∞–љ–Є—П –Љ–Њ–љ–Њ—Б–ї–Њ—П —Д–Њ—Б—Д–∞—В–љ—Л–Љ —Б–Њ–ї–µ–≤—Л–Љ .–±—Г—Д–µ—А–Њ–Љ (–§–°–С) –Є–ї–Є –§–°–С —Б 1 –Љ–Ь –≠–Ф–Ґ–Р –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –Є–љ–Ї—Г–±–∞—Ж–Є–Є —Б —Е–Њ–ї–Њ–і–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ —В—А–Є–њ—Б–Є–љ–∞ (0,25 % –љ–µ–Њ—З–Є—Й–µ–љ–љ—Л–є –Є–ї–Є 0,01вАФ0,05 % –Њ—З–Є—Й–µ–љ–љ—Л–є) –≤ —В–µ—З–µ–љ–Є–µ 30 —Б. –Я–Њ—Б–ї–µ —Н—В–Њ–≥–Њ —В—А–Є–њ—Б–Є–љ —Г–і–∞–ї—П—О—В, –Ъ–ї–µ—В–Ї–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Є–љ–Ї—Г–±–Є—А—Г—О—В –≤ —В–µ—З–µ–љ–Є–µ 15 –Љ–Є–љ. –Ч–∞—В–µ–Љ –Ї–ї–µ—В–Ї–Є —Б—Г—Б–њ–µ–љ–Ј–Є—А—Г—О—В –≤ —Б—А–µ–і–µ, –Њ–њ—А–µ–і–µ–ї—П—О—В –Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Є —А–∞—Б—Б–µ–≤–∞—О—В –≤ –љ–Њ–≤—Л–µ —Д–ї–∞–Ї–Њ–љ—Л.
–Ъ—А–Є–≤–∞—П —А–Њ—Б—В–∞
–Я–Њ—Б–ї–µ –њ–Њ—Б–µ–≤–∞ –Ї–ї–µ—В–Њ–Ї –≤–Њ —Д–ї–∞–Ї–Њ–љ –Њ–љ–Є –≤—Е–Њ–і—П—В –≤ –ї–∞–≥-–њ–µ—А–Є–Њ–і –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 2вАФ24 —З, —Б–Љ–µ–љ—П—О—Й–Є–є—Б—П –њ–µ—А–Є–Њ–і–Њ–Љ —Н–Ї—Б–њ–Њ–љ–µ–љ—Ж–Є–∞–ї—М–љ–Њ–≥–Њ —А–Њ—Б—В–∞ (–ї–Њ–≥–∞—А–Є—Д–Љ–Є—З–µ—Б–Ї–∞—П —Д–∞–Ј–∞). –Т –Ї–Њ–љ—Ж–µ —Н—В–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –Ї–ї–µ—В–Ї–Є –і–Њ—Б—В–Є–≥–∞—О—В –њ–ї–Њ—В–љ–Њ–≥–Њ –Љ–Њ–љ–Њ—Б–ї–Њ—П –Є –≤—Е–Њ–і—П—В –≤ –њ–µ—А–Є–Њ–і –Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ —А–Њ—Б—В–∞ –Є–ї–Є –њ–Њ–Ї–Њ—П (—Д–∞–Ј–∞ –њ–ї–∞—В–Њ). –≠—В–Є —Д–∞–Ј—Л —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –≤—Б–µ—Е –Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–љ–Є–є –Є –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ–Њ–ї—Г—З–Є—В—М –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–љ–Є–Є: –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –ї–∞–≥-–њ–µ—А–Є–Њ–і–∞, –≤—А–µ–Љ—П —Г–і–≤–Њ–µ–љ–Є—П –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ —Б–µ—А–µ–і–Є–љ–µ –ї–Њ–≥–∞—А–Є—Д–Љ–Є—З–µ—Б–Ї–Њ–є —Д–∞–Ј—Л –Є –љ–∞—Б—Л—Й–∞—О—Й—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М –Ї–ї–µ—В–Њ–Ї –≤ –Љ–Њ–љ–Њ—Б–ї–Њ–µ –≤ —Д–∞–Ј–µ –њ–ї–∞—В–Њ. –Т–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ–Њ—Б—В—М —Н—В–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ —В–Њ–ї—М–Ї–Њ –њ—А–Є –њ–Њ—Б—В–Њ—П–љ—Б—В–≤–µ —Г—Б–ї–Њ–≤–Є–є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П.
–Ю–њ—А–µ–і–µ–ї–µ–љ–Є–µ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ —А–Њ—Б—В–Њ–≤–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –≤–∞–ґ–љ–Њ –і–ї—П –њ–∞—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ї—Г–ї—М—В—Г—А—Л –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –љ–∞ –Ї—Г–ї—М—В—Г—А–∞—Е. –Я–Њ–≤–µ–і–µ–љ–Є–µ –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –Ї–ї–µ—В–Њ–Ї –Ј–∞–Љ–µ—В–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –≤ —А–∞–Ј–љ—Л–µ —Д–∞–Ј—Л —А–Њ—Б—В–∞ –Ї—Г–ї—М—В—Г—А—Л, —В–∞–Ї —З—В–Њ –≤–∞–ґ–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Б—В–∞–і–Є—О —А–Њ—Б—В–Њ–≤–Њ–≥–Њ —Ж–Є–Ї–ї–∞, –≤ –Ї–Њ—В–Њ—А–Њ–є –≤ –Ї—Г–ї—М—В—Г—А—Г –і–Њ–±–∞–≤–ї—П—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –ї–Є–±–Њ —А–µ–∞–≥–µ–љ—В—Л –Є–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М —Б–±–Њ—А –Ї–ї–µ—В–Њ–Ї –і–ї—П –њ–µ—А–µ—Б–µ–≤–∞. –§–Њ—А–Љ–∞ –Ї—А–Є–≤–Њ–є —А–Њ—Б—В–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —В–∞–Ї–ґ–µ –њ–Њ–ї—Г—З–Є—В—М –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї–µ –Ї—Г–ї—М—В—Г—А—Л. –Э–µ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Њ–Љ–љ–µ–љ–Є—П —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Ї–ї–Њ–љ–∞–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ—Б—В –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –±–Њ–ї–µ–µ –Њ–і–љ–Њ–Ј–љ–∞—З–љ—Л–µ –Є –њ—А–∞–≤–Є–ї—М–љ—Л–µ –≤—Л–≤–Њ–і–∞.
–Ч–∞—А–∞–ґ–µ–љ–Є–µ –Ї—Г–ї—М—В—Г—А—Л –Ї–ї–µ—В–Њ–Ї
–Ю–њ–∞—Б–љ–Њ—Б—В—М –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П –Ї—Г–ї—М—В—Г—А –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –Љ–µ—А–µ —Б–љ–Є–ґ–∞–µ—В—Б—П –±–ї–∞–≥–Њ–і–∞—А—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ –Є –ї–∞–Љ–Є–љ–∞—А–љ—Л—Е –±–Њ–Ї—Б–Њ–≤. –Ю–і–љ–∞–Ї–Њ —Б–ї–µ–і—Г–µ—В –њ–Њ –Љ–µ—А–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є–Ј–±–µ–≥–∞—В—М –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є—П –Ї–ї–µ—В–Њ–Ї —Б –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–∞–Љ–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Њ–±–ї–µ–Љ–∞ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–∞—В–µ–љ—В–љ–Њ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П –≤—Б–µ –µ—Й–µ –Њ—Б—В–∞–µ—В—Б—П –Њ—Б—В—А–Њ–є.
–°–ї–µ–і—Г–µ—В –Ї–∞–Ї –Љ–Њ–ґ–љ–Њ —З–∞—Й–µ –њ—А–Њ–≤–Њ–і–Є—В—М –≤–Є–Ј—Г–∞–ї—М–љ—Г—О) –Њ—Ж–µ–љ–Ї—Г –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ –Ј–∞—А–∞–ґ–µ–љ–Є—П –Ї—Г–ї—М—В—Г—А—Л –њ–Њ –±—Л—Б—В—А–Њ–Љ—Г –Є–Ј–Љ–µ–љ–µ–љ–Є—О —А–Э. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Ј–∞—А–∞–ґ–µ–љ–Є–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —А–Э, —Е–Њ—В—П –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≥—А–Є–±—Л –Љ–Њ–≥—Г—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Э. –Ч–∞—А–∞–ґ–µ–љ–Є–µ –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є —В–∞–Ї–ґ–µ –Ї –њ–Њ–Љ—Г—В–љ–µ–љ–Є—О —Б—А–µ–і—Л, –њ–Њ—П–≤–ї–µ–љ–Є—О –Љ–µ–ґ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –≥—А–∞–љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞, –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ–Љ–Њ–≥–Њ –њ—А–Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –Є –≤–Ј–≤–µ—И–µ–љ–љ–Њ–≥–Њ –≤ —Б—А–µ–і–µ –љ–µ–Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞. –Т–Њ –≤—Б–µ—Е —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–µ —Б–Њ—Б—Г–і—Л –Є–Ј–Њ–ї–Є—А—Г—О—В, –љ–µ –≤—Л–љ–Є–Љ–∞—П –њ—А–Њ–±–Ї–Є, –Є –∞–≤—В–Њ–Ї–ї–∞–≤–Є—А—Г—О—В.
–Ш—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –Ј–∞—А–∞–ґ–µ–љ–Є—П –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–Њ–є –њ—А–Є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–Є –Ї–ї–µ—В–Њ–Ї –Љ–Њ–≥—Г—В –±—Л—В—М –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–∞—П —Б—А–µ–і–∞, —Б—Л–≤–Њ—А–Њ—В–Ї–∞, —В—А–Є–њ—Б–Є–љ –Є–ї–Є —Б–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М. –Ч–∞—А–∞–ґ–µ–љ–Є–µ –љ–µ –≤—Л—П–≤–ї—П–µ—В—Б—П –≤–Є–Ј—Г–∞–ї—М–љ–Њ, –Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ–љ–Њ –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—О —А–Њ—Б—В–∞ –Ї—Г–ї—М—В—Г—А—Л, –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ–Њ–є —З–∞—Б—В–Њ –Њ—Б—В–∞—С—В—Б—П –љ–µ–Ј–∞–Љ–µ—З–µ–љ–љ—Л–Љ. –°–ї–µ–і—Г–µ—В —А–µ–≥—Г–ї—П—А–љ–Њ (–Њ–і–Є–љ —А–∞–Ј –≤ 1 вАФ 3 –Љ–µ—Б.) –њ—А–Њ–≤–µ—А—П—В—М –Ї—Г–ї—М—В—Г—А—Л –љ–∞ –љ–∞–ї–Є—З–Є–µ –≤ –љ–Є—Е –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —В–∞–Ї–Њ–µ –Ј–∞—А–∞–ґ–µ–љ–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Є–Ј–Љ–µ–љ—П–µ—В –±–Є–Њ—Е–Є–Љ–Є—О –Ї–ї–µ—В–Њ–Ї, –Є—Е –∞–љ—В–Є–≥–µ–љ–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –Є –њ–∞—А–∞–Љ–µ—В—А—Л —А–Њ—Б—В–∞ –Ї—Г–ї—М—В—Г—А—Л. –Я—А–µ–і–ї–Њ–ґ–µ–љ–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–µ—В–Њ–і–Њ–≤ –≤—Л—П–≤–ї–µ–љ–Є—П –Љ–Є–Ї–Њ–њ–ї–∞–Ј–Љ, –љ–Њ –љ–∞–Є–±–Њ–ї—М—И–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –њ–Њ–ї—Г—З–Є–ї –Љ–µ—В–Њ–і —Д–ї—О–Њ—А–µ—Б—Ж–µ–љ—В–љ–Њ–≥–Њ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –Ф–Э–Ъ –њ–Њ –Љ–µ—В–Њ–і—Г –І–µ–љ–∞.
–Я–Њ–ї—Г—З–µ–љ–Є–µ –Є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ —Н–њ–Є–і–µ—А–Љ–Њ—Ж–Є—В–Њ–≤
1. –Я–Њ–ї—Г—З–µ–љ–љ—Л–є –і–µ—А–Љ–∞—В–Њ–Љ–љ—Л–є —Б—А–µ–Ј –њ–Њ–Љ–µ—Й–∞—О—В –≤ –њ—А–Њ–±–Є—А–Ї—Г, —Б–Њ–і–µ—А–ґ–∞—Й—Г—О —Б—А–µ–і—Г –Ш–≥–ї–∞ + –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ (25.000 –Х–Ф/–Љ–ї) + —Б—В—А–µ–њ—В–Њ–Љ–Є—Ж–Є–љ (25.000 –Х–Ф/–Љ–ї) + —Д—Г–љ–≥–Є–Ј–Њ–љ (50 –Х–Ф/–Љ–ї),вАФ –і–Њ 24 —З –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ.
2. –Ю—В–Љ—Л–≤–∞—О—В –≤ —Б—А–µ–і–µ –Ш–≥–ї–∞ –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ —Б—А–µ–і–∞ –љ–µ —Б—В–∞–љ–µ—В –њ—А–Њ–Ј—А–∞—З–љ–Њ–є.
3. –Я–Њ–Љ–µ—Й–∞—О—В –≠–Ф–Ґ–Р –љ–∞ 20 –Љ–Є–љ –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ.
4. –Я–µ—А–µ–љ–Њ—Б—П—В –≤ —В—А–Є–њ—Б–Є–љ (0,05 % –Є–ї–Є 0,25 %) –љ–∞ 18 —З –њ—А–Є +4 ¬∞–°.
5. –§–µ—А–Љ–µ–љ—В —Б–ї–Є–≤–∞—О—В –Є –і–Њ–±–∞–≤–ї—П—О—В —Б—Л–≤–Њ—А–Њ—В–Ї—Г –і–ї—П –љ–µ–є—В—А–∞–ї–Є–Ј–∞—Ж–Є–Є —Д–µ—А–Љ–µ–љ—В–∞.
6. –Т—Л–і–µ–ї—П—О—В —Н–њ–Є–і–µ—А–Љ–Њ—Ж–Є—В—Л –≤ —З–∞—И–Ї–µ –Я–µ—В—А–Є –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ.
7. –¶–µ–љ—В—А–Є—Д—Г–≥–Є—А—Г—О—В –њ—А–Є 1000 –Њ–±/–Љ–Є–љ 5 –Љ–Є–љ.
8. –Ю—Б–∞–і–Њ–Ї —А–µ—Б—Г—Б–њ–µ–љ–і–Є—А—Г—О—В –≤ —Б—А–µ–і–µ –Ш–≥–ї–∞ (–±–µ–Ј Ca2+).
9. –°—Г—Б–њ–µ–љ–Ј–Є—О –Ї–ї–µ—В–Њ–Ї –≤–љ–Њ—Б—П—В –≤ –њ–ї–∞—Б—В–Љ–∞—Б—Б–Њ–≤—Л–µ, –њ–Њ–Ї—А—Л—В—Л–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–Љ –Є–ї–Є –≥–Є–і—А–Њ—Д–Є–ї—М–љ—Л–µ —З–∞—И–Ї–Є (–Є–Ј —А–∞—Б—З–µ—В–∞ –љ–µ –Љ–µ–љ–µ–µ 70 000 - 100 000 –љ–∞ 1 —Б–Љ2).
10. –°–Љ–µ–љ—П—О—В —Б—А–µ–і—Г 2 —А–∞–Ј–∞ –≤ –љ–µ–і–µ–ї—О –і–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Љ–Њ–љ–Њ—Б–ї–Њ—П.
–Я–Њ–ї—Г—З–µ–љ–Є–µ –Є –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ —Д–Є–±—А–Њ–±–ї–∞—Б—В–Њ–≤
1. –Ф–µ—А–Љ—Г –њ–Њ—Б–ї–µ —Г–і–∞–ї–µ–љ–Є—П —Н–њ–Є–і–µ—А–Љ–Є—Б–∞ –Є–Ј–Љ–µ–ї—М—З–∞—О—В –љ–Њ–ґ–љ–Є—Ж–∞–Љ–Є –≤ –њ–µ–љ–Є—Ж–Є–ї–ї–Є–љ–Њ–≤—Л–є —Д–ї–∞–Ї–Њ–љ.
2. –Ъ –≥–Њ–Љ–Њ–≥–µ–љ–∞—В—Г –і–Њ–±–∞–≤–ї—П—О—В —А–∞—Б—В–≤–Њ—А –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л (–≥–Њ—В–Њ–≤—П—В –љ–∞ —Б—А–µ–і, –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–ї–ї–∞–≥–µ–љ–∞–Ј—Л –Њ—В 0,28 –і–Њ 630 –Х–Ф/–Љ–ї) –Є –Є–љ–Ї—Г–±–Є—А—Г—О—В –≤ –љ–µ–Љ.
3. –§–µ—А–Љ–µ–љ—В –љ–µ–є—В—А–∞–ї–Є–Ј—Г—О—В –њ—Г—В–µ–Љ –і–Њ–±–∞–≤–ї–µ–љ–Є—П —Б—А–µ–і—Л —Б 10 % —Б—Л–≤–Њ—А–Њ—В–Ї–Є.
4. –¶–µ–љ—В—А–Є—Д—Г–≥–Є—А—Г—О—В –њ—А–Є 1000 –Њ–± /–Љ–Є–љ 5 –Љ–Є–љ.
5. –Ю—Б–∞–і–Њ–Ї —А–µ—Б—Г—Б–њ–µ–љ–і–Є—А—Г—О—В –≤ —Б—А–µ–і–µ (–Ш–≥–ї–∞ –Є –і—А. —Б –Њ–±—Л—З–љ—Л–Љ–Є –і–Њ–±–∞–≤–Ї–∞–Љ–Є).
6. –Я–Њ–і—Б—З–Є—В—Л–≤–∞—О—В –Ї–ї–µ—В–Ї–Є –≤ –Ї–∞–Љ–µ—А–µ –У–Њ—А—П–µ–≤–∞ (20.000 –Ї–ї–µ—В–Њ–Ї –љ–∞ 1—Б–Љ2).
7. –°—Г—Б–њ–µ–љ–Ј–Є—О –Ї–ї–µ—В–Њ–Ї –њ–µ—А–µ–љ–Њ—Б—П—В –≤ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ—Л–µ —З–∞—И–Ї–Є.
8. –°–Љ–µ–љ—П—О—В —Б—А–µ–і—Г –љ–∞ —Б–ї–µ–і—Г—О—Й–Є–є –і–µ–љ—М.
9. –Я—А–Њ–≤–Њ–і—П—В –і–∞–ї—М–љ–µ–є—И–µ–µ –Ї—Г–ї—М—В–Є–≤–Є—А–Њ–≤–∞–љ–Є–µ –і–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –Љ–Њ–љ–Њ—Б–ї–Њ—П.
–Т—Л–і–µ–ї–µ–љ–Є–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –Є –њ–Њ–Ї—А—Л—В–Є–µ –Є–Љ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї –і–ї—П —Г—Б–Ї–Њ—А–µ–љ–Є—П —А–Њ—Б—В–∞
–Ъ–Њ–ї–ї–∞–≥–µ–љ I —В–Є–њ–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–µ—В–Њ–і–∞, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ S. Strom –Є —Б–Њ–∞–≤—В. (1982), –Є–Ј —Б—Г—Е–Њ–ґ–Є–ї–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –њ–Њ–Ј–≤–Њ–љ–Ї–∞–Љ–Є —Е–≤–Њ—Б—В–∞ –Ї—А—Л—Б.
1. –†–∞–Ј—А–µ–Ј–∞—О—В —Б–≤–µ–ґ–µ–≤—Л–і–µ–ї–µ–љ–љ—Л–µ –Є–ї–Є –Ј–∞–Љ–Њ—А–Њ–ґ–µ–љ–љ—Л–µ –Є –Њ—В—В–∞—П–≤—И–Є–µ —Е–≤–Њ—Б—В—Л –њ—А–Њ–і–Њ–ї—М–љ–Њ –Њ—В –Њ—Б–љ–Њ–≤–∞–љ–Є—П –і–Њ –Ї–Њ–љ—Ж–∞.
2. –£–і–∞–ї—П—О—В –Ї–Њ–ґ—Г –Є –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л–µ —Б–Њ—Б—Г–і—Л.
3. –С–µ—А—Г—В –±–µ–ї—Л–µ –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Є —Б—В–µ—А–Є–ї–Є–Ј—Г—О—В –Є—Е —Б –њ–Њ–Љ–Њ—Й—М—О —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –Є–Ј–ї—Г—З–µ–љ–Є—П.
4. –Я–Њ–Љ–µ—Й–∞—О—В 1 –≥ –Ї–Њ–ї–ї–∞–≥–µ–љ–Њ–≤—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ (–Є–Ј 3 вАФ 4 —Е–≤–Њ—Б—В–Њ–≤) –≤ 300 –Љ–ї 0,1 –Ь —Г–Ї—Б—Г—Б–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –Њ—Б—В–∞–≤–ї—П—О—В –њ–µ—А–µ–Љ–µ—И–Є–≤–∞—В—М—Б—П –њ—А–Є 4 ¬∞–° –≤ —В–µ—З–µ–љ–Є–µ 48 —З.
5. –§–Є–ї—М—В—А—Г—О—В —А–∞—Б—В–≤–Њ—А —З–µ—А–µ–Ј 2 вАФ 3 —Б–ї–Њ—П —Б—В–µ—А–Є–ї—М–љ–Њ–є –Љ–∞—А–ї–Є.
6. –†–∞–Ј–≤–Њ–і—П—В –њ–Њ–ї—Г—З–µ–љ–љ—Л–є —А–∞—Б—В–≤–Њ—А –≤ 20 —А–∞–Ј –±–Є–і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є.
7. –Я–Њ–Ї—А—Л–≤–∞—О—В —А–∞—Б—В–≤–Њ—А–Њ–Љ –і–љ–Њ –њ–ї–∞—Б—В–Є–Ї–Њ–≤–Њ–є —З–∞—И–Ї–Є –Є –≤—Л—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ (1 вАФ 2 –і–љ—П –њ—А–Є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ, –љ–µ –њ—А–µ–≤—Л—И–∞—О—Й–µ–є 37 ¬∞–°). –І–∞—И–Ї–Є –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М –≤–Њ –≤–ї–∞–ґ–љ–Њ–є –∞—В–Љ–Њ—Б—Д–µ—А–µ –њ—А–Є 4 ¬∞–° –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Б—П—Ж–µ–≤.
–Ш—Б—Е–Њ–і–љ—Л–є –Љ–∞—В–Њ—З–љ—Л–є —А–∞—Б—В–≤–Њ—А –Ї–Њ–ї–ї–∞–≥–µ–љ–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —В–∞–Ї–ґ–µ –љ–µ–є—В—А–∞–ї–Є–Ј–Њ–≤–∞–љ –Є —А–∞–Ј–≤–µ–і–µ–љ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–є —Б—А–µ–і–Њ–є. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Ї–Њ–ї–ї–∞–≥–µ–љ –Њ–±—А–∞–Ј—Г–µ—В –≥–µ–ї—М –±–ї–∞–≥–Њ–і–∞—А—П –њ–Њ–≤—Л—И–µ–љ–Є—О —А–Э –Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б–Њ–ї–µ–є. –Ф–µ–љ–∞—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л–є (–≤—Л—Б—Г—И–µ–љ–љ—Л–є –љ–∞ –≤–Њ–Ј–і—Г—Е–µ) –Ї–Њ–ї–ї–∞–≥–µ–љ –Њ–±–ї–µ–≥—З–∞–µ—В –њ—А–Є–Ї—А–µ–њ–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ–Ї (–љ–∞–њ—А–Є–Љ–µ—А, –Ї–ї–µ—В–Њ–Ї —Н–љ–і–Њ—В–µ–ї–Є—П –Є —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж), –∞ –љ–∞—В–Є–≤–љ—Л–є (–љ–µ–і–µ–љ–∞—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л–є) –Ї–Њ–ї–ї–∞–≥–µ–љ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –і–ї—П –њ—А–∞–≤–Є–ї—М–љ–Њ–є —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є.
–Ю–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї —Д–Є–±—А–Њ–љ–µ–Ї—В–Є–љ–Њ–Љ –і–ї—П —Г—Б–Ї–Њ—А–µ–љ–Є—П –Є—Е —А–Њ—Б—В–∞
–§–Є–±—А–Њ–љ–µ–Ї—В–Є–љ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ–Њ–ї—Г—З–µ–љ —Б –њ–Њ–Љ–Њ—Й—М—О –Љ–µ—В–Њ–і–∞, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–≥–Њ –Т. Obrink (1982), –Є–Ј —Б–≤–µ–ґ–µ–є –њ–ї–∞–Ј–Љ—Л —З–µ–ї–Њ–≤–µ–Ї–∞, –љ–µ –Њ–±—А–∞–±–Њ—В–∞–љ–љ–Њ–є –≥–µ–њ–∞—А–Є–љ–Њ–Љ, –≤ —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Д–µ–љ–Є–ї–Љ–µ—В–Є–ї—Б—Г–ї—М—Д–Њ–љ–Є–ї—Д—В–Њ—А–Є–і–Њ–Љ. –Ь–Њ–ґ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М —В–∞–Ї–ґ–µ –Ї–Њ–Љ–Љ–µ—А—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л —Д–Є–±—А–Њ–љ–µ–Ї—В–Є–љ–∞. –§–Є–±—А–Њ–љ–µ–Ї—В–Є–љ –њ—А–Є–Љ–µ–љ—П—О—В –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 1 вАФ 5 –Љ–Ї–≥ –љ–∞ 1 —Б–Љ3 –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–є –њ–Њ—Б—Г–і—Л.
1. –†–∞—Б—В–≤–Њ—А—П—О—В –њ—А–Є –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ–Љ –њ–Њ–Љ–µ—И–Є–≤–∞–љ–Є–Є 20 –Љ–Ї–≥ –ї–Є–Њ—Д–Є–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ —Д–Є–±—А–Њ–љ–µ–Ї—В–Є–љ–∞ –≤ 1 –Љ–ї –±–Є–і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і—Л.
2. –Я–Њ–Ї—А—Л–≤–∞—О—В –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ –і–љ–Њ —З–∞—И–Ї–Є –і–Є–∞–Љ–µ—В—А–Њ–Љ 35 –Љ–Љ –Є –≤—Л—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ –њ—А–Є 40 ¬∞–°.
3. –Ґ—Й–∞—В–µ–ї—М–љ–Њ –њ—А–Њ–Љ—Л–≤–∞–µ—В —З–∞—И–Ї–Є –і–Є—Б—В–Є–ї–ї–Є—А–Њ–≤–∞–љ–љ–Њ–є –≤–Њ–і–Њ–є –Є –≤–љ–Њ–≤—М –≤—Л—Б—Г—И–Є–≤–∞—О—В –љ–∞ –≤–Њ–Ј–і—Г—Е–µ. –У–Њ—В–Њ–≤—Л–µ —З–∞—И–Ї–Є –Љ–Њ–ґ–љ–Њ —Е—А–∞–љ–Є—В—М –њ—А–Є –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А–µ –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Б—П—Ж–µ–≤.
| 















